http://www.chemistrymag.org/cji/2007/095024pc.htm |
May 14,
2007 Vol.9 No.5 P.24 Copyright |
(1College of Chemistry & Environmental Science, Hebei University, Baoding 071002; 2College of Chemistry & Environmental Science,South China Normal University, Guangzhou 510631 China)
Abstract Alginate microcapsule containing
germicide flusilazole dissolved in liquid paraffin oil, were prepared by emulsification
external gelation and the potential use as an sustained release system were investigated.
Microcapsule formation involved dispersing germicide flusilazole into alginate solution.
The dispersion was then emulsified in liquid paraffin oil to form an O/W/O multiple phase
emulsion. Addition of an oil soluble ethanol calcium chloride adduct released calcium from
ethanol adduct calcium for gelation of the alginate. Parameters studied included alginate
concentration, and membrane formation time etc. Mean diameters ranging from 2.0 to 8.0 mm and encapsulation yields ranging from
60 to 80% were obtained. Sustained release was observed, and can keep homogeneous release
rate in more than twelve days at room temperature 25ºC.So the slow rate of release
from the alginate microcapsule was felt good suited as a delivery vehicle for oil soluble
germicide flusilazole.
Keywords microcapsule; muplicate emulsification; flusilazole; sodium alginate;
sustained release
(1河北大学化学与环境科学学院,河北保定071002;2华南师范大学化学与环境学院,广东广州510631)
2007年4月10日收稿
摘要
本文讨论了以正丙醇氯化钙加合物作为海藻酸钠的交联剂,通过复乳化法(O1/W/O2)制备氟硅唑海藻酸钠微胶囊的实验条件及其缓释性能。氯化钙正丙醇加合物能够溶解在液体石蜡中,并把钙离子释放在水相中,使海藻酸钠交联生成氟硅唑海藻酸钙微胶囊。考察了海藻酸钠的浓度、交联时间等因素对包埋率的影响。微胶囊的粒径在2.0微米~8.0微米之间,包埋率达到60.0%~80.0%,能够在12天内保持基本稳定的释放速率。关键词 微胶囊;复乳化;氟硅唑;海藻酸钠;缓释
1 前言
以往农药微胶囊的囊壁材料大都采用不能够生物降解的聚脲、聚胺酯等,其囊壁给环境造成了新的污染。然而海藻酸钠是可生物降解的天然高分子,与钙离子的交联产物同样可以在环境中生物降解,符合我国农药的发展趋势和实际要求。
氟硅唑是一种优良唑类杀菌剂,可以有效防治苹果黑星病菌、白粉病菌、禾谷类的白粉黑腔菌、壳针孢属菌、葡萄钩丝壳菌、葡萄球座菌、以及甜菜等多种作物上的各种病原菌。我国登记的单剂制剂只有40%乳油,但是乳油用有机溶剂配制而成,其中有机溶剂污染环境,破坏生态平衡,增加药害危险性。氟硅唑微胶囊化可以克服乳油的缺陷,同时降低对人体的接触毒性、减少药害危险性、加大载药量、隔绝外界不利因素的影响。缓释作用可以提高氟硅唑的药效、减少喷药次数。氟硅唑微胶囊化在将来的农业病害控制方面将会有很好的应用前景。
2 实验部分
Span-80、Tween-80、正丙醇、海藻酸钠、无水氯化钙、液体石蜡、十二烷基磺酸钠(均为分析纯)、氟硅唑(含量95%以上)。
2.2 实验操作步骤与产品纯化
实验步骤:适量海藻酸钠逐渐加入到100毫升40℃的蒸馏水中(含Tween-80,2.0%,W/V;十二烷基磺酸钠0.5%,W/V),得2.0%(W/V)海藻酸钠水溶液(溶液A)。溶液A升温到60℃,加入适量的氟硅唑,机械搅拌1小时,得氟硅唑海藻酸钠初乳(乳状液B)。液体石蜡加热至60℃,加入适量Span-80,机械搅拌30分钟(溶液C)。溶液C降温至20℃,机械搅拌下加入乳状液B(20℃),慢慢升温到40℃,机械搅拌30分钟。加入适量的无水氯化钙正丙醇加合物溶液,继续搅拌35分钟,反应结束。减压蒸馏出体系中的部分正丙醇,离心分离出微胶囊。
产品纯化:用1.0%Tween-80和0.5%氯化钙水溶液洗涤三次,再用热的无水乙醇洗涤三次。采用减压抽滤热无水乙醇淋洗的洗涤方式。40℃真空干燥至恒重。
2.3 分析检测方法
红外光谱分析:采用KBr压片法,傅立叶红外光谱仪(VECTOR22 BRUKER)测定。
形貌测试:微胶囊用离子溅射仪(JFC-1100E JEOL)镀金,扫描电子显微镜(JSM-5400 JEOL)观测拍照。
粒度分布:超声波分散器(4710SERIES COLE-PARMER)分散微胶囊于水中,25℃用激光衍射粒度分布仪(ZETASIZER300HS MANERN)测定。
载药量包埋率测定:取一定量的海藻酸钠氟硅唑微胶囊,加入0.1moL/L的盐酸50.0毫升,电磁搅拌24小时,然后加入100毫升的无水乙醇,继续搅拌24小时。用紫外可见分光光度计(WFZ800-D3A 北京第二光学仪器厂)检测溶液中氟硅唑的量,波长λ=262.0nm。结果表明,载药量可达到30.0~50.5%,包埋率可达到60.0~80.0%。
释放性能检测:取一定量微胶囊于100毫升水中,每隔24小时过滤分离出微胶囊,然后加入蒸馏水定容。量取一定量滤液,高速离心除去少量悬浮微胶囊,紫外可见分光光度仪检测溶液中氟硅唑的量。
累积缓释性能检测:取一定量微胶囊于100毫升水中,每隔24小时取5毫升检测水中氟硅唑的含量。第一天每6小时检测一次释放的量,以后24小时检测一次释放含量。
3 结果与讨论
海藻酸钠的浓度、乳化剂的类型及用量、复乳化机械搅拌速度、无水氯化钙正丙醇加合物的浓度和体系固化交联的温度等对微胶囊的成型、包埋率、载药量、粒径尺寸及缓释性能有很大的影响。因素考察如表1。
表 1 因素水平表
Table 1 Factor level table
因素 |
水平 |
|||
海藻酸钠浓度 %(W/V) |
0.5 |
1.0 |
2.0 |
3.0 |
| 无水氯化钙正丙醇浓度 %(W/V) | 5.0 |
10.0 |
15.0 |
20.0 |
乳化剂用量 %(W/V) |
0.5 |
1.0 |
2.0 |
3.0 |
固化交联温度 ℃ |
15 |
20 |
30 |
50 |
氯化钠加入量 %(水溶液W/V) |
0.0 |
0.5 |
1.0 |
1.5 |
初乳搅拌速度 ×103 rpm |
2.0 |
2.5 |
3.0 |
3.5 |
复乳搅拌速度 ×103 rpm |
1.2 |
1.5 |
1.8 |
2.1 |


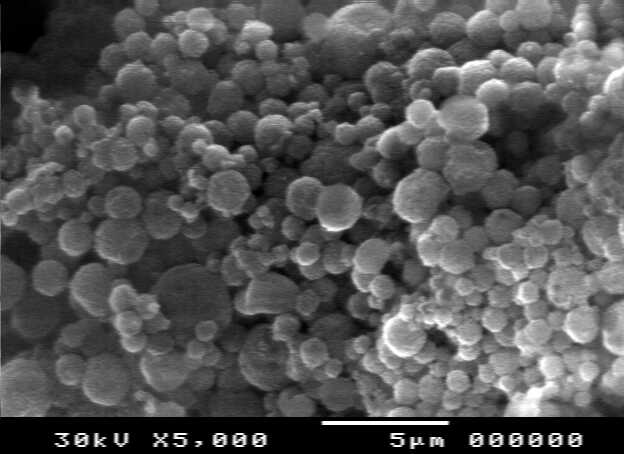
a b

c
图1 不同浓度海藻酸钠所得微胶囊的SEM图片
Fig.1 SEM pictures of microcapsules formed with sodium alginate of different concentration
a:1.0%(W/V);b:2.0%(W/V);c:3.0%(W/V)
图
1可知:海藻酸钠的浓度在2.0%(W/V)时,制备的微胶囊的形貌较好。微胶囊颗粒尺寸在2.0微米到8.0微米之间,呈现规则的球形,颗粒完整性较好。粒径尺寸有一定的分布宽度。较高的浓度和较低浓度制备的微胶囊形貌都不理想。虽然1.0%(W/V)海藻酸钠形成的微胶囊粒径较小,但是其载药量比较低,释放速度过快,没有缓释功能。制备稳定的初乳和复乳需要合适的表面活性剂种类及合适的浓度。非离子表面活性剂[5]Tween-80和Span-80有较高的乳化性能,同时是可以生物降解的绿色环保乳化剂。乳化剂的浓度如果低于0.5%,形成的初乳液在复乳化时容易破乳。乳化剂浓度高于3.0%,形成的液滴较小,造成载药量的降低。
乳化搅拌速度对微胶囊的形成和微胶囊的粒径影响很大。要获得粒径均一的液滴,不但需要适当的表面活性剂,而且需要合适的机械剪切力。单乳化(O/W或者W/O)的搅拌速度越高液滴越小,但是复乳化(O1/W/O2或者W1/O/W2)的搅拌速度和乳化液滴的大小不具有简单的线形关系。复乳液的液滴结构(O1/W/O2)要求初乳的液滴尺寸比复乳液滴尺寸小很多,这样形成的复乳液才可能具有足够的稳定性。如果复乳化时的搅拌速度过高,氟硅唑(O1)表面包裹的海藻酸钠层(W)在机械剪切力的作用下很快变薄破裂,导致氟硅唑进入外油相形成W/O液滴。如果复乳的搅拌速度比初乳的搅拌速度低一个数量级,复乳液滴形成多芯型核壳结构。实验表明:初乳的搅拌速度为2000~3500 rpm形成的乳液比较稳定。复乳搅拌速度1200 rpm~1800 rpm形成的乳液比较稳定;复乳化时搅拌速度高于2100 rpm容易破乳,低于1000 rpm时形成的颗粒呈不规则球形。复乳化时不同搅拌速度下SEM微胶囊粒径大小变化如图2。

d e


f g
图2 不同搅拌速度所得微胶囊SEM图片
Fig.2 SEM pictures of microcapsules formed at different rotational speed
d:1200(rpm);e:1500(rpm);f:1800(rpm);g:2100(rpm)
图
2 可知:在一定的搅拌速度范围内复乳的搅拌速度和微胶囊粒径大小成反比,搅拌速度越大微胶囊粒径越小。但是搅拌速度高于一定值时,复乳液发生破乳现象,生成片状物;搅拌速度低于某一值时,微胶囊形成不规则球形。非凝胶金属离子氯化钠可以使海藻酸钠凝胶反应缓和,但是会造成海藻酸钙膜上有较大的孔洞[4,6],使包埋的小分子泄漏。本实验发现不加入氯化钠制备的微胶囊表面致密(图 3 h),而加入氯化钠制备的微胶囊表面不够致密(图 3 i)。
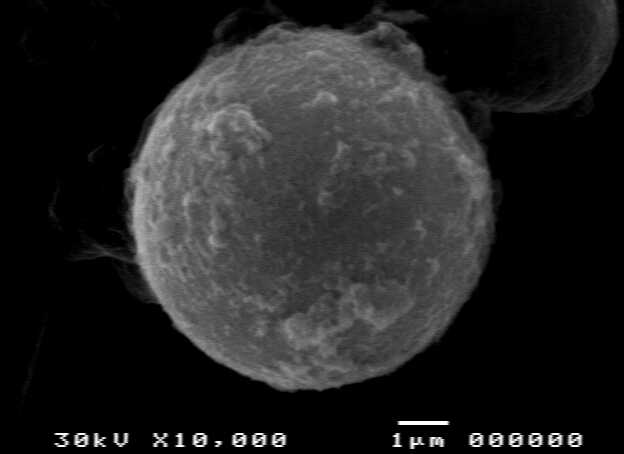

h
i
图3
Fig.3 Shape of single microcapsule
固化交联的温度对包埋率和载药量
[7]的影响很大。包埋物氟硅唑溶于热的液体石蜡,复乳化的温度如果超过50℃包埋率会下降到20.0%,温度在20℃包埋率最可高达到80%,但是乳化温度在高于35℃时制备的微胶囊的球形较规则。乳化液中加入电解质会影响乳液的稳定性。但是正丙醇有助表面性剂作用,能吸附在界面上降低界面张力,抵消了氯化钙的消极影响,使复乳液的稳定性增加。过量的正丙醇会溶解包埋物氟硅唑。无水氯化钙正丙醇加合物的最佳浓度为20.0%(W/V)。
3.2
微胶囊表征分析氟硅唑海藻酸钠微胶囊的红外图谱中没有氟硅唑的特征吸收峰。原因是:无水氯化钙正丙醇加合物进入氟硅唑海藻酸钠液滴程度较深,生成的空间网状结构比较致密。红外光不能透过这种致密的膜,氟硅唑的苯环及杂环上的双键的电子也就不能吸收能量发生跃迁。如图4。
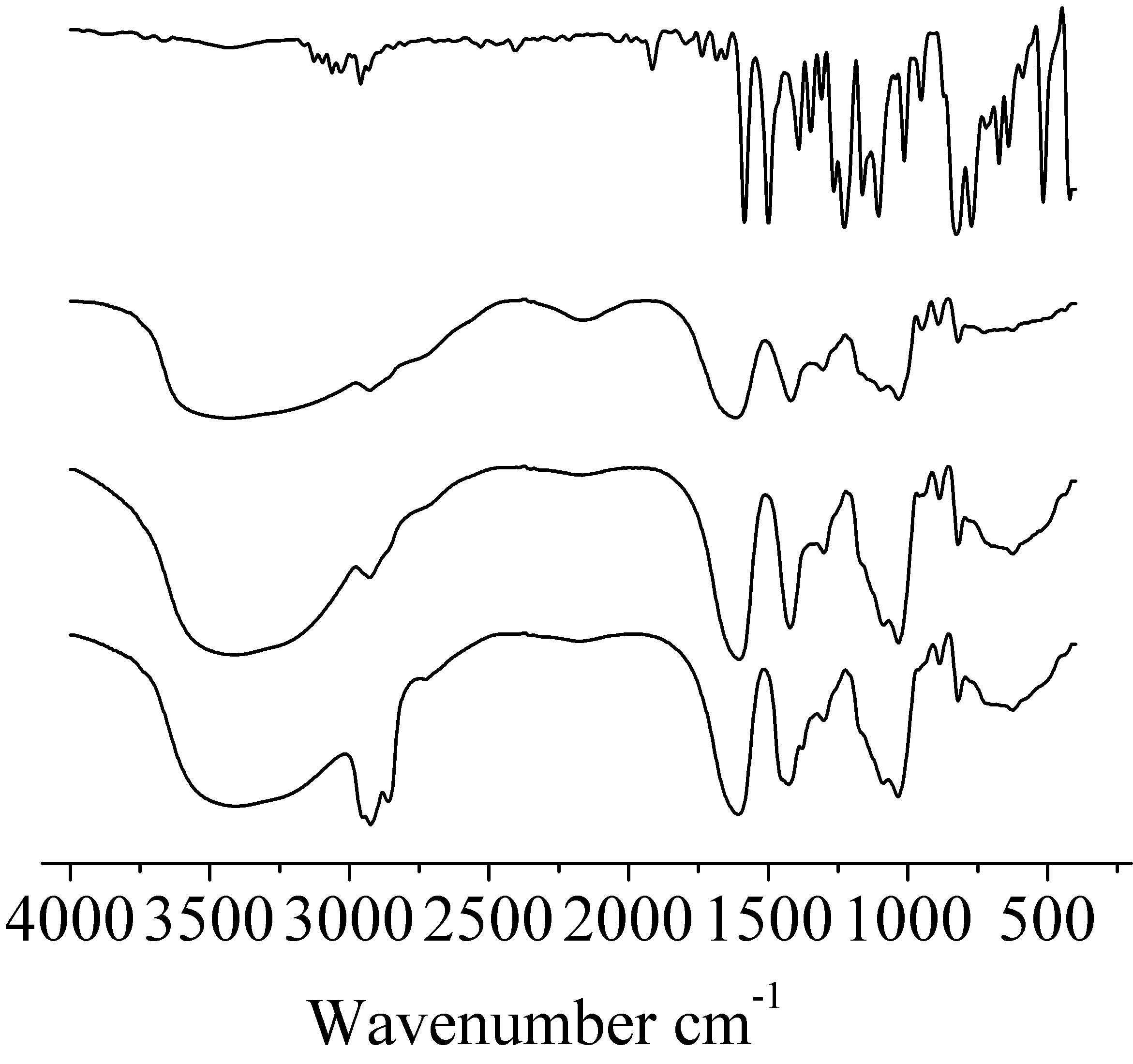
图4 红外光谱图
Fig.4 FTIR of flusilazole,sodium alginate, microsphere and microcapsule
红外谱图从上而下依次是,氟硅唑、海藻酸钠、海藻酸钙微球、氟硅唑海藻酸钙微胶囊的红外谱图。用激光衍射粒度分析仪和SEM对微胶囊的粒度及形貌进行分析。如图5。激光衍射数据计算可知微胶囊平均粒径为4.78mm。粒径尺寸分布和SEM照片(图1 b)表现值基本一致。
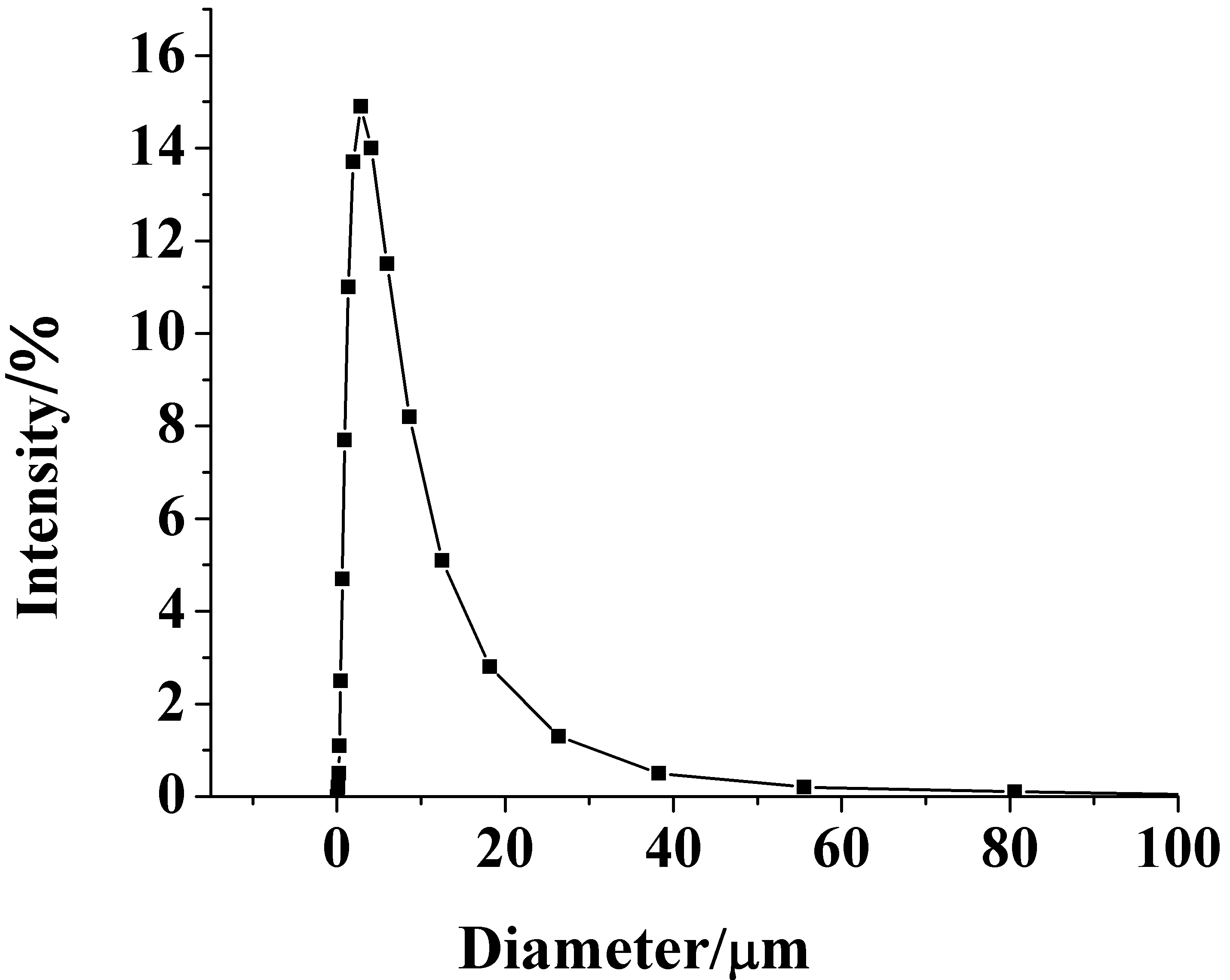
图 5 激光衍射粒度粒度分布图
Fig.5 Size distributions of 2.0% alginate microcasules by
ZETASIZER
2.3
微胶囊缓释性能测定每天的释放曲线如图6,累积释放曲线如图7。
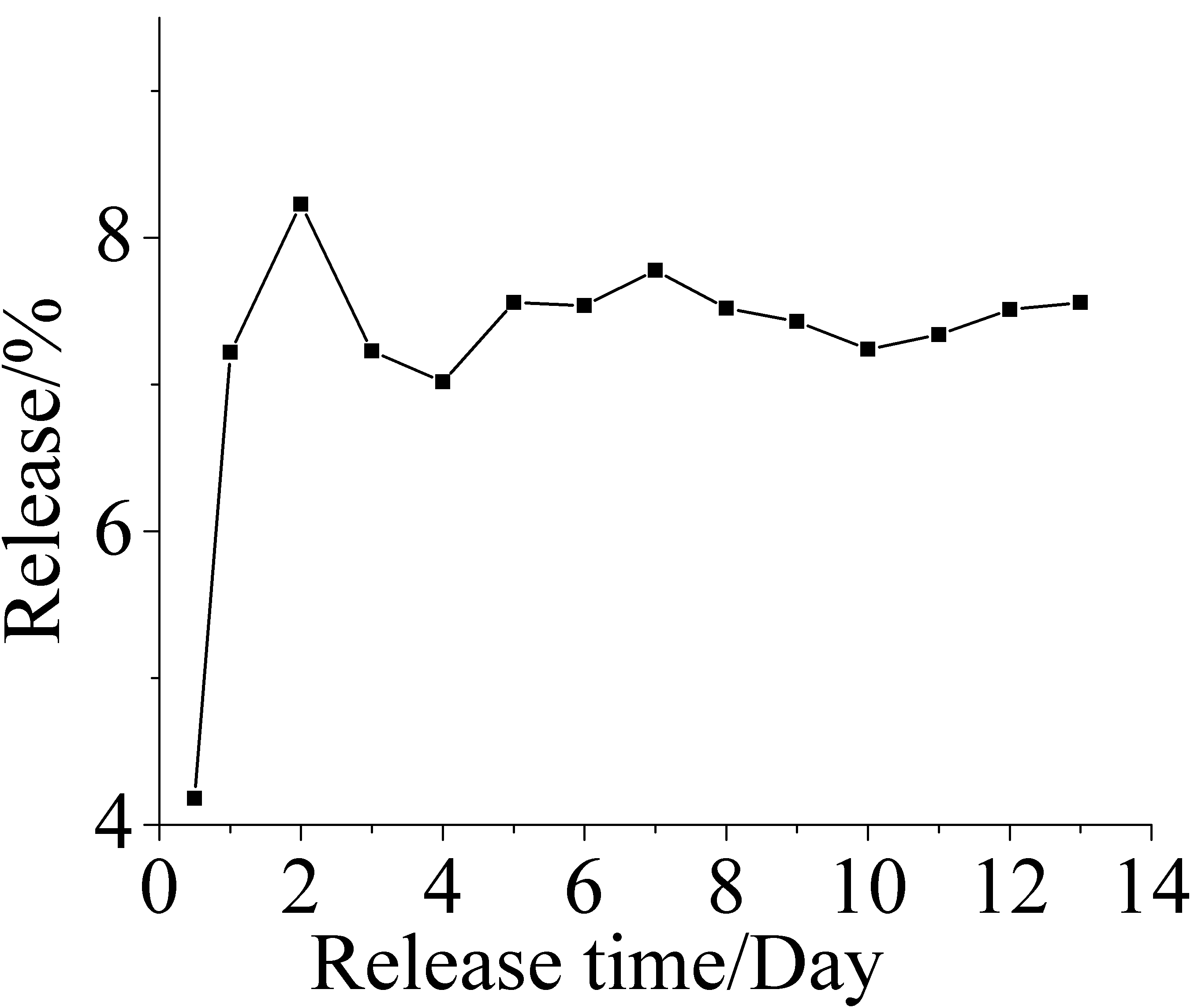
图6 氟硅唑海藻酸钙微胶囊释放曲线
Fig.6 Release of flusilazole calcium alginate microcapsules
微胶囊12天内每天释放的量基本一致,有一定的缓释效果。在第2天的释放有一个最高峰,是常见的微胶囊轻微暴释[8]造成的。第5、6、7三天的释放量有所升高,可能是表面部分海藻酸钙解离造成的。第8、9、10三天的释放有所降低,可能是微胶囊内部的氟硅唑的量减少造成的。第11、12、13三天的释放有所上升,可能是大量的海藻酸钙解离造成的。
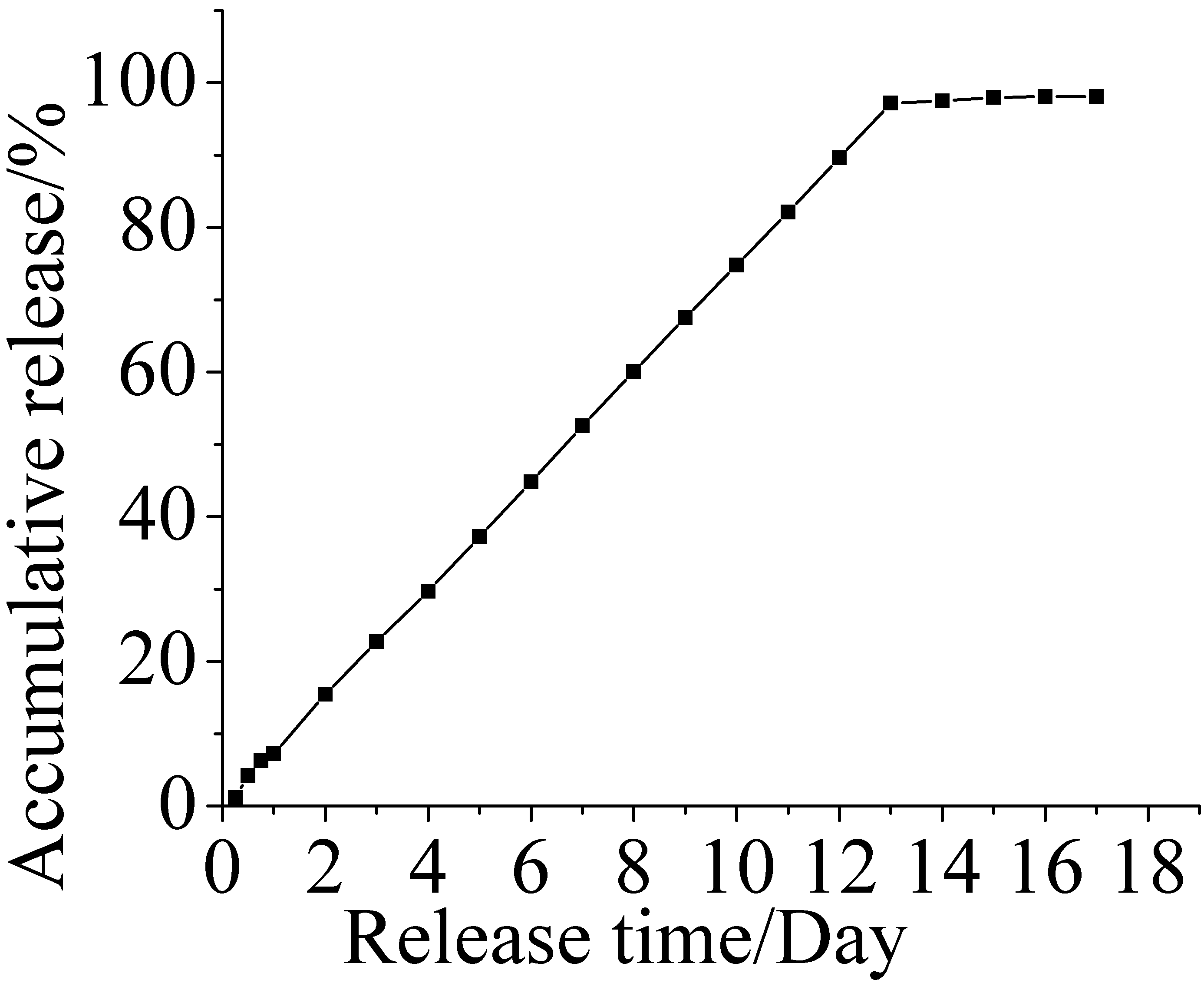
图7 氟硅唑海藻酸钠微胶囊累积释放曲线
Fig.7 Accumulative release of flusilazole calcium alginate microcapsules
图7可知,累积释放的量和时间有一定的线性关系。
40%氟硅唑乳油的施用稀释倍率是8000~10000倍。40%氟硅唑乳油稀释后的浓度和氟硅唑原药在水中的溶解度(45毫克/升25℃)基本一致。氟硅唑海藻酸钠微胶囊每天的释放量为7%左右,基本均一的释放速度可以维持12天左右,适当的稀释倍率同样可达到40%氟硅唑乳油的施药杀菌浓度。由于微胶囊的粒径较小,密度和水较相近,可以配制成适合田间作业的悬浮液。微胶囊具有很好的生物黏附性,可以很好的黏附在作物的页面枝茎上。缓释性能良好的氟硅唑微胶囊可以大大减少施药次数,降低人工成本,提高药效。由于微胶囊囊壁具有一定的厚度,还可以保护内部的氟硅唑不受雨水冲刷、温度、紫外线等不利因素的影响。
目前国内还没有氟硅唑微胶囊化的相关报道,国际上液只有水分散粒剂(WG)悬乳剂(SE)、水乳剂(EW),悬浮剂(SC)和有关微乳剂等混配制剂的报道。复乳化法制备氟硅唑海藻酸钠微胶囊,在理论上可以满足氟硅唑微胶囊工业化大规模生产的需要。
3
结论海藻酸钠的浓度和搅拌速度对微胶囊的成型和形貌影响最大,只有合适的海藻酸钠浓度和合适的搅拌速度才可以制备出形貌和粒径分布均理想的微胶囊。海藻酸钠非凝胶盐的加入会使囊壁上生成孔洞,是微胶囊能否有缓释性质的关键所在。所以应该避免此类盐的加入。
氟硅唑海藻酸钠微胶囊优化后的制备条件是:海藻酸钠浓度:2.0%(W/V); Tween-80乳化剂:2.0%(W/V);Span-80乳化剂:1.5%(W/V);无水氯化钙在正丙醇的浓度:20.0%(W/V);交联时间:30分钟;初乳搅拌速度:3000 rpm;复乳搅拌速度:1200~1500 rpm。FTIR和SEM数据表明此条件下制备的微胶囊具有良好的形貌,粒径较小(平均4.78μm)、表面光滑致密、球形规则。包埋率和载药量数据测量表明此条件下制备的微胶囊具有理想的包埋率和载药量。每天缓释曲线和累积缓释曲线表明此条件下制备的微胶囊具有良好的性能,缓释时间较长释放速度均匀,在12天内能保持每天7%基本均一的释放速度。所以氟硅唑微胶囊具有很好的实际应用前景。
无水氯化钙正丙醇加合物作为交联剂,使外源法大规模制备海藻酸钙微胶囊在理论上成为可能。氯化钙正丙醇加合物作为交联剂,复乳化制备海藻酸钠的微胶囊的方法,同样适用于一些其它油溶性小分子的缓释性微胶囊的包埋。可以推广到食品、化妆品、医药、影像等领域。 REFERENCES
[1] Poncelet D. Production of alginate beads by emulsification/internal gelation. Annuals of the New York Academy of Sciences 2001. 944: 74-82.
[2] Poncelet D, Smet B P D, Beaulieu C et al. Appl. Microbiol. Biotechnol. 1995, 43: 644-650.
[3] Chan L W, Lee H Y, Heng P W S. International Journal of Pharmaceutics. 2002, 242 (1-2): 259-262
[4] Liu LS, Liu S Q, Ng S Y et al. Journal of Controlled Release 1997, 43 (1): 65-74.
[5] Wan L S C, Heng P W S, Chan L W. International Journal of Pharmaceutics 1994, 103 (3): 267-275.
[6] Ribeiroa A J, Neufeld R J, Arnaudc P et al. International Journal of Pharmaceutics 1999, 187 (1): 115-123.
[7] Machlufa M, Regevb O, Peleda Y et al.. Characterization of microencapsulated liposome systems for the controlled delivery of liposome-associated macromolecules. Journal of Controlled Release. 1997, 43 (1): 35-45.
[8] Nikhil O. Dhoot L, Margaret A. et al.. Microencapsulated liposomes in controlled drug delivery: Strategies to modulate drug release and eliminate the burst effect. Journal of Pharmaceutical Sciences. 2002, 92 (3): 679-689.