http://www.chemistrymag.org/cji/2008/108039nc.htm
Aug.
1, 2008 Vol.10 No.8 P.39 Copyright ![]()
http://www.chemistrymag.org/cji/2008/108039nc.htm |
Aug.
1, 2008 Vol.10 No.8 P.39 Copyright |
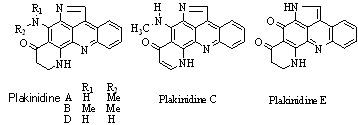
Synthesis of 1-chloro-9-methylacridine-2,4-diamine
Yu Xiaosong1,2, Li Depeng1,2,
Wang Ailing1,2, Liu Dianqing1,2, You Yecheng1,2
(1 College
of Environment and Chemical Engineering, Dalian University, Dalian, 116622; 2
Liaoning Key Laboratory of Bio-Organic Chemistry, Dalian University, Dalian, 116622)
Abstract Two synthesis methods of an
intermediate of Plakinidine D were introduced in this article. 1-(2-(5-
chloro-2,4-dinitrophenylamino)phenyl)ethanone cyclized in F3CSO3H to
give 1-chloro-9-methylene-2,4-dinitro- 9,10-dihydroacridine.
1-chloro-9-methylene-2,4-dinitro-9,10-dihydroacridine reseted in DBU to give 1-chloro-9-
methyl-2,4-dinitroacridine. Reduction of 1-chloro-9-methyl-2,4-dinitroacridine created
1-chloro-9-methyl-2,4- dinitroacridine. And this compound was synthesized by cyclization
of N,N'-(1-chloro-9-methylacridine- 2,4-diyl)diacetamide.
Keyword Plakinidine; Cyclization; 1-chloro-9-methylacridine-2,4-diamine
摘要 本文介绍了Plakinidine D中间体9-甲基-2,
4-二氨基-1-氯吖啶的两种合成方法。2,4-二硝基-5-氯-2’-乙酰基二苯胺在三氟甲磺酸中关环得到9,10-二氢-9-亚甲基-2,4-二硝基-1-氯吖啶,该化合物在DBU中重排得到9-甲基-2,4-二硝基-1-氯吖啶,然后还原得到9-甲基-2,
4-二氨基-1-氯吖啶。2,4-二硝基-5-氯-2’-乙酰基二苯胺还原得到2,4-二氨基-5-氯-2’-乙酰基二苯胺,将其氨基保护得到2,4-二乙酰胺基-5-氯-2’-乙酰基二苯胺,该化合物在浓硫酸-醋酸体系中关环得到9-甲基-2,
4-二乙酰胺基-1-氯吖啶,然后除去氨基保护基得到9-甲基-2, 4-二氨基-1-氯吖啶。
关键词 普莱克尼定 傅克关环 9-甲基-2, 4-二氨基-1-氯吖啶
1.1仪器与试剂
仪器:核磁共振仪(BRUKER ADVANCE500),IR-408红外光谱仪(岛津)。
试剂:间二氯苯(AR),邻氨基苯乙酮(AR),浓盐酸,还原铁粉,浓硫酸(98%),乙酸(AR),乙酸酐(AR),无水乙醇(AR),硝酸钾(AR),碳酸钾(AR),三氟甲磺酸(AR),1,8-二氮杂二环(5.4.0)十一烯(DBU)(AR),硅胶(层析用,200-300目),石油醚(AR),乙酸乙酯(AR)。
1.2 合成实验
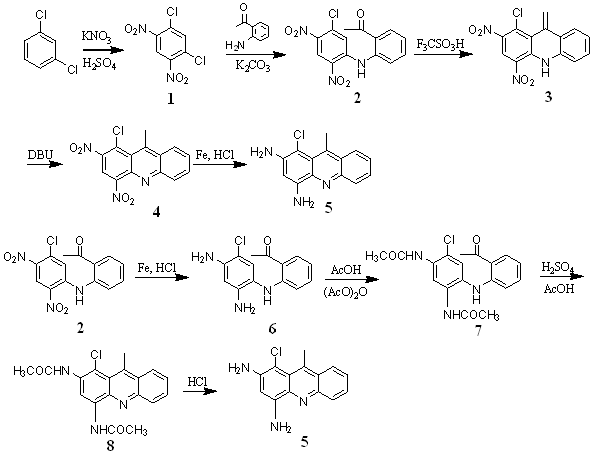
1.2.1 化合物1的合成[7]
向配有回流冷凝器的250mL的单口烧瓶中,加入7.31g间二氯苯(0.05mol),25.00g硝酸钾和80ml浓硫酸。在不断搅拌的条件下,缓慢升温至80℃,反应30min。然后再升温至130℃,反应4h。将混合液倒入冰水中,出现淡黄色沉淀。过滤,水洗(100ml×3),固体用无水乙醇重结晶,得到片状淡黄色固体,产量为10.82g,产率为91.1%。
1.2.2 化合物2的合成
向配有回流冷凝管的250ml单口烧瓶中,加入2.37g化合物1,1.35g邻氨基苯乙酮,0.70g碳酸钾和80ml水。回流反应10h。将反应物倒入100ml冷水中,静置半小时得到红色固体。过滤,固体水洗三次(50ml×3)。经硅胶柱分离(石油醚:乙酸乙酯=8:1),得到黄色固体2.48g,产率73.9%。
1.2.3 化合物3的合成
向配有干燥管的50ml单口烧瓶中加入20ml三氟甲磺酸,3.35g
化合物2,40℃下反应8h。然后将反应物缓慢倒入100ml冰水中,得到褐色固体。过滤,水洗(50ml×3)。硅胶柱分离(石油醚:乙酸乙酯=10:1),得到红色固体0.11g,产率3.5%。
1.2.4 化合物4的合成
向配有干燥管的10ml单口烧瓶中加入4ml DBU,0.20g 化合物3,40℃下搅拌24h,然后将反应物倒入50ml冷水中,用石油醚萃取(20×3),合并有机相,有机层用无水硫酸镁干燥。蒸干溶剂得到化合物4,0.17g,产率85.0%。
1.2.5 化合物6的合成
向配有电动搅拌器和回流冷凝管的250ml三口烧瓶中加入1.67g化合物2,5.6g还原铁粉,80ml水和3ml浓盐酸,搅拌回流3h。然后将混合液倒入500ml烧杯中,加入200ml乙酸乙酯,搅拌20min,静置,待固体沉淀后过滤,滤液分层并取出有机层。干燥后将乙酸乙酯蒸除,得到褐色油状物,柱色谱分离(石油醚:乙酸乙酯=5:1)得到黄色絮状固体1.08g,产率76.4%。
1.2.6 化合物7的合成
向配有回流冷凝管的100ml烧瓶中加入2.75g化合物6,3ml乙酸酐,30ml乙酸回流反应3h。然后将混合物倒入100ml冷水中,静置2h得到黄色絮状沉淀。过滤,固体水洗3次(20ml×3)。干燥后得到黄色沉淀3.49g,产率97.2%。
1.2.7 化合物8的合成
向100ml的烧瓶中加入3.60g化合物7,40ml乙酸和5ml浓硫酸,100℃反应1h。然后较混合液倒入200ml冷水中,得到棕色沉淀。静置待固体沉淀后过滤,固体水洗3次(20ml×3)。干燥后柱色谱分离(石油醚:乙酸乙酯=5:1),得到黄色固体1.97g,产率为57.8%。
1.2.8 化合物5的合成
方法一:向配有回流冷凝管的50ml烧瓶中加入0.16g化合物4,1g还原铁粉,20ml水和1ml浓盐酸,搅拌回流2h。然后将反应混合液倒入100ml烧杯中,加入30ml乙酸乙酯,搅拌半小时,过滤,滤液分层,取出有机层,干燥后蒸除乙酸乙酯得到褐色油状物,经柱色谱分离(石油醚:乙酸乙酯=5:1)得到黄色固体。
方法二:向配有回流冷凝管的100ml烧瓶中加入1.7g化合物8,5ml浓盐酸,30ml水,回流反应10小时。冷却后用10%NaOH溶液中和,待固体沉淀后过滤,固体水洗三次(20ml×3)。然后柱色谱分离(石油醚:乙酸乙酯=5:1)得到黄色固体0.92g,产率71.6%。
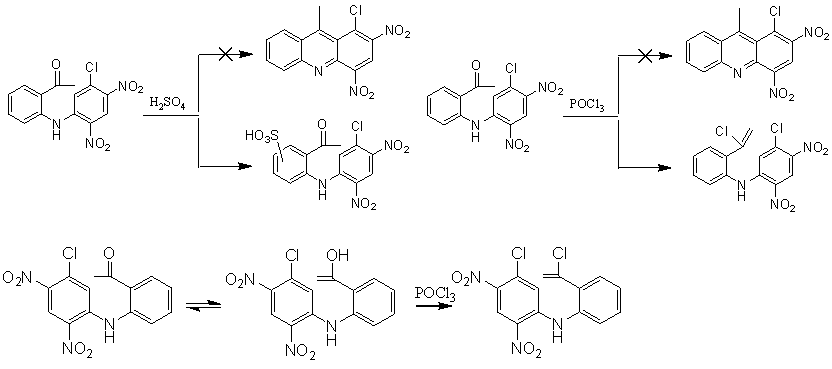
化合物2难以发生关环反应的主要原因是,2中要参与成环的苯环上联了两个硝基和一个氯,这三个基团都是强吸电子基团。三个吸电子基团的钝化作用使2难以发生关环反应。2与硫酸作用时,关环非常困难,相比之下,磺化反应相对容易发生,因此只发生了磺化反应。2与三氯氧磷作用时,也没有关环,而生成了氯代产物,其作用原理可能是:2中的酮羰基先重排为烯醇式结构,然后POCl3与烯醇羟基发生氯代反应,取代羟基生成2,
4-二硝基-5-氯-2’-(1-氯乙烯基)二苯胺。
方法二先将硝基还原,然后又制得7,该化合物容易关环得到8,且产率较高。8水解得到5。虽然方法二比方法一多出一步,但产率仍大于方法一。
REFERENCES
[1] Wayne D. Inman, Mark O'Neill-Johnson.J. Am. Chem. Soc. 1990. 112. 1-4.
[2] West, R. R.; Mayne, C. L. Tetrahedron Lett. 1990, 31, 3271-3274.
[3] Cameron J. Smith, Debra A. Venables, Plakinidine D. J. Nat. Prod. 1997, 60, 1048-1050.
[4] Paul W. Ford, Bradley S. Davidson, Plakinidine D. J. Nat. Prod. 1997, 60, 1051-1053.
[5] R Paul, S Laura, C G Nadine, etal. J. Org. Chem. 2007, 70, 95―99.
[6] Yoshiyasu Kitahara, Tomomichi Mizuno. Tetrahedron 2004, 60, 4283–4288.
[7] Wolfgang Knobloch, Hartmut Niedrich. Chemische Berichte, 1958,91, 2562-2566.
[8] J Rosewear,JFK Wilshire. Australian Journal of
Chemistry.1981,34(4):839-853.