http://www.chemistrymag.org/cji/2004/062012nc.htm |
Feb.1, 2004 Vol.6 No.2 P.12 Copyright |
Tai Xi 1,2, Li Haitao 1,
Hu Qiufen 1,2, Yang Guangyu 2, Huang Zhangjie 2, Yin
Jiayuan 2
(1 Department of Chemistry and Environment
Science, Yuxi Teacher's College, Yuxi 653100; 2 Department of Chemistry, Yunnan
University, Kunming 650091, China)
Abstract The color reaction of
2-(2-quinolinylazo)-4-methyl-1,3-dihydroxidebenzene (QAMDHB) with cadmium was studied. In
the presence of pH=8.0 buffer solution and TritonX-100 medium, QAMDHB can react with
cadmium (II) to form a stable 2:1 complex (QAMDHB:
Cd(II)). The molar absorptivity is 1.01×105 L.mol-1.cm-1
at 560 nm. Beer's law is obeyed in range of 0-1.0 mg/ml. The cadmium ion in samples can be enriched and separated by
solid phase extraction with anion exchange resin cartridge. This method was applied to the
determination of cadmium in water and food with good results.
Keywords 2-(2-quinolinylazo)-4-methyl-1,3-dihydroxidebenzene; cadmium;
spectrophotometry; solid phase extraction
2-(2-喹啉偶氮)-4-甲基-1,3-二羟基苯固相萃取光度法测定镉的研究
台 希1,2,李海涛1,胡秋芬1,2,杨光宇2,黄章杰2,尹家元2
(1玉溪师范学院化学与环境科学系,玉溪653100; 2云南大学化学系,昆明650091) 2003年11月23日收到,云南省教育厅(011143)和玉溪师范学院科研基金(02476)资助项目
摘要 研究了新试剂2-(2-喹啉偶氮)-4-甲基-1,3-二羟基苯(QAMDHB)与镉的显色反应,在pH=8.0的硼酸-氢氧化钠缓冲介质中,TritonX-100存在下,QAMDHB与镉反应生成2:1稳定络合物,体系最大吸收波长lmax=560 nm,摩尔吸光系数 e
=1.01×105 L.mol-1.cm-1,样品中的镉用强阴离子交换固相萃取柱固相萃取预分离和富集后用该方法测定,结果令人满意。关键词 2-(2-喹啉偶氮)-4-甲基-1,3-二羟基苯;镉;光度法;固相萃取
镉是重要的环境元素,因此环境样品中镉含量的测定具有重要意义[1,2],目前用杂环偶氮类试剂光度法测定镉有很多报道[3-5],但是杂环偶氮类试剂对镉选择性较差,而且对于一些镉含量低的样品(如环境水样和生物样品)普通光度法灵敏度也不能满足于测定的要求。固相萃取技术在分析化学中得到了广泛应用,该技术具有富集倍数高,能有效地分离干扰的特点[6-8];因此我们研究了2-(2-喹啉偶氮)-4-甲基-1,3-二羟基苯(QAMDHB)与镉的显色反应及用强阴离子交换固相萃取柱预分离和富集样品中的镉,建立了一种测定水样和生物样品中镉含量的新方法。
1 实验部分
1.1 主要仪器和试剂
UV-2401紫外可见分光光度计(日本岛津公司),1 cm比色皿;强阴离子交换固相萃取柱(7× 30 mm;30 mm) 见图1。在装填管的一端装上筛板,装入粒度为30 mm 的季胺型阴离子交换树脂并压实,然后在另一端装上筛板,拧紧柱冒就装好 (填料购于美国安捷仑公司);pHS-3C型精密pH计(上海雷磁仪器厂生产)。
镉标准储备液:1.0 mg/mL,购于国家标准物质研制中心,使用时用10%盐酸稀释成1.0 mg/mL 的标准工作液;pH=8.0的硼酸-氢氧化钠缓冲溶液;QAMDHB 按文献[9]的方法合成,使用时用95%的乙醇配成0.1%的溶液;1%的TritonX-100溶液,用10%乙醇配制。
1.3 实验方法
取适量标样或样品溶液(总含镉<10 mg),用氯化钠调节氯离子浓度约为2.0 mol/L左右),以10 mL/min 的流速通过预活化好的强阴离子交换固相萃取柱,过完柱后以10 mL/min 的流速用50 mL 0.2 mol/L的盐酸洗脱小柱分离锌;然后颠倒小柱,反方向用5 ml 0.1 mol/L的硝酸以 5 ml/min 的流速洗脱于小柱上富集的镉,洗脱液收集于10 ml比色管中,调pH到近中性,加入0.5 ml 1%的TritonX-100溶液,2 ml pH=8.0的硼酸-氢氧化钠缓冲溶液,0.5 ml 0.1% QAMDHB溶液,定容到刻度,充分摇匀,放置10 min,以试剂空白为参比,用1 cm比色皿,于560 nm处测定吸光度。
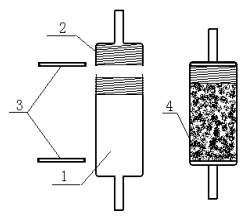
图1 强阴离子交换固相萃取柱
Fig.1 Anion exchange resin cartridge
(1) 聚四氟乙烯装填管(带螺纹) (Tube for fill in resin),(2)聚四氟乙烯柱冒(带螺纹) (Screw cap for sealing the tube),(3) 筛板 (Sieve plate),(4)强阴离子交换树脂 (Anion exchange resin)
2 结果与讨论
2.1 吸收光谱
吸收曲线见图2, 配合物最大吸收波长为560 nm,
试剂空白最大吸收波长为452 nm,Dl
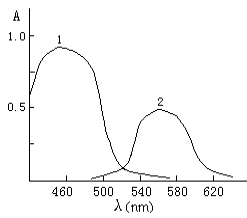
图2 吸收光谱
Fig.2 Absorption spectra
1 试剂空白对蒸馏水 (Reagent blank against
water);2 显色体系对试剂空白 (Colored system against water)
2.2 显色酸度的选择
试验了酸度对显色反应的影响,试验表明在pH7.2-9.8范围内配合物吸光度最大且恒定,因此实验选用pH=8.0的硼酸-氢氧化钠缓冲溶液控制酸度,用量在2.0
ml内可把pH控制在适宜范围。
2.3 表面活性剂的作用
体系在水介质中溶解度较差,用表面活性剂增溶可增加体系的稳定性,实验表明非离子型表面活性剂TritonX-100对体系有较好的增溶作用,TritonX-100用量在0.3-1
ml内增溶效果好且吸光度稳定,实验选用0.5 ml。
2.4 显色剂用量选择
实验表明,显色剂用量在0.3-1.2 mL内吸光度最大且稳定,实验选用0.5
mL。
2.5 显色时间及体系的稳定性
体系在室温下迅速显色,放置5 min左右吸光度可达到稳定,显色完全后体系至少可稳定8
h以上。
2.6 固相萃取
镉离子可在大量氯离子存在下和氯离子生成[CdCl4]2-络阴离子,可被强阴离子交换剂富集,并可和Fe3+,V(V),Zn2+,Co2+,Ni2+,
Cu2+,Mn2+ 等干扰元素分离[10]。常规离子交换柱装柱、富集和洗脱操作都较麻烦,且常规树脂粒度过大,导致交换柱柱效很低,镉和树脂之间的离子交换和脱附速度都比较慢,有时还会交换不完全影响回收率,且洗脱时需要的洗脱液体积大,富集倍数较低。因此我们研究了用Waters
SPE 真空提取装置和筛板式固相萃取柱(树脂粒度30 mm)
固相萃取富集和预分离镉。用Waters SPE
真空提取装置,每次可同时处理20个样品,小柱洗涤和样品富集的流速均为10
mL/min。萃取柱先用2 mol/L的盐酸20 mL 洗涤,然后再用2 mol/L的氯化钠溶液20
ml洗涤后即可用于镉的富集。
镉是以[CdCl4]2-络阴离子形式被吸附到阴离子交换树脂上,因而,样品溶液中氯离子浓度对镉吸附的程度有重要的影响。为了确定最佳上柱氯离子浓度,用镉离子浓度为0.25
mg/mL的溶液,用氯化钠调整至不同的氯离子浓度过柱。实验表明当氯离子浓度在1.5-2.5
mol/L时镉能较完全的富集在固相萃取柱上,因此实验选择过柱氯离子浓度为2.0
mol/L。
配制镉离子浓度为 3.0 mg/mL (用氯化钠调节氯离子浓度为 2.0 mol/L)的溶液过柱,实验表明当过柱溶液达100
mL时镉离子都不会发生穿漏,说明小柱对镉离子的萃取容量至少可达300
mg,在本实验中镉离子的浓度小于10
mg,远远低于小柱的萃取容量,因此不会发生穿漏现象。
该实验条件下除镉外,锌也能在小柱上富集,实验表明小柱富集完后先用0.2
mol/L的盐酸洗脱可让小柱上富集的锌络阴离子完全洗下,而镉络阴离子仍然保留在小柱上,再用0.1
mol/L硝酸洗脱小柱可让镉洗下,这样可达锌和镉分离。实验表明,当小柱上富集的锌约为100
mg,镉为10 mg时,用50 mL 0.2 mol/L的盐酸洗脱小柱可让锌完全洗下;分离锌后用0.1
mol/L的硝酸洗脱小柱上富集的镉,如果以正方向洗脱,需20 mL以上的洗脱剂才能把小柱上富集的镉完全洗下,如果富集完后颠倒小柱反方向洗脱,用5
ml左右的洗脱剂就可把富集在柱上的镉完全洗下,大大缩小了洗脱液的体积。因此实验选择富集完后用5
ml 0.1 mol/L的硝酸反方向洗脱。
2.7 工作曲线
在选定实验条件下,Cd(II)含量在0-1.0mg/ml范围内符合比耳定律,线性回归为A
= 0.0146 +0.885CCd (mg/mL), r=0.9996,从回归方程可算出摩尔吸光系数 e=1.01×105 L.mol-1.cm-1。
2.8 络合物组成的测定
由摩尔比法和连续变化法可测得络合物中Cd2+与QAMDHB摩尔比为1:2。
2.9共存离子的影响
对于5 mg Cd(II),相对误差为±5%,下列量离子不干扰(mg):NH4+,Na+,Cl-,PO43-,SO42-
(40);Ca2+,Mg2+,Al3+,B(Ⅲ),AsO3-
(10);SiO32-,Ba2+,Ce (IV),Cr3+ (1);Cr(Ⅵ),Mo(Ⅵ),W(VI),Ti(IV),Sb(III)
(0.2);La(III),Th(IV),Pb2+,Mn2+,Sn(VI) (0.05);Ni2+,
Hg2+,Ag+,V(V),Cu2+ (0.01);Pd2+,Co2+,Fe3+,Zn2+,Bi(III)
(0.005);常见元素Fe3+,V(V),Zn2+,Co2+,Ni2+,Cu2+,Mn2+
干扰严重,但用强阴离子交换固相萃取可分离这些元素,不再干扰镉的测定,体系选择性好。
3 样品分析及结果
清洁水样取500 mL
用盐酸酸化,用氯化钠调节氯离子浓度约为2.0 mol/L,按实验方法测定,并用原子吸收法作对照,结果见表1。
取食品样品1.0 g于聚四氟乙烯微波消化瓶中,加入5 mL浓硝酸和10
mL30%的过氧化氢,于微波消化炉中消解15 min;消解完后于电热板上加热蒸发到近干,再加入5
mL的盐酸(1+1)和20 mL 2.0 mol/L的氯化钠溶液加热溶解盐类,冷却后按试验方法测定,并用原子吸收法作对照,结果见表1。
表1
样品分析及结果
Table 1 Determination
results of the Samples
试样 |
测定值 |
AAS法 |
RSD% |
标准回收率(Recovery)% |
湖水(Lale Water) |
6.86( mg/L) |
6.52( mg/L) |
2.6 |
105 |
自来水(Tap Water) |
1.24( mg/L) |
1.35( mg/L) |
3.5 |
97 |
大米(Rice) |
0.247( mg/g) |
0.228( mg/g) |
2.8 |
98 |
面粉(Flour) |
0.452(mg/g) |
0.436( mg/g) |
2.5 |
102 |
REFERENCES
[1] Chen F. Chinese Journal of Hygiene Research (Weisheng YanJiu).1991, 20 (6): 31.
[2] Yang X E, Yang M J. Guangdong Trace Elements
Science.1996, 3 (7): 1.
[3] Ye Q Y, Jiang J H,Tang F L. Chinese Journal of Analytical Science (Fenxi Kexue
Xuebao). 2002, 18 (5): 406.
[4] Wang X J, Wang B L. Chinese Journal of Analytical
Chemistry (Fenxi Huaxue). 2001, 29 (4): 396.
[5] Yang G Y, Zhang C M, Hu Q F, Yin J Y. Journal of Chromatographic Science. 2003,
41 (4): 195.
[6] Hu Q F, Yang G Y, Yin J Y. Talanta. 2002, 57 (4): 751-756.
[7] Li, Z, Yang G Y, Wang B X, Jiang C Q, Yin J Y. Journal of Chromatography A. 2002, 971
(1/2): 243.
[8] Hu Q F, Yang G Y, Dong X C, Yin J Y. Analytical Letters. 2002, 35 (5): 1735-1745.
[9] Gao X Y, Li Y K, Hu Q F et al. Chinese Journal of Physical and Chemical Analysis,
Chemical Analysis Part (Lihua Jianyan Huaxue Fence). 2003, 39 (10): 864.
[10] Mao J J, Zhu D C et al. The Enrichment and
Separation Method in Trace Inorganic Elements. Shanghai, Fudan University Press, 1995,
517.