http://www.chemistrymag.org/cji/2004/06a068pc.htm |
Oct. 1,
2004 Vol.6 No.10 P.68 Copyright |
Determination of residues of organochlorine pesticides in soil by solid-phase extraction and capillary gas chromatography
Yan Zheng, Feng Di, Li Shenjie, Zhao Yakui(College of Chemistry and Environmental Science, Hebei University, Baoding 071002, China)
Abstract The Solid-Phase Extraction and the capillary GC method was introduced for determination of organochlorine pesticide residues in soil. The organochlorine pesticide residues were extracted from soil with mixed solvents (Petroleum ether+ n-hexane), cleaned up by Florisil solid-phase extraction column,separated by capillary column SPB-5 (30m×0.25mm×0.25m
m ) and detected by ECD. The other conditions are as follows: carrier gas N2 (99.999%,1.5mL/min); split ratio:1:2.2; injector temperature 220ºC; detector temperature 330ºC; column temperature program: 100ºC, rate of 20ºC min-1 to 190ºC (hold 1.0 min), rate of 4ºC min-1 to 235ºC (hold 7 min).The average recoveries were within 94.2-105.3% and RSD 1.1-7.6%.Keywords Capillary gas chromatography; Solid phase extraction; Soil; Organochlorine pesticides 固相萃取毛细管气相色谱法测定土壤中的多种有机氯农药残留量
阎正,封棣,李申杰,赵亚奎
(河北大学 化学与环境科学学院,保定 071002)
摘 要 建立了土壤中有机氯类农药残留量的固相萃取-毛细管气相色谱(SPE-CGC)分析方法。样品以正己烷-丙酮用超声波提取,Florisil(1g)固相萃取小柱快速净化提取物。采用SPB-5弹性石英毛细管柱分离样品,GC-ECD检测13种有机氯农药的残留量。方法的线性范围为1.26×10-10~2.24×10-7g/mL;
最小检测量为6.4×10-11~6.1×10-10g/mL;加样平均回收率为94.2~105.3%(RSD为1.1~7.6%)。
关键词 毛细管气相色谱法;固相萃取;土壤;有机氯类农药
2004年6月6日收稿; 河北省科学技术厅博士基金项目(03547023D)
有机氯类农药(OCPs)由于大多具有“三致”(致癌、致畸、致突变)效应和遗传毒性,并且在全球范围的各种环境介质(海洋、土壤等)以及动植物组织器官和人体中广泛存在,已经引起了世界各国的广泛关注,成为全球性环境问题。其中六六六(a-、b-、g-、d-BHC)以及滴滴涕(pp'-DDE、pp'-DDD、op'-DDT、pp'-DDT)已被美国环保总署(EPA)列入优先检测的有机污染物“黑名单”,而狄氏剂(DIE)、异狄氏剂(Endrin)、艾氏剂(ALD)、七氯(HEPT)被联合国环境规划署(UNEP)列为首批控制的有机污染物[1-4]。因此,环境样品中OCPs残留的分析一直是环境污染分析的一大热点。在环境农药检测的方法研究中,常用的柱层析净化法虽成本较低,但既费时间又费溶剂并且重现性不好[5,6],而固相萃取法(SPE)虽然小柱成本较高,但因其高选择性、使用方便快速、回收率高、溶剂用量少、重复性好、便于自动化操作等突出的优势开始担当越来越重要的角色。如朱九生等用硅胶小柱和GC法快速测定土壤中的氯氰菊酯残留[7],万袆等用C18小柱和GC-MS法检测环境中痕量农药类内分泌干扰物质[8],刘长武等用Florisil小柱和CGC法快速检测了果蔬中的25种有机氯农药残留[9]。近年来,在对土壤中OCPs 残留测定的方法研究中,SPE-GC法也有不少报道,如谭英武等研究了C18、硅藻土、硅胶、Al2O3小柱对稻田泥土等土壤样品的净化[10]、丘耀文等用硅胶小柱对大亚湾海域的沉积物进行了净化[11]。本方法将Florisil(1g)固相萃取商品小柱用于中草药种植土壤的净化,毛细管气相色谱外标法对土壤中13种有机氯农药的残留量进行了分析研究,丰富了土壤中OCPs的固相萃取研究方法。该法简便高效、灵敏准确,具有广泛的应用前景。 1 实验部分
1.1 主要仪器及试剂
仪器:SP-6000气相色谱仪;63Ni-ECD 检测器(北京分析仪器厂);5200H型超声波清洗器(上海科导超声仪器有限公司);旋转薄膜蒸发器(天津玻璃仪器厂);CS50型超级恒温器(重庆试验设备厂);离心机(河北吴桥电机厂); SPB-5(30m×0.25mm×0.25mm)弹性石英毛细管柱(SUPELCO);固相萃取柱Florisil(1g)购于Varian公司;35 mL具塞离心试管(日本理化学器械株式会社)。试剂:丙酮(AR,重蒸,天津新同精细化工有限公司);石油醚(AR,60℃-90℃重蒸,天津化学试剂有限公司);正己烷(AR,重蒸,天津市大茂化学仪器供应站);无水硫酸钠(AR, 650℃灼烧5h,冷却后在干燥器中密闭保存,河北省保定化学试剂厂)。
有机氯农药标准品:六六六(a-、b-、g-、d-BHC);滴滴涕(pp'-DDE、pp'-DDD、op'-DDT、pp'-DDT);七氯(HEPT);艾氏剂(ALD);环氧七氯(HCE);狄氏剂(DIE);异狄氏剂(Endrin)农药标准溶液 (全国标准样品委员会北京应天意标准品有限公司),浓度均为0.10mg/mL,纯度均为99%。农药标准品用石油醚稀释成适用浓度的标准储备液,室温密闭保存。
实验样品:中草药种植土壤样品共7个,由安国药市办公室提供。
1.2 样品制备
土壤样品:将土壤样品自然风干,研细后过60目筛,备用。空白样品:取一定量的土壤样品于坩埚中,置于650℃的马弗炉中煅烧2h,自然冷却,放入干燥器中备用。
1.3 样品处理
提取:准确称取过筛后的土壤样品5g放入35mL具塞试管中,与3g无水硫酸钠混匀,加30mL 正己烷-丙酮(1∶1),超声提取0.5h,离心5min。残渣重复提取一次。提取液合并于100mL梨形瓶中,40℃水浴旋转蒸发至0.5mL,待净化。
净化:用5mL丙酮-正己烷(1:9)活化Florsil固相萃取柱(1g),再加5ml正己烷平衡柱子。把样品加到已活化好的固相萃取柱上,调节流速使其逐滴流下,用正己烷少量多次洗涤梨形瓶(约2mL),加到柱头上,用15mL具塞刻度离心试管收集。用丙酮-正己烷(1:9)淋洗小柱,收集洗脱液共15mL,45℃水浴氮吹浓缩至干,加石油醚至2mL,以备GC-ECD测定。
1.4 色谱条件
色谱柱:SPB-5(30m×0.25mm×0.25mm)弹性石英毛细管柱;载气:(高纯N2)1.4mL/min(恒流方式);尾吹:(高纯N2 )20mL/min;进样分流比 1:2.2;进样量1mL;进样口温度220℃;检测器温度330℃;柱升温程序:初始温度100℃,以20℃/min升至190℃后,保持1min,4℃/min升至235℃,保持7min;外标法定量。 2 结果与讨论
2.1 提取方法和提取溶剂的选择
研究证明,超声波提取较经典的索氏提取而言既可节约大量溶剂,又可节约大量时间,从而提高提取效率;快速离心法的使用既可使溶剂和样品快速分层,又可避免过滤法中因过滤所导致的损失。
实验了乙腈、二氯甲烷-丙酮作为提取剂,但乙腈、二氯甲烷成本高、毒性大、污染环境,且乙腈沸点高不易浓缩。本文用成本低污染小的正己烷:丙酮(体积比为1:1)作为提取剂得到了令人满意的回收率。
2.2 固相萃取因素分析
有关样品的固相萃取处理技术已有不少研究[12,13]。一种好的固相萃取方法,首先取决于固定相对杂质与待测组分之间的选择性。其次,与固定相的用量、洗脱剂的强度、体积和流速等因素相关。
2.2.1固定相的选择
Florsil填料被广泛用于柱层析净化法中,但此法繁琐费时,溶剂用量大,且重复性不好。固定相选择主要依据固定相对杂质与待测组分之间的选择性。与常用的C18小柱的作用机理相反,Florsil固相萃取小柱是正相固相萃取,Florsil填料对样品中的色素等极性杂质有很强的吸附,而流过柱子的是有机氯等非极性和弱极性的待测组分,且待测组分的极性与固定相极性差别越大净化效果越好。
2.2.2固定相用量的选择
填料有一定的载样量,超负荷上样,会影响回收率和正相固相萃取中的净化效果。应先根据最终待测液恰当的分析浓度确定待测品的取样量,再根据背景杂质量的大小来确定固定相用量。用量不足,干扰组分不能充分除去;用量太大,相应的洗脱剂用量也要增大。本研究中,从样品净化液的颜色及样品的色谱图来看,实验所用的Florsil(1g)固相萃取小柱,对所测的7种土壤样品均得到了良好的净化效果。
2.2.3洗脱剂及用量的选择
洗脱剂的选择直接关系到测定结果的回收率。溶剂极性太强,会洗下一些更强保留的杂质组分;溶剂极性太弱,有些待测组分不能被洗脱完全。由于待测的13种有机氯农药为非极性和弱极性,因此应尽量选择非极性或弱极性的溶剂作为洗脱剂。实验表明,用二氯甲烷洗脱的杂质较多,单用正己烷不能将待测组分洗脱完全。用正己烷-丙酮作为洗脱剂效果好。进一步实验了不同配比的正己烷-丙酮的洗脱效果,以体积比为9:1为最好。作洗脱曲线确定洗脱剂的用量为15mL。
2.2.4洗脱剂流速的选择
溶剂流过固相萃取柱的流速过高净化效果不好,流速过低又耗时太长。经过实验,本法选择流速为0.5mL/min。
2.3 标准曲线、线性范围与最小检测量
用石油醚将农药标准品配制成不同浓度的标准溶液在所确定的色谱条件下进行测定,取1mL进样,以十三种有机氯农药的浓度对标准品峰面积做线性回归分析,得标准曲线、线性范围及最小检测量,见表1。有机氯农药标准品色谱图如图1。
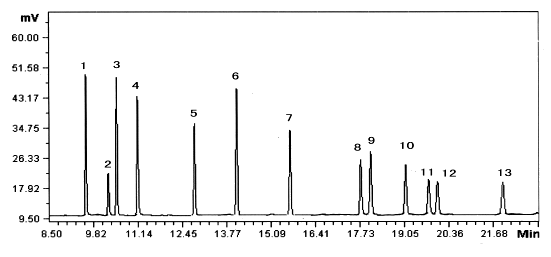
图 1 有机氯农药标准品色谱图
Fig. 1 Chromatogram of standard of organochlorine pesticide
1.a-BHC;2.b-BHC;3. d-BHC;4. g-BHC;5. HEPT;6. ALD;7. HCE;
8. pp'-DDE;9. DIE;10. Endrin;11. pp'-DDD;12. op'-DDT;13. pp'-DDT
表1 标准曲线方程、线性范围及最小检测量
Table 1 Standard curve equation, correlation
coefficient, linear range and minimum detection
农药 |
标准曲线方程 |
相关系数 |
线性范围(g/mL) |
最小检测浓度(g/mL) |
a-BHC |
Y=2.4328x+0.2278 |
0.9995 |
4.47×10-10~1.00×10-7 |
9.3×10-11 |
b-BHC |
Y=0.7929x+0.6467 |
0.9998 |
5.01×10-10~1.43×10-7 |
3.4×10-10 |
g-BHC |
Y=2.2155x-0.9645 |
0.9985 |
4.44×10-10~1.17×10-7 |
1.5×10-10 |
d-BHC |
Y=2.2155x-0.9645 |
0.9999 |
1.41×10-10~1.12×10-7 |
1.1×10-10 |
pp'-DDE |
Y=1.3373x+1.2235 |
0.9987 |
4.01×10-10~1.99×10-7 |
3.3×10-10 |
pp'-DDD |
Y=1.0886x+0.9508 |
0.9993 |
5.20×10-10~1.86×10-7 |
4.2×10-10 |
op'-DDT |
Y=1.1662x+0.0390 |
0.9997 |
5.82×10-10~1.78×10-7 |
4.9×10-10 |
pp'-DDT |
Y=1.1756x+0.2303 |
0.9996 |
6.40×10-10~1.80×10-7 |
6.1×10-10 |
HEPT |
Y=2.0215x-0.1171 |
0.9983 |
2.82×10-10~1.11×10-7 |
1.1×10-10 |
HCE |
Y=3.0358x+2.2615 |
0.9994 |
1.26×10-10~8.91×10-7 |
8.1×10-11 |
ALD |
Y=1.4314x+1.9369 |
0.9997 |
2.51×10-10~7.94×10-7 |
6.4×10-11 |
DIE |
Y=1.8528x-0.1313 |
0.9994 |
4.47×10-10~2.24×10-7 |
3.3×10-10 |
Endrin |
Y=1.2686x+0.5333 |
0.9996 |
3.98×10-10~1.58×10-7 |
1.7×10-10 |
X-Concentration of the standard;Y-Peak area of the standard
2.4 方法加样回收率和精密度
准确称取同一空白土壤样品9份,分别加入一定量标准品溶液,3个添加水平,每个添加水平3份,按“1.3”和“1.4”项操作进行测定,计算平均回收率及相对标准偏差。结果见表2。
表2 回收率测定
Table 2 Recovery
农药 |
回收率(%) |
平均回收率 |
RSD |
||
Ⅰ |
Ⅱ |
Ⅲ |
|||
a-BHC |
98.7 |
100.9 |
90.0 |
96.5 |
6.0 |
b-BHC |
101.7 |
93.2 |
95.5 |
96.8 |
6.0 |
g-BHC |
97.0 |
103.0 |
104.8 |
101.6 |
4.0 |
d-BHC |
95.7 |
98.8 |
88.0 |
94.2 |
5.9 |
pp'-DDE |
102.4 |
101.0 |
98.5 |
100.6 |
2.0 |
pp'-DDD |
103.0 |
102.9 |
107.3 |
104.4 |
2.4 |
op'-DDT |
98.2 |
92.9 |
93.2 |
94.8 |
3.1 |
pp'-DDT |
95.1 |
96.8 |
97.7 |
96.5 |
1.4 |
HEPT |
99.4 |
98.8 |
93.9 |
97.4 |
3.1 |
HCE |
98.8 |
103.1 |
102.5 |
101.5 |
2.3 |
ALD |
96.2 |
97.6 |
110.1 |
101.3 |
7.6 |
DIE |
97.2 |
96.2 |
98.4 |
97.3 |
1.1 |
Endrin |
108.6 |
101.7 |
105.5 |
105.3 |
3.3 |
Added:I:28.0ng/g; II:14.0ng/g; III:2.8ng/g
2.5 样品的测定
准确称取7种不同的土壤样品,按“1.3”项处理后以“1.4”项操作进行测定,以外标法定量,土壤样品色谱图如下,农药残留量测定结果见表3
。
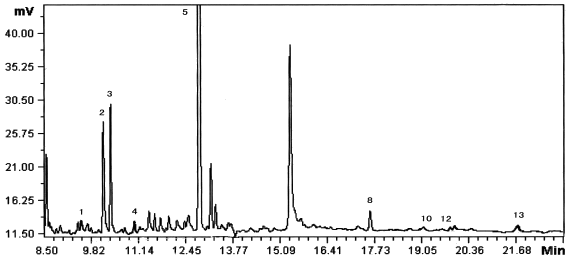
图 2 土壤样品局部色谱图
Fig. 2 Part amplify chromatogram of soil
1.a-BHC;2.b-BHC;3. d-BHC;4. g-BHC;5. HEPT;6. ALD;7. HCE;
8. p,p'-DDE;9. DIE;10. Endrin;11. p,p'-DDD;12. o,p'-DDT;13. p,p'-DDT
表3 7种土壤样品中有机氯农药残留量的测定
Table 3 Determination results of organochlorine pesticide
residues in seven soil samples (ng/g)
农药 |
土壤样品 |
|||||||
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S7 |
S8 |
|
a-BHC |
33.44 | 18.08 |
4.13 |
28.27 |
10.80 |
44.91 |
4.49 |
144.12 |
b-BHC |
133.56 |
60.03 |
47.71 |
87.93 |
64.28 |
82.15 |
50.47 |
526.13 |
g-BHC |
18.70 |
10.99 |
3.01 |
7.43 |
10.21 |
28.06 |
8.01 |
86.41 |
d-BHC |
ND |
3.78 |
15.06 |
6.87 |
17.78 |
52.40 |
8.27 |
104.16 |
总BHC |
185.60 |
92.80 |
69.91 |
130.50 |
103.07 |
207.52 |
71.24 |
860.64 |
pp'-DDE |
16.44 |
14.08 |
5.37 |
5.63 |
14.76 |
8.03 |
26.67 |
90.98 |
pp'-DDD |
ND |
1.84 |
ND |
0.52 |
8.08 |
ND |
ND |
10.44 |
op'-DDT |
15.38 |
3.80 |
0.78 |
1.04 |
20.47 |
ND |
7.05 |
48.52 |
pp'-DDT |
3.90 |
8.56 |
6.31 |
4.58 |
40.30 |
16.20 |
10.34 |
90.19 |
总DDT |
35.72 |
28.28 |
12.46 |
11.77 |
83.61 |
24.23 |
44.06 |
243.14 |
HEPT |
154.54 |
123.22 |
128.00 |
3.16 |
0.77 |
21.89 |
37.37 |
462.94 |
HCE |
ND |
0.63 |
ND |
0.30 |
15.33 |
ND |
ND |
16.26 |
ALD |
ND |
6.72 |
ND |
16.90 |
45.82 |
26.28 |
6.39 |
102.11 |
DIE |
4.00 |
0.77 |
ND |
ND |
11.16 |
ND |
ND |
15.93 |
Endrin |
ND |
3.52 |
ND |
1.07 |
95.59 |
16.89 |
2.43 |
119.5 |
ND: Not detected
2.4 结论
固相萃取SPE与色谱技术的联用实现了样品前处理及分离分析的优化组合,SPE既可作为单纯样品制备技术(离线分析),也可作为其他分析仪器的进样技术(在线分析)。由于CGC可以高效分离、快速、高灵敏度、高选择性地检验环境样品中痕量、复杂、多组分的有机污染物,因而目前SPE-CGC联用已成为最为成熟的联用方式[14]。在测定土壤中OCPs的固相萃取方法研究中,可以使用的柱填料有很多种,常用的有C18小柱、硅胶小柱等。本文建立了土壤中13种有机氯农药残留的Florsil固相萃取-毛细管气相色谱测定方法,丰富了土壤中OCPs的固相萃取研究方法。此法净化效果好,回收率高,操作简便省时,灵敏准确,测定结果令人满意。
从测定结果来看,13种有机氯农药残留在土壤中均有检出,总含量较高的是b-BHC、HEPT、a-BHC,最低的是pp'-DDD。有机氯农药杀虫效果显著,曾是各国用量最大的杀虫剂。作为一个农业大国,我国在20世纪50~80年代生产和使用的主要农药品种也是有机氯农药。当时,我国除了未生产艾氏剂、狄氏剂、异狄氏剂和灭蚊灵之外,曾大量使用BHC、DDT、HEPT等农药。有机氯农药虽早已被禁用,但其半衰期长、化学性质稳定、不易降解和代谢,因此长期积存于土壤中。植物在这样的土壤中生长,有机氯农药残留有可能由根部进入植物体内,对植物造成严重污染。所以在种植各种作物之前有必要对土壤进行农药残留量普查。
REFERENCES
[1] Jones K C, Voogt P de. Environmental Pollution,1999, 100 (1-3): 209-221.
[2] Yu G, Huang J, Zhang P Y et al. Environmental Protection (Huanjing Baohu), 2001, 4:
37-39.
[3] Simonich S L et al . Science, 1995, 269: 1851.
[4] Ma L L, Lao W J, Wang X T et al. Chinese Journal of Analytical Chemisty (Fenxi
Huaxue), 2003, 31 (9): 1025-1029.
[5] Zhu X M, Cui Y H, Guo L Q et al. Environmental Science (Huanjing Kexue), 2002, 23 (5):
113-116.
[6] Liu X M, Xu X R, Zhang X T et al. Marine Environmental Science (Haiyang Huanjing
Kexue), 2001, 20 (4): 40-44.
[7] Zhu J S, Qiao X W, Qin S et al. Environmental Chemistry (Huanjing Huaxue), 1997, 16
(2): 116-118.
[8] Wan Q, Hu J Y, Shao B. Environmental Science (Huanjing Kexue), 2002, 23 (Sup): 79-82.
[9] Liu C W, Liu F Z, Zhai G S et al. Acta Scientiae Circumstantiae (Huanjing Kexue
Xuebao), 2003, 23 (4): 499-502.
[10] ChenY W,Chen J, Yan H M et al. J. Wuhan Inst. Chem.Tech. (Wuhan Huagong Xueyuan
XueBao), 2003, 25 (4) : 1-3.
[11] Qiu Y W, Zhou J L, Maskaoui K et al. Marine Environmental Science (Haiyang Huanjing
Kexue), 2002, 21 (1): 46-51.
[12] Ma N, Chen L, Xiong F. Shanghai Environmental Sciences (Shanghai Huanjing Kexue),
2002, 21 (3): 181-188.
[13] Zhang S M, Yang K. Environmental Monitoring in China (Zhongguo Huanjing Jiance),
2000,16 (6): 53-57.
[14] Liu L L,Chen S, Ren R. Journal of Beijing University of Technology (Beijing Gongye
Daxue Xuebao), 2003, 29 (1): 68-72.