http://www.chemistrymag.org/cji/2005/073022pc.htm |
Mar.10, 2005 Vol.7 No.3 P.22 Copyright |
Chen Yunyun, Yang Jun, Li Mingyu#, Zhang Wanwen, Tang Yu, Zhang Yuanming
( Department of Chemistry
Abstract Rutile TiO2 was prepared by direct calcination of Ti mesh. The crystalline texture and morphology of the TiO2 film on Ti mesh were examined by X-ray diffractometer and scanning electronic microscopy respectively. The results indicated that,below 500 ºC calcined temperature, only amorphous TiO2 presented, whereas the rutile was the dominant component in the calcined temperature range of 550-700
ºC. Methyl orange was chosen to study photoelectro-catalytic properties of the TiO2/Ti mesh. The results showed that the samples calcined at 600 ºC had the highest photoelectro-catalytic activity, higher or lower calcination temperature would obviously lower the activity. The effect of electrical bias voltage on the photoelectron-catalytic degradation of methyl orange was also investigated. The results showed that activity increased with the increment of the electrical bias voltage. However, when the electrical bias voltage reached to 15 V, or more, it had insignificant effect on activity of TiO2/Ti mesh.Keywords Rutile, TiO2, Photoelectro-catalytic, Methyl Orange 金红石相二氧化钛光电催化降解甲基橙 陈芸芸,杨骏,李明玉#,张婉文,唐渝,张渊明
(暨南大学化学系;#暨南大学环境工程系,广州 510632)
2005
年1月12日收稿; 国家自然科学基金资助项目(20171018)摘要 用直接氧化法在金属
Ti网上制备出金红石相TiO2,采用X射线衍射仪、扫描电镜对Ti网表面TiO2膜的晶体结构和形貌进行检测。结果表明:500 ℃以下焙烧,所得氧化物主要为无定形的TiO2,550 ℃以上焙烧,金红石相TiO2是主要的相态。以甲基橙为降解物的模型化合物,研究了TiO2/Ti网的光电催化性能,结果表明:600 ℃焙烧的TiO2/Ti网具有最高的光电催化活性,温度过高或过低都会显著降低其催化活性。外加电压对光电催化反应的实验结果表明,外加电压的增强会促进甲基橙的降解,当电压超过15 V,外加电压的影响趋于缓慢。关键词 金红石相;二氧化钛;光电催化;甲基橙
自从
1972年Fujishma等发现TiO2单晶电极光分解水以来,半导体光催化材料已得到广泛的研究[1,2]。其中TiO2粉体和膜是两种最为常用的光催化剂。就粉体TiO2光催化材料而言,纳米和微晶的TiO2粉具有很高的比表面积和量子产率,因而受到众多研究者的青睐;但在光催化研究中,粉体由于难于与被处理体系分离,存在不易再利用的问题而不能得到广泛利用。采用TiO2膜可以有效地解决这一问题,但目前TiO2膜通常采用涂覆法制备,这种膜的抗磨损性差,容易脱落,因而该法也不可能应用于大规模的水或空气处理[3]。鉴于此,我们采用直接氧化金属Ti网的方法制备TiO2膜,该法不仅简单,而且TiO2膜是直接长在Ti网基质上的,具有较好的机械完整性,抗磨损性强。另外,针对TiO2膜比表面小和光催化活性较粉体低的问题,我们还在该膜上施加阳极偏压,考察了TiO2膜的光电催化性能。施加阳极偏压可以促使光生空穴-电子分离,从而提高光催化效率。外加电场的光电化学技术,是一种光催化与电化学氧化协同作用的新型氧化技术,也是目前研究废水中有机污染物降解领域的前沿课题,近年来引起了人们广泛的关注[4-8]。TiO2有三种晶相,其中亚稳相锐钛矿具有较高的光催化降解性能,在光催化方面的应用比较广泛;金红石相是热力学稳定相,具有较强的覆盖力、着色力和紫外线吸收能力,有广泛的应用前景[9,10]。过去普遍认为锐钛矿相的光催化活性优于金红石相,但高濂等报道金红石相TiO2粉体也具有很好的光催化作用,其光催化活性与P-25相当 [11]。
本文以甲基橙作为降解染料的模型化合物,研究了焙烧温度对TiO2/Ti网的晶相、形貌和光电催化活性的影响,并考察了外加电压对TiO2/Ti网降解甲基橙的促进作用。
1 实验部分
1.1 仪器与试剂
光源为GGZ-125 W型中压汞灯;电源为RYI-3003直流稳压电源;甲基橙的测定用Spectrumlab 22 pc 可见分光光度计;TiO2催化剂的制备采用KQ-100 DE型数控超声波清洗器,1010-2 B型电热鼓风干燥箱,SX 2-4-10高温箱型电炉;TiO2催化剂的表征采用MSAL XD-2型X射线衍射仪与JEOL JSM-T 300扫描电子显微镜。所用试剂均为分析纯,钛网由广州有色金属研究院提供。
1.2 催化剂的制备
将钛网放入HNO3:HF(体积比) = 3:1混合液中刻蚀30 s,再经丙酮和去离子水超声清洗至无白色溶出物,置于烘箱中200 ℃干燥2 h,取出,自然冷却后置于马弗炉中由室温以5 ℃/min升至所设定的温度,恒温3 h,得到不同焙烧温度的TiO2/Ti网[8]。
1.3 光电催化性能检测
光电催化反应在自制光电催化装置中进行。125 W的中压紫外汞灯作为光源,TiO2/Ti网作为正极,铜片作为负极。将80 mL的甲基橙水溶液(20 mg/L)置于玻璃夹套中进行反应,用自来水冷却,以90 ml/min的速度向溶液内鼓入空气。反应前打开紫外汞灯预热一段时间后,再将待测样品放入其中,进行光电催化反应,反应时间为120 min。每隔10 min 取样一次,用可见分光光度计测定甲基橙溶液浓度。
2 结果与讨论
2.1 TiO2/Ti网的SEM分析
图1为不同焙烧温度下的SEM。由图可见,未经焙烧的钛网表面基本平整且致密(图1a)。图1b-1d,Ti网经450 ℃到600 ℃,表面被部分氧化,明显可以看出凹凸不平的形貌,450 ℃和500 ℃焙烧样品未出现明显的规则晶体外貌;图1d,焙烧温度为600 ℃时,表面开始有立方状小晶粒的出现;图1e,700 ℃下焙烧,样品表面结晶致密度增大,出现晶粒团聚的情况,Ti网表面被小晶粒完全覆盖,表明其氧化、晶化的程度都已很高。
|
|
a |
b |
|
|
|
图1 不同温度焙烧下TiO2/Ti网的SEM
|
2.2 TiO2/Ti网的XRD分析
由JCPDS No.21-1276和No.21-1272得,金红石相TiO2特征峰的2
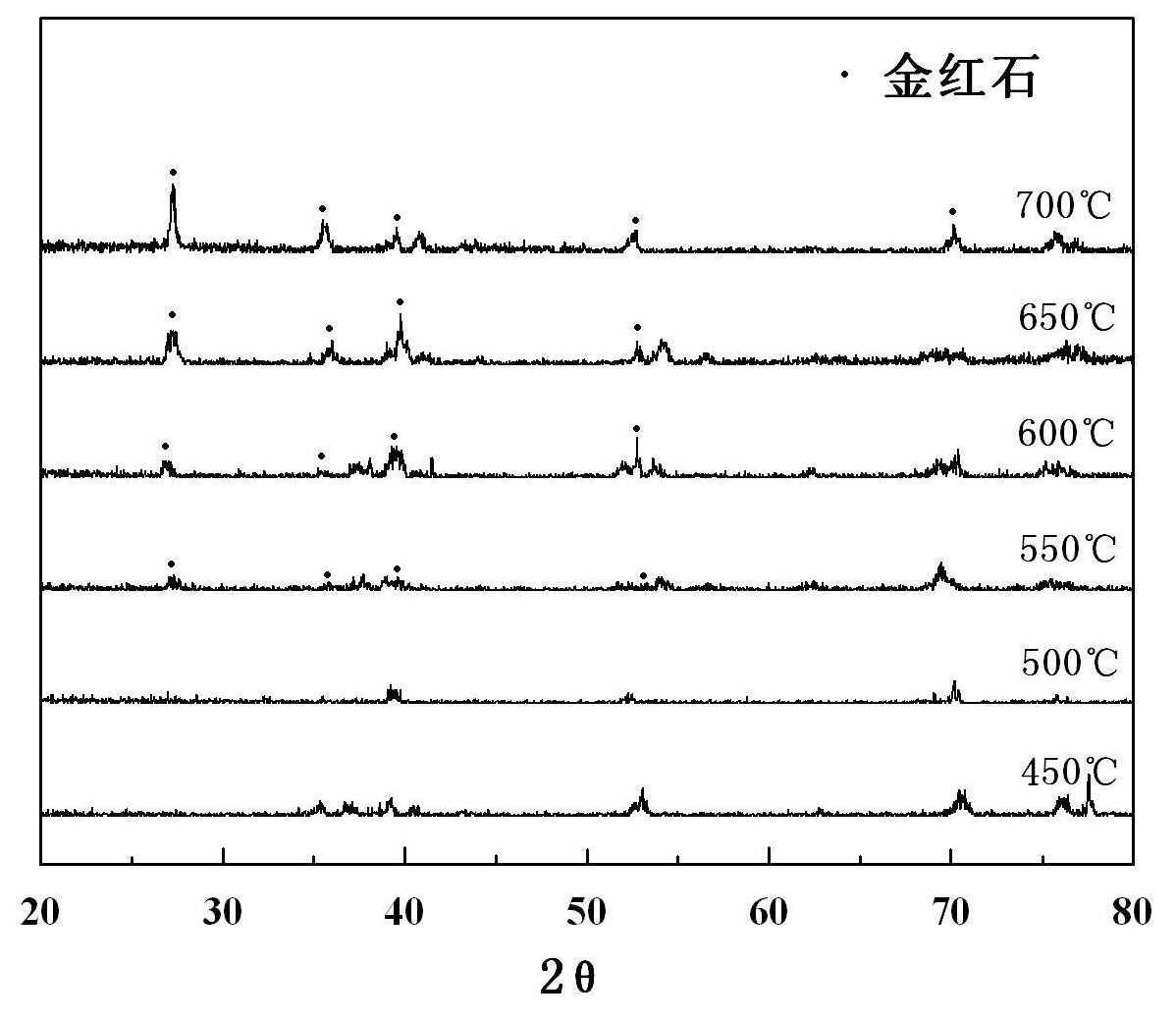
图2 不同温度焙烧下TiO2/Ti网的XRD
Fig.2 XRD patterns of TiO2/Ti mesh calcined at different temperatures
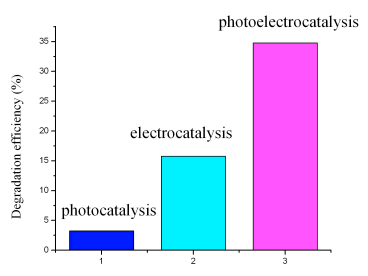
图3 不同处理条件下甲基橙的降解率
Fig.3 Degradation efficiency of methyl orange at different catalytic processes
2.3 不同处理条件下TiO2/Ti网的催化活性
在前述实验条件下,分别测定了TiO2/Ti网在光催化、电催化以及光电催化下甲基橙的降解率,结果如图3所示。实验结果显示:光催化下反应120 min,甲基橙的降解率只有3%左右,相同条件下电催化甲基橙降解率约为15%,而光电催化下的降解率达到了35%。从三种条件下甲基橙的降解率可以看出,光电催化的效率明显大于单一的光催化和电催化效率之和,表明本文所报道的光电催化反应体系存在着光电协同效应。
在外加电压的作用下,金红石相的二氧化钛对甲基橙的降解有促进作用。这可能包括两个因素:(1)通过外加电压的作用,能有效地分离光生空穴和光生电子,降低电子与空穴的复合率,从而提高光电催化反应的效率;(2)电解水副反应产生的活性氧充分提供了羟基自由基的原料,能够降低光生电子与空穴的复合。
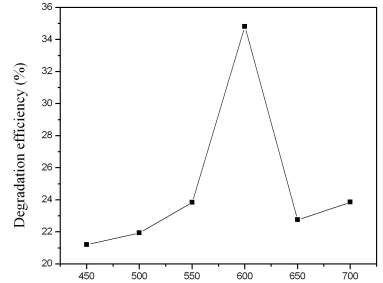
图4 焙烧温度对甲基橙的降解率的影响
Fig.4 Effect of calcined
temperature on the degradation of methyl orange different oxidation temperatures
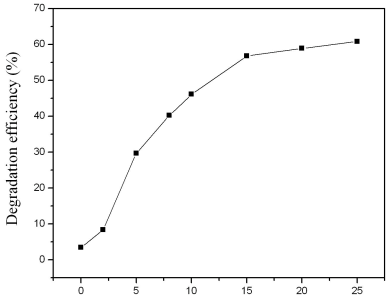
图5 外加电压对甲基橙的降解率的影响
Fig.5 Effect of electrical bias voltages on
the degradation of methyl orange
2.4 焙烧温度对TiO2/Ti网光电催化活性的影响
不同焙烧温度对TiO2/Ti网光电催化降解甲基橙的影响如图4所示。甲基橙的光电催化降解时间为120 min,外加偏压为5 V。当焙烧温度由450 ℃升至600
℃,TiO2/Ti网对甲基橙的降解率逐渐升高;450-550 ℃焙烧时,甲基橙的降解率只有22-24%左右,焙烧温度至600 ℃时,TiO2/Ti网的光电催化活性显著升高,由24%升至34.8%;焙烧温度继续升高至650 ℃,TiO2/Ti网的光电催化活性反而明显降低,甲基橙的降解率降低至24-26%。结合XRD和SEM的表征结果,450-500
℃焙烧时,Ti网表面主要为无定形的TiO2,因而光催化活性较低;550 ℃开始,随着表面金红石相的出现,TiO2/Ti网的光电催化活性显著增加,600 ℃达到最高,此时对应于表面凹凸不平的形貌和小的金红石晶粒;之后随温度的升高,光电催化活性快速下降,对应于TiO2/Ti网表面金红石晶粒的明显聚集长大。据文献报道[12],焙烧温度对催化剂表面的晶相影响极大,600 ℃左右会出现锐钛矿相向金红石相的转变;且随着焙烧温度的升高,TiO2的比表面积急剧减小,尤其是高温,700 ℃焙烧后,金红石相TiO2的比表面积降至5 m2/g。考虑到催化剂的活性受制备条件的影响较大,随着催化剂制备过程中煅烧温度的改变,TiO2催化剂的晶型、晶粒尺寸、比表面积等都会发生变化,综合各个方面的影响,600℃应是最适宜的催化剂制备温度。冷文华[13]等人报道了金红石TiO2光电催化降解苯胺,其中催化剂的制备温度也是600 ℃,与本文的实验结果一致。
2.5 外加电压对TiO2/Ti网光电催化活性的影响
外加电压对TiO2/Ti网光电催化降解甲基橙的影响如图5。TiO2/Ti网焙烧温度为600 ℃,焙烧时间为3 h。外加电压从0 V到15 V,甲基橙的降解率逐渐增大。当外加电压从15 V到25 V时,甲基橙的降解率增加缓慢。这是因为随着外加电压的增大,光生空穴与电子复合的几率减少,提高了甲基橙的光催化降解效率;此外,在固定光强的照射下,光生空穴和电子的数量是有限的,电压继续增大,降解率增加缓慢。
3 结论
在实验条件下,600 ℃焙烧3 h得到的TiO2/Ti网对甲基橙的光电催化降解效率最优,存在明显的光电协同效应。焙烧温度对催化剂的晶相、表面形貌的影响很大,进而影响甲基橙的光电催化效率。外加电压的增加会促进甲基橙的降解,当电压达到15 V,外加电压的影响趋于缓慢。
REFERENCES
[1] Fujishima A, Honda K. Nature. 1972, 238(5368): 37-38.
[2] Butterfield I M, Christensen P A, Hamnentt A et al. Journal of Applied
Electrochemistry. 1997, 27 (4): 285.
[3] Mehrdad K, Madjid M, Tom T. Applied Catalysis B: Enviromental. 2004, (53): 209-219.
[4] H. Hidaka, T. Shimura, K. Ajisaka et al. Journal of Photochemistry Photobiology A:
Chemistry. 1997 (109): 165.
[5] Salvador P, Gonzalez Garcia M L, Munoz F. Journal of Physical Chemistry. 1992 , 96
(25): 10349-10353.
[6] Radecka M, Zakrzewska K, Czternastek H et al. Applied Surface Science. 1993, 65/66
(1-4): 227.
[7] An T C, Zhang W B, Zhu X H et al. Chinese Journal of Catalysis(Cuihua Xuebao). 2003,
24 (5): 338-342.
[8] Tong S P, Leng W H, Zhang Z et al. Chinese Journal of Chemical Physics(Huaxue Wuli
Xuebao). 2002, 15 (1): 65-68.
[9] Gu Y Y, Qiu X Y, Du Z J. New Chemical Materials(Huagong Xinxing Cailiao). 2004, 32
(3):14.
[10] Gao L, Zheng S, Zhang Q H. Applications of Nanosized TiO2 Photocatalyst
Material, Beijing, Chemical Industry Press, 2002.
[11] Shun J, Gao L. Acta Chimica Sinica(Huaxue Xuebao). 2002, 60 (8): 1524-1526.
[12] Zhang Q H, Gao L, Sun J. Chinese Journal of Inorganic Chemistry(Wuji Huaxue Xuebao).
2001, 16 (5): 833-838.
[13] Leng W H, Zhang Z, Zhang J Q. Journal of Molecular Catalysis A: Chemical. 2003, 206:
239-252.




