http://www.chemistrymag.org/cji/2005/073021pc.htm |
Mar.1, 2005 Vol.7 No.3 P.21 Copyright |
Effect of reaction conditions on performance of Mo-Ni/g-Al2O3 catalyst for hydrodeoxygenation
Chen Manying, Yang Jun(Department of Chemistry, Jinan University, Guangzhou, 510632)
Abstract A serial of Mo-Ni/
g-Al2O3 catalysts were prepared by dipping method with g-Al2O3 as support. The effect of Ni content and operation conditions on performance of catalysts for hydrogenation of the model oxygenate, CH3COOH, were investigated in detail. The results show that the Mo-Ni/g-Al2O3 catalysts have high activity for oxygenate hydrogenation. Molybdenum addition can weaken the interaction of NiO and g-Al2O3, decrease the reduction temperature of catalysts, and increase the activity of catalysis for hydrodeoxygenation. The experimental results indicate that with the conditions: NiO content of 6-10%, temperature of 280-300 ºC, LHSV of 1.5 h-1,catalyst has a optimal performance.Keywords Nickel, molybdenum, hydrodeoxygenation 反应条件对Mo-Ni/g-Al2O3催化剂加氢脱氧性能的影响
陈满英,杨骏
(暨南大学化学系,广州 510632) 2004年11月30日收稿; 国家科技部863资助项目(No.2002AA523010)
摘要
以g-Al2O3为载体,通过浸渍法直接合成Mo-Ni/g-Al2O3系列催化剂。以乙酸为模型化合物,通过改变催化剂镍含量,反应压力,空速,温度等条件考察了催化剂的加氢脱氧性能。结果表明,Mo-Ni/g-Al2O3系列催化剂对乙酸具有高的加氢脱氧性能。Mo助剂的加入可有效地抑制Ni与载体g-Al2O3的强相互作用,大幅降低催化剂的还原温度,增加催化剂的乙酸加氢脱氧活性。实验结果表明,NiO含量6-10%、温度280-300 ℃、反应物液时空速1.5 h-1时,催化剂具有较高的加氢脱氧性能。关键词 镍,钼,加氢脱氧
1 引言
石油资源匮乏和国内石油供应不足已成为我国能源发展的一个严峻现实,随着国民经济的发展,石油供需矛盾将呈持续性扩大趋势。经济高速增长、石油资源缺乏的中国已经把石油安全置于能源战略的核心位置[1,2]。F-T合成作为替代技术,可将煤、天然气和生物质等其它碳资源转化为燃料油和化工原料。但与工业原油相比,费托合成油品中含有少量有机含氧化合物。而含氧化合物的存在会降低油品的品质,特别是有机酸将影响油品加工[3,4]。Mo-Ni/g-Al2O3催化剂对加氢脱硫、脱氮表现出较高的活性[5-7],但在加氢脱氧方面研究相对较少。
本工作以乙酸为模型氧化物,系统地研究负载型Mo-Ni/g-Al2O3催化剂的乙酸加氢脱氧性能以及Mo助剂的影响,并详细考察催化剂组成对催化剂的结构和性能、反应条件对催化剂的反应性能的影响,以期为开发性能优越的工业催化剂提供依据。
2 实验部分
2.1 催化剂的制备
以g-Al2O3(比表面为160.0 m2·g-1)为载体,钼酸铵、硝酸镍为原料。采用两次等体积浸渍法制备催化剂。先浸渍钼酸铵溶液,干燥后,500 ℃焙烧4 h; 第二步是浸渍硝酸镍溶液,经干燥,500 ℃焙烧4 h,制得所需的活性组分负载量的催化剂。所有的催化剂中MoO3wt%均为16wt%,而NiO的含量分别为2-14wt%,记为MoNix,其中x为NiO的质量百分含量。另外还制备了不加Mo助剂的催化剂作为比较,含NiO 6wt%,记为Ni6。
2.2 XRD分析
催化剂样品用日本理学电机Rigaku D/MAX-2500型X-射线衍射仪,Cu靶,Ni滤波,管电压50 kV,管电流100 mA,扫描速度4°/min,扫描范围20-80 °(2q)。
2.3 程序升温还原实验
样品用量为100 mg,粒度40-60目,还原气为5% H2和95% N2的混合气(体积分数),气体流量为50 mL·min-1,升温速率10 ℃·min-1。
2.4催化剂反应活性评价
催化剂评价在连续流动固定床微型反应器内进行,催化剂的用量为4克。催化剂经氢气 (99.9%)原位还原后,调节至所需的反应条件,反应原料乙酸庚烷溶液(4wt%)用ZB-80型微量计量泵精确计量泵入,反应产物用冷阱收集。待反应4 h后,开始收集稳定反应的产物进行分析。
2.5催化剂乙酸转化率的计算
乙酸的加氢反应主要有下面几个反应:
CH3COOH + 2H2 → CH3CH2OH + H2O (1)
CH3CH2OH + H2 → CH3CH3 + H2O (2)
CH3COOH + 3H2 → CH3CH3 + 2H2O (3)
反应中未加氢的乙酸和乙醇在反应过程中会生成乙酸乙酯,为了便于有效的比较各种因素对催化剂性能的影响,在计算催化剂转化率时,将产物中的乙酸乙酯折算为相应的乙酸和乙醇,然后分别归类到未完全加氢的酸和醇中,最后由修正后的乙酸量计算催化剂的转化率。在后面的图表中乙酸和乙醇的量皆为修正后的量。
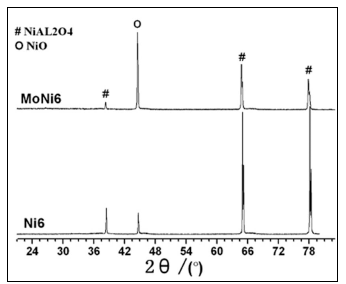
图1 Mo-Ni/g-Al2O3催化剂XRD图
Fig.1 XRD patterns of Mo-Ni/g-Al2O3 catalysts
3 结果和讨论
3.1 XRD、TPR表征
图1是MoNi6和Ni6催化剂的XRD衍射图谱。由图可见,催化剂在38.4°、44.7°、65.0°和78.2°都出现了衍射峰。根据文献报道[8],38.4°、65.0°和78.2°的峰属于NiAl2O4的特征峰,而44.7°是NiO的特征峰。图谱清楚显示Mo助剂的加入显著地降低了NiAl2O4的衍射峰强度,而同时增加了NiO的特征峰强度,这表明Mo助剂的加入大大地抑制了NiO和g-Al2O3间的相互作用,减少了NiAl2O4晶相,相应增加了易还原的NiO相。Mo-Ni/g-Al2O3没有出现MoO3衍射峰,也无钼铝尖晶石峰,表明MoO3呈高度分散状态。
图2是样品的H2-TPR图谱。根据文献[8]的报道,不加Mo助剂的NiO/g-Al2O3催化剂有两个特征还原峰,可推断570 ℃、780 ℃左右的耗氢峰分别归属于八面体和四面体镍中心的还原,即NiO和NiAl2O4的还原峰,这与XRD检测的晶相组成一致。
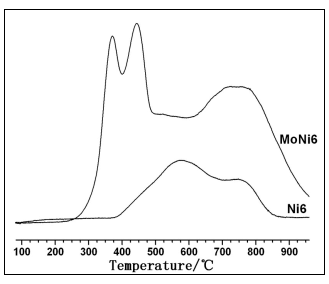
图2 Mo-Ni/g-Al2O3催化剂的H2-TPR图
Fig.2 H2-TPR of Mo-Ni/g-Al2O3catalysts 由图2可见,Mo助剂的添加显著地降低了催化剂中的NiO的还原温度,由570 ℃降至370 ℃,且还原峰的强度增加,提高了催化剂的还原程度,与前面的XRD结果一致。这些试验结果表明Mo-Ni/g-Al2O3催化剂中MoO3与g-Al2O3的相互作用适中,既利于活性组分高度分散,又利于其还原,为催化剂具有高的加氢脱氧活性奠定了基础。MoNi6催化剂780 ℃左右的第三还原峰比未加Mo的Ni6催化剂还强,是因为其不仅仅归因于NiAl2O4的还原。根据文献[9,10]的报道Mo-Ni/g-Al2O3催化剂存在八面体配位和四面体配位的Mo,八面体配位的Mo比四面体配位的Mo容易还原,445 ℃和877 ℃峰分别归属为八面体配位和四面体配位的Mo的还原峰,即分散状态的MoO3和Al2(MoO4)3。所以在MoNi6中第三个峰是NiAl2O4的还原峰和Al2(MoO4)3的还原峰的重叠峰。
3.2 加氢脱氧反应催化性能
3.2.1 Mo的影响
在反应温度为240℃和260℃,反应压力4.0 MPa和液时空速1.5 h-1的条件下,分别考查了加Mo和不加Mo负载型Ni催化剂的加氢脱氧的性能,结果列于表1。由表1可见, Mo助剂的添加,显著地提高了Ni催化剂的加氢脱氧活性,乙酸的转化率分别由240℃和260℃的21.8%和27.2%,大幅增加至87.2%和89.1%。这一结果与催化剂的XRD和TPR表征结果相符。Mo助剂的加入可抑制NiO和g-Al2O3间的相互作用,减少了NiAl2O4晶相,相应增加了易还原的NiO相,因而提高了催化剂的还原程度,增加了加氢脱氧活性。
表
1 Mo对催化剂加氢脱氧性能的影响Table 1 Effect of Mo on the performance of catalyst for hydrodeoxygenation
转化率 |
未反应的含氧化合物含量 /wt% |
|||||||
乙酸 |
乙醇 |
乙酸+乙醇 |
||||||
温度 /℃ |
Mo16Ni6 |
Ni6 |
Mo16Ni6 |
Ni6 |
Mo16Ni6 |
Ni6 |
Mo16Ni6 |
Ni6 |
240 |
87.2 |
21.8 |
0.53 |
3.24 |
1.03 |
0.14 |
1.56 |
3.38 |
260 |
89.1 |
27.2 |
0.45 |
3.02 |
0.99 |
0.19 |
1.44 |
3.21 |
3.2.2
镍含量的影响在反应温度为260℃,反应压力为4.0 MPa和液时空速1.5 h-1的反应条件下,考察了镍的不同含量对Mo-Ni/g-Al2O3催化剂加氢脱氧催化性能的影响,结果见图3。
由图3可知,镍含量分数在2-14%,随着镍含量的增加,转化率呈现先升高后降低的趋势。转化率从42.8%迅速升至92.5%后,增加变缓,最高达93.6%后,再缓慢降到91.3%。其中镍含量在10wt%时达到最高值93.6%。可能原因是Ni含量较低时,高分散地负载于g-Al2O3表面的MoO3可有效抑制NiO与载体的相互作用,增加的Ni主要是易还原的高分散NiO,催化剂的活性升高很快;但随着Ni含量的进一步增高,一方面镍晶粒会聚集长大,另一方面可能会生成较多的尖晶石相NiAl2O4,导致催化剂的活性增加缓慢,甚至降低。
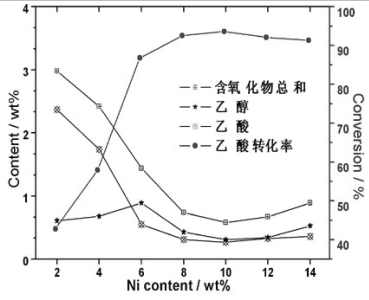
图3 镍含量对加氢脱氧催化性能的影响
Fig.3 Effect of Ni content on performance of catalysts for hydrodeoxygenation
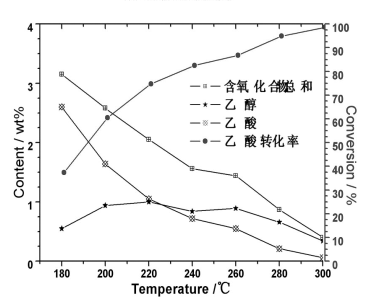
图4 温度对加氢脱氧催化性能的影响
Fig.4 Effect of temperature on performance of catalyst for hydrodeoxygenation
3.2.3反应温度的影响
反应压力为4.0 MPa和液时空速1.5 h-1的反应条件下,在180-320 ℃的范围内,详细考察了温度对Mo16Ni6催化剂性能的影响,结果见图4。在实验的温度范围内,乙酸转化率均随温度的升高而单调增加。温度较低时,随着温度的升高,乙酸转化率急剧增加,但温度高于240 ℃后,活性随温度升高而增加的速率变缓,300 ℃时,乙酸转化率高达98.6%,但仍有0.34%的中间产物乙醇未加氢完全,继续升高温度,则乙酸转化率接近100%,未完全加氢的乙醇量仅0.1%。
3.2.3反应空速的影响
对Mo16Ni6催化剂,在温度为260 ℃和压力4.0 MPa的反应条件下,考察了反应物的液时空速对催化剂的加氢脱氧性能的影响,结果见图5,随着空速由0.5 h-1变至8h-1,乙酸转化率急剧下降,由98.5%降至14.9%。这主要是空速升高,反应物在催化剂床层内的停留时间缩短,不利于加氢。空速低,催化剂的转化率虽然高,但单位时间的处理量少,两者之间有一综合平衡。
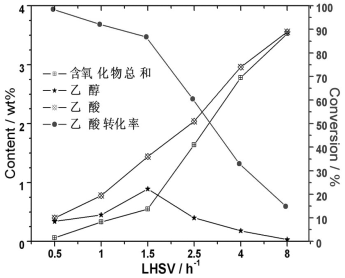
图5 空速对加氢脱氧催化性能的影响
Fig.5 Effect of LHSV on
performance of catalyst for hydrodeoxygenation
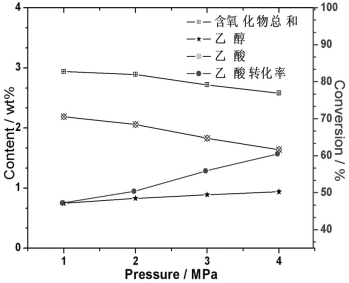
Fig.6 Effect of pressure on performance of catalyst for hydrodeoxygenation
3.2.5 反应压力的影响
在反应温度为200 ℃和液时空速1.5 h-1的反应条件下,分别考察了几个压力下Mo16Ni6对乙酸加氢反应,结果列于图6。由方程(1)-(3)可知,乙酸加氢是一个总体积减少的反应,从热力学平衡来看,加压有利于加氢脱氧反应。由图6可见,随着反应压力的增加,加氢脱氧的转化率逐渐增加,总压从1 MPa变成4 MPa时,转化率分别从47.27%升高到60.47%,不完全加氢的乙酸的含量由2.19%降至1.64%,但中间物乙醇的含量由0.75%增加到0.94%。产生这一现象的可能原因是,乙酸加氢生成乙醇的反应(1)是体积减小反应,但乙醇加氢生成乙烷的反应(2)体积无变化,因而,压力的升高只促进反应(1)和(3),乙酸的加氢反应的进行,不影响乙醇的加氢反应,最终导致上述的反应结果。
4 结论
(1) 通过浸渍法可以获得分散度好,加氢脱氧性能优良的Mo-Ni/g-Al2O3的催化剂。Mo助剂的加入可有效地抑制Ni与载体g-Al2O3的强相互作用,大幅降低催化剂的还原温度,增加催化剂的乙酸加氢脱氧活性。
(2) NiO含量对催化剂活性影响很大,存在一最优的值,太高和低都降低催化剂的活性,含量在6wt%-10wt%较好。
(3) 条件实验结果表明,催化剂的最优操作条件为:温度280-300℃,反应物液时空速1.5h-1。
致谢 本工作的完成得到了中国科学院山西煤炭化学研究所合成油911组的大力支持,特别是任杰研究员的悉心指导,王雪峰和王锋同学的热心帮助,在此表示最诚挚的谢意。
REFERENCES
[1] Xiang H W, Tang H Q, Li Y W. Journal of Fuel Chemistry and Technology (Ranliao Huaxue Xuebao), 2001, 29(4): 289.
[2] Bai L, Deng S P, Dong G Q, et al. Chemical industry and engineering progress (Huagong
Jinzhan), 2003, 22(4): 441.
[3] Yang J, Liu Y, Li Y, et al. Chinese Journal of Catalysis (Cuihua xuebao), 2003, 24(5):
343.
[4] Edward F. Applied Catalysis A: General, 2000, 199: 147.
[5] Suzuki K, Takaya H, Araki M, et al. Int. Chem. Eng., 1984, 24(3): 546.
[6] Liu X H, Shao Z Q, Zhang W L, et al. Natural Gas Chemical Industry (Tianranqi
Huagong), 1991, 16(3): 22.
[7] Kadinov G, Praliaud H, Primet M, et.al. Appl. Catal., 1984, 10: 63.
[8]Yong S H. Materials science and engineering, 2004, 369: 241.
[9] Cheng W, Li Y M, Wang R J. Chemical Industry and Engineering (Huaxue gongye
yugongcheng), 1998, 15(4): 30.
[10] Chung K S, Massoth F E. J. Catal., 1980, 64(2): 320.