http://www.chemistrymag.org/cji/2005/07a067pc.htm |
Oct. 2, 2005 Vol.7 No.10 P.67 Copyright |
Wang Yihua,Shen Weiping,Jin Hongmei,Wang Fei
(Department of Chemistry, Shanghai University, Shanghai, 200444, China)
Abstract Water dispersible polyisocyanate compounds consisting of polyisocyanate and poly(dimethylsiloxane) as hydrophobic chain and polyglycol as hydrophilic chain were designed and synthesized according to polymer self-assembly theory. Polyglycol with controlled hydroxyl number was prepared with octamethylcyclotetrasiloxane and polyglycol monomethyl ether beforehand and then amphipathic polyisocyanate was synthesized with certain NCO/OH proportion. Also examined was how colloidization was influenced by the proportion of hydrophilicity and hydrophobicity.
Keyword water dispersible, polyisocyanate group, self-assembly 自组装水分散多异氰酸酯的合成
王一华,沈卫平,金红梅,王斐
(上海大学 理学院化学系,上海200444)
摘要
根据聚合物自组装原理,设计合成由多异氰酸酯基团、聚二甲基硅氧烷疏水性链以及聚乙二醇亲水性链构成的水分散多异氰酸酯化合物。用八甲基环四硅氧烷和聚乙二醇单甲醚反应,制备控制羟值的疏水改性的聚乙二醇,然后按照NCO/OH不同当量比,与HDI三聚体合成一系列两亲性的水分散多异氰酸酯化合物。探索了亲水性和疏水性的比例对胶束化过程的影响。
关键词 水分散;多异氰酸酯基团;自组装
高分子自组装是近年来蓬勃发展的研究领域[1]。在此领域中,对嵌段共聚物的胶束化研究尤为广泛和热烈[2,3]。两亲性嵌段或接枝共聚物在水中发生自组装形成球状胶束,通常胶束含有一个疏水性核和一个亲水性壳层。
根据聚合物自组装原理,我们设计合成一个新颖的水分散多异氰酸酯。如图1所示的这个目标分子是含有多异氰酸酯基团,聚二甲基硅氧烷疏水链以及聚乙二醇亲水链构成的两亲性分子。
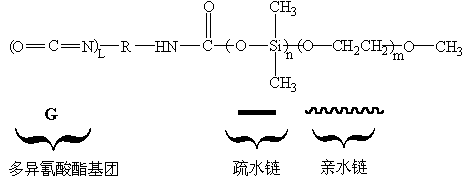
图1 目标分子结构
在以前的研究中,大多采用在多异氰酸酯化合物上直接接枝亲水性链段,使其胶束化,但其水分散性较差,很容易凝胶化,而丧失了实际应用价值,可见利用多异氰酸酯化合物本身的疏水性无法很好地保护其异氰酸酯基团[4]。为了改进其水分散性和形成乳液稳定性,有研究者在多异氰酸酯和聚乙二醇亲水链之间嵌入高烷基疏水链[5],以此形成胶束,加强对异氰酸酯基团的稳定性保护。这样确实提高了水分散多异氰酸酯的胶束形成能力和其乳液的稳定性。但它的胶束疏水性核是均相体系,水分子渗透亲水性壳层与均相的疏水性核表面的异氰酸酯基团发生反应导致凝胶化,而使乳液稳定性降低[6]。
本论文利用聚氨酯和聚有机硅氧烷之间互溶性差(溶度参数d分别是10.0和7.5)[7],设计合成了在多异氰酸酯基团骨架和聚乙二醇亲水链之间嵌入疏水性聚二甲基硅氧烷的水分散多异氰酸酯。其在水中自组装成胶束,期望它的疏水性核具有微相分离形成双层结构,聚二甲基硅氧烷在亲水性壳层和多异氰酸酯基团之间生成疏水屏障,防止水分子的渗入,从而得到水分散多异氰酸酯的稳定乳液。见图2
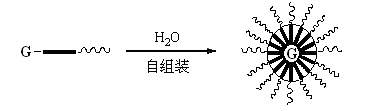
图2 目标分子自组装胶束化过程 1 实验部分
1.1 实验材料与仪器
聚二乙醇单甲醚(M=428),八甲基环四硅氧烷(D4),e-己内酯,氢氧化四甲基铵甲醇溶液(25%),均为市售化学纯;1.6-六亚甲基二异氰酸酯(HDI)三聚体(拜尔公司N3300, NCO含量21.8±0.3%)。
Gemini-2000 300MHz核磁共振仪;AVATAR370-FT-IR红外光谱仪;TEM-800X透射电子显微镜;ZetaSizer 3000HS纳米粒度及Zeta电位分析仪。
1.2 化学容量法
异氰酸酯含量测定:采用二正丁胺方法,见参考文献[8]。羟值测定:采用羟基硅油中羟值含量的容量法测定,见参考文献[9]。
1.3 e-己内酯改性聚醚及其水分散多异氰酸酯(N)的制备
在干燥的250ml三颈瓶中,加入无水处理的聚乙二醇单甲醚42.8g(0.1mol)和新蒸的 e-己内酯13.7g(0.12mol)以及28mg磷酸,搅拌均匀,在130℃,下反应15小时,冷却后倒入1000ml石油醚,沉淀出浅黄色油状物,干燥后得到54g产物,羟值为1.77mmol/g,产率99.6%。
IR(KBr) cm-1: 3478 (broad,nOH); 2869 (s,nCH2); 1733 (s,nC=O); 1140 (s,nC-O-C) H1-NMR(CDCl3) ppm: 4.23 (t, 2H, J=6Hz, -COO-CH2-); 4.07 (t, 2H, J=6Hz, -CH2O-); 3.67-3.60 (m, 28H, -(CH2CH2O)7-); 3.55-3.53 (m, 4H, -OCH2CH2OCH3-); 3.39 (s, 3H,-OCH3-); 2.37-2.29 (m, 2H, - CH2-COO-); 2.05 (broad, 1H, -OH); 1.69-1.38 (m, 8H, -(CH2)4-)。
在氩气保护下,取50g HDI三聚体(NCO%=21.8%)和8.2g上述制备的干燥的改性聚醚(羟值1.77mmol/g),NCO/OH当量比为18,搅拌均匀,加热到100℃,反应2小时后停止,冷却后冲氩气保存,得到几乎无色透明的粘稠状液体,NCO含量为17.29%。
1.4 聚二甲基硅氧烷疏水改性聚乙二醇单甲醚(改性聚醚)的制备
在干燥的250ml三颈瓶中,加入经无水处理的聚乙二醇单甲醚42.8g(0.1mol)和新蒸D4 31.1g (0.105mol) 以及催化量30mg的25%氢氧化四甲基铵的甲醇溶液,搅拌均匀,加热到120℃。反应时间见表1所示,然后冷却,倒入1000ml石油醚,沉淀出无色透明油状物72g左右,几乎定量转化,它们的羟值见表1。
IR(KBr) cm-1: 3390-3200 (nSi-OH); 1140 (nC-O-C); 1108 (nSi-0-Si); 860-780 (dSi-(CH3)2) H1-NMR(CDCl3) ppm: 3.65 (m, 33H, -(OCH2CH2)8-); 3.59 (m, 4H, -CH2CH2OSi-); 3.38 (s, 3H, -OCH3); 2.03 (Broad, 1H, -SiOH); 0.11 (s, 27H, -Si(CH3)2)。
1.5 HDI三聚体接枝改性聚醚反应
氩气保护下,取10g HDI三聚体(17.3mmol,NCO%=21.8%),搅拌下溶入30ml干燥的甲苯中。加热到100℃时,滴加13.3g改性聚醚(17.3mmol,羟值1.302mmol/g)的30ml干燥的甲苯溶液,滴加2.5-3小时,滴完后继续反应0.5小时,冷却后,旋转蒸发出部分甲苯,然后倒入1L石油醚中,沉淀出无色透明的油状物,真空干燥后得2.8g无色透明粘稠状液体,产率98%,NCO含量5.93%(理论含量6.24%)。
IR(KBr) cm-1: 3368 (nNH); 2937 (nCH3); 2861 (nCH2); 2273 (nNCO); 1689 (n
 ); 1142 (nC-O-C);1107 (nSi-O-Si); 860-750 (d-Si(CH3)2)。H1-NMR(CDCl3) ppm:
3.87 (t, 4H, J=7Hz, -CH2NCO); 3.65 (m, 38H, -(OCH2CH2)9-
); 3.38 (s, 3H, -OCH3); 3.30 (t, J=7Hz, 9H, -NCH2-); 1.58-1.41 (m, 27H, -(CH2)4-);
0.10 (s, 28H, -Si(CH3)2-)。
); 1142 (nC-O-C);1107 (nSi-O-Si); 860-750 (d-Si(CH3)2)。H1-NMR(CDCl3) ppm:
3.87 (t, 4H, J=7Hz, -CH2NCO); 3.65 (m, 38H, -(OCH2CH2)9-
); 3.38 (s, 3H, -OCH3); 3.30 (t, J=7Hz, 9H, -NCH2-); 1.58-1.41 (m, 27H, -(CH2)4-);
0.10 (s, 28H, -Si(CH3)2-)。
1.6 水分散多异氰酸酯(T)的制备
在氩气保护下,把50g HDI三聚体(NCO%=21.8%)和11.1g改性聚醚搅拌混合均匀,加热到100℃,反应1小时后取样测定异氰酸酯的含量,以后每隔半小时,测定一次。当样品的NCO%接近理论值时,停止加热。冷却充氩气保存,得到几乎无色透明粘稠状液体,测定NCO含量。具体配比和NCO含量见表2。
1.7 水分散多异氰酸酯的乳液性能测试
精确称取10g水分散多异氰酸酯(T),加入等量的去离子水,用玻璃棒搅匀成50%浓度的乳液,并观察水分散过程和乳液外观,并做出评判。优:手动搅拌5分钟后成为带蓝光白色的乳液;良:手动搅拌8分钟后成为白色乳液;中:手动搅拌10分钟后成为有细小油珠漂浮的白色乳液;差:手动搅拌下不能成为乳液。
水分散多异氰酸酯的乳液一旦形成,马上精确称取乳液样品1.5g
放入烧瓶中,用移液管加入20ml二正丁胺甲苯溶液(33.8%),按实验1.2二正丁胺方法测定异氰酸酯基团含量,以后每隔1小时测定一次异氰酸酯的含量。
2 结果与讨论
2.1
聚二甲基硅氧烷疏水改性聚乙二醇单甲醚(改性聚醚)的合成与表征
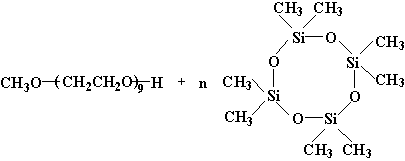
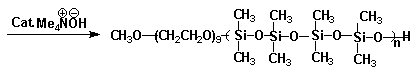
图3 聚乙二醇单甲醚和八甲基环四硅氧烷的开环加成反应
图3中,在氢氧化四甲基铵的催化下,八甲基环四硅氧烷(D4)和聚乙二醇单甲醚发生开环加成反应。理论上控制D4与聚乙二醇单甲醚的摩尔比,也即是调控疏水段和亲水段的比例。按其摩尔比为1:1时,进行聚乙二醇的疏水嵌段合成反应。按照理论计算,经过无水处理的聚乙二醇单甲醚的羟值为2.336mmol/g(实测值2.318mmol/g),与D4反应后,羟值应下降至1.381mmol/g。根据HLB值定义,我们把羟值换算成HLB值,理论上其HLB值为11.8,符合非离子表面活性剂作为乳化剂使用的准则[10]。但反应不可避免地会出现D4的自聚,所以用羟值测定来跟踪反应进程,以此控制合成两亲性的聚二甲基硅氧烷改性的聚乙二醇单甲醚。
表1 反应时间与羟值变化
反应时间(h) |
10 |
11 |
12 |
13 |
14 |
15 |
羟值(mmol/g) |
1.401 |
1.302 |
1.296 |
1.153 |
1.021 |
0.931 |
HLB值 |
11.99 |
11.15 |
11.10 |
9.87 |
8.74 |
7.81 |
表1的结果显示,反应在10小时前的羟值大于理论计算值,说明聚乙二醇单甲醚与D4反应,尚未达到一定的转化率。当反应进行到11小时,羟值接近理论值。随着反应的进行,两分子硅醇可进一步缩合,而使羟值下降,HLB值减少,产物的疏水性增强。
HLB值为8.74和11.15的改性聚醚,它们的红外光谱特征吸收基本一致,均出现:3390-3200cm-1的硅醇羟基吸收和1140-1108
cm-1的双重的强宽吸收,表明有醚键 (C-O-C) 和硅醚键 (Si-O-Si)
的存在;同时在890-760 cm-1处有一强宽峰,为 (Si-(CH3)2)
的特征吸收。H1-NMR光谱对不同HLB值的改性聚醚呈现在3.38ppm
(-OCH3) 和0.11ppm (-Si(CH3)2-) ,它们的峰强度(积分面积)之比发生变化。理论上,如果按等摩尔反应,即图3中n=1的情况计算积分面积之比应为1:8。实际测定过程中HLB值为11.15的改性聚醚得到的积分面积之比为1:9,换算成HLB值应为11.25。8.74的改性聚醚其积分面积之比为1:15.3,相应的HLB值8.61。用羟值测定和核磁共振光谱的两种方法获得的产物HLB值很接近,说明成功地合成了图3
中的改性聚醚,通过控制反应时间,可获得聚二甲基硅氧烷疏水改性的聚乙二醇单甲醚,它们的n值可控制在1.13-1.91之间,从而得到可控制亲水/疏水比例的不同HLB值的改性聚醚。
2.2
合成水分散多异氰酸酯及其水分散性能考察
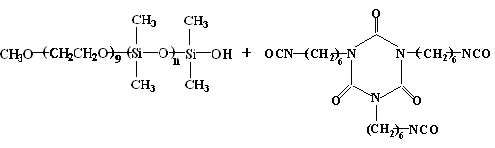
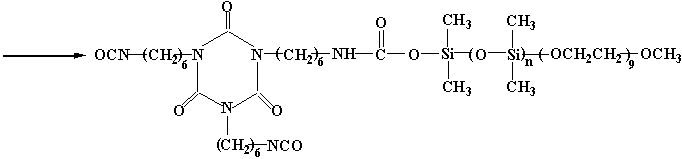
图4 HDI三聚体与改性聚醚的接枝反应
如图4所示,HDI三聚体和改性聚醚,以等摩尔反应,经纯化后,它的红外光谱表明,其改性聚醚原有的硅醇羟基在3390-3200cm-1强宽特征吸收,经与异氰酸酯反应后转变成在3368(中等强度)和1689cm-1处的酰胺基特征吸收。H1-NMR在3.87ppm处的异氰酸酯基团的a-亚甲基相对吸收强度,与HDI三聚体的此处的相对吸收强度相比较,其减弱为三分之二左右,这表明HDI三聚体中的一个异氰酸酯基团与硅醇羟基发生了亲核加成反应,改性聚醚成功地接枝到HDI三聚体上。同时原有改性聚醚2.03ppm处的硅醇羟基吸收却明显地消失了。合成的等摩尔改性聚醚接枝HDI三聚体在水中分散成几乎无色透明的微乳,并且在水中稳定24小时,仍无变化。但其作为交联剂使用时,由于异氰酸酯基团的含量很低,而不起交联剂反应,所以用作HDI三聚体水分散时的内乳化剂,可望得到水分散多异氰酸酯这样的水性交联剂。
我们采用HDI三聚体直接与不同HLB值的改性聚醚进行接枝反应。按交联剂的设计要求,它的异氰酸酯基团的含量应在15-17%范围。调节NCO/OH的当量比,以控制HDI三聚体的接枝率,用测定异氰酸酯基团的含量来跟踪反应,从而获得一系列水分散性能有差异的多异氰酸酯化合物(表2)。
表2 水分散性多异氰酸酯的合成和性质
产物T |
改性聚醚HLB值 |
NCO/OH |
改性聚醚含量(%) |
产物 |
水分散 |
乳胶粒径(nm) |
T1 |
8.74 |
21 |
19.5 |
16.28 |
差 |
- |
T2 |
8.74 |
18 |
22.0 |
15.93 |
差 |
- |
T3 |
8.74 |
15 |
25.4 |
15.03 |
中 |
|
T4 |
9.87 |
21 |
17.6 |
17.06 |
差 |
- |
T5 |
9.87 |
18 |
20.0 |
16.13 |
良 |
935 |
T6 |
9.87 |
15 |
23.1 |
15.22 |
优 |
317 |
T7 |
11.15 |
21 |
16.0 |
17.30 |
良 |
876 |
T8 |
11.15 |
18 |
18.2 |
16.68 |
优 |
256 |
T9 |
11.15 |
15 |
21.0 |
15.93 |
优 |
219 |
N |
15.14 |
18 |
14.0 |
17.29 |
优 |
236 |
表2结果显示,当改性聚醚的HLB值为8.74较小时,无论其反应的接枝率,也即改性聚醚的百分含量有多高,均不能使目标产物具有较好的水分散性。当改性聚醚的HLB值增大到9.87,接枝率为20%时,合成的目标产物呈现优良的自乳化性能。其HLB值进一步增大到11.15,不同接枝率下,的HDI三聚体接枝改性聚醚,都表现出优良的水分散性。
2.3 水分散多异氰酸酯的乳液性能
首先,考察表2中T5-T9的产物50%浓度的乳液稳定性,并与用e-己内酯改性聚乙二醇单甲醚接枝HDI三聚体的水分散多异氰酸酯(N)进行比较,通过它们的乳液中NCO%的含量随时间变化来评价其稳定性。见图5。
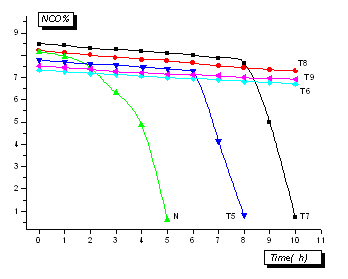
图5 水分散多异氰酸酯乳液的NCO含量随时间变化
图5 结果表明T6,T8,T9产物的乳液有很好的稳定性,一般在10小时以内基本无变化;
T5,T7分别在6小时和8小时出现凝胶化现象,NCO的含量急剧下降;而用高烷基疏水改性的聚乙二醇接枝HDI三聚体(N),在3小时后出现部分凝胶沉淀,随后乳液凝聚分层。
对应于表2显示的产物乳液粒径测试也反映了,HLB值较大,亲水性相对变强,其乳液粒径在350nm-200nm范围时,设计合成的目标分子在水中具有优秀的自组装形成胶束形成稳定乳液的能力;而当HLB较小,亲水性相对减弱时,虽仍然能形成胶束,但其粒径增大到800-1000nm之间,导致乳液稳定性变差;用于比较的产物N虽然其乳液粒径为236nm,但由于缺乏聚二甲基硅氧烷的疏水相的保护,而导致乳液不稳定。


图6 TEM观察T8和N的乳胶粒子形态
为了进一步证明此,用透射电镜(TEM)直接观察T8和N乳液。图6很清晰地反映T8乳胶粒子的疏水性核具有明显的双层结构。而N的乳胶粒子呈现普通乳液的胶粒形态[11]。这说明在多异氰酸酯和聚乙二醇之间嵌入五个碳的疏水链,还不能有效地保护异氰酸酯基团。而运用溶度参数差异大的理论,来设计两亲性嵌段共聚物,并在水中自组装成具有微相分离结构的胶束,可以合成出稳定的水分散多异酸酯化合物。
REFERENCES
[1] Philp D, Stoddart J F. Angew Chem Int Ed Engl, 1996, 35: 1154-1158.
[2] Soten I, Ozin G A. Current Opinion in Colloid&Interface Science, 1999, 4:
325-328.
[3] Tomalia D A, Wang Z, Tirrel M. Current Opinion in Colloid&Interface Science,
1999, 4:3-10
[4] West L J, Halas N J. Current Opinion in Colloid&Interface Science, 2000, 11:
215.-223
[5] Bernd Bruchmann,Gunter Mohrhardt,Hans Renz. . United States Patent, patent number: 6,538,09.6 B2
[6] Wicks Z W, Wicks D A, Rosthauser J W. Prog Org Coat, 2002, 4.4: 161-167
[7] 冯圣玉, 张洁, 李美江.
有机硅高分子及其应用 (北京)化学工业出版社, 2004,
238-253
[8] 中华人民共和国化工行业标准
采用二正丁胺方法测定异氰酸酯含量HG/T 2409, 1992.
[9] 姚成, 张骥红, 王镇浦. 化学世界, 1998, 9:
491-493.
[10] 程铸生.《精细化学品化学》2nd[B] (上海)华东理工大学出版社, 1996:
244-254.
[11] Ling F, Shieh Y D. Journal of Applied Polymer Science, 1998, 69: 2069-2078.