http://www.chemistrymag.org/cji/2006/083019pc.htm |
Mar. 2, 2006 Vol.8 No.3 P.19 Copyright |
Lin Hong
(Department of Chemistry and environment, Yuxi Teachers College, Yuxi 653100)
Abstract The method for the determination
of chlorogenic acid and rutin in tobaccos by spectrophotometry was proposed. Chlorogenic
acid and rutin in tobaccos samples were extracted by methanol, the color reaction used
aluminum chloride and sodium nitrite,then they were
determined by spectrophotometry. The relative standard deviations
were 1.6-2.6% and The standard recovery results were 96-105%. The determination results
were consistent with that by HPLC. The method was applied to determinated
Chlorogenic acid and rutin content in tobaccos samples. The results were satisfactory.
Keywords Chlorogenic Acid; Rutin; Spectrophotometry; Tobacco
(玉溪师范学院化学与环境科学系,云南 玉溪 653100)
摘要 研究了用分光光度法测定烟草中的氯原酸和芸香苷,烟草中的氯原酸和芸香苷用甲醇提取,然后分别用三氯化铝和亚硝酸钠显色,用分光光度法测定,方法相对标准偏差在1.6-2.6%之间,标准回收率在96-105%之间,测定结果和HPLC法相符合,方法用于烟草样品中氯原酸和芸香苷含量的测定,结果令人满意。
关键词 芸香苷 光度法 烟草
1 实验部分
1.1 主要仪器和试剂
1.2 实验方法
工作曲线:于25ml比色管中,分别加入芸香苷标准工作液0,1,2,3,4,5 mL,然后加入12 mL含三氯化铝的缓冲溶液,稀释到刻度,摇匀,放置5 min,以试剂空白为参比,于416 nm处测定吸光度,得芸香苷与Al(III)显色的工作曲线。于25mL比色管中,分别加入氯原酸标准工作液0,1,2,3,,4,5 mL,然后加入4 mL 0.5 mol/L盐酸溶液,4 mL亚硝酸钠-钼酸钠混合液,放置3 min,然后加入4 mL 1.0 mol/L氢氧化钠溶液,用水稀释到刻度,摇匀,以试剂空白为参比,于510 nm处测定吸光度,得氯原酸与亚硝酸钠反应的工作曲线;用芸香苷标准工作液重复上述操作可得在510 nm处芸香苷与亚硝酸钠显色反应的工作曲线。
样品分析:准确称取烟样适量用滤纸包住, 于索氏提取管中用石油醚回流1 h脱去色素,转入100 ml烧瓶中接上回流冷凝管用45 ml 80%甲醇回流提取30 min,定容到50mL,过滤,取5 mL滤液加三氯化铝溶液显色,并以烟样空白为参比,于416 nm波长处测定吸光度,按芸香苷与Al(III)显色的工作曲线计算出芸香苷含量;另取5 mL滤液,用亚硝酸钠显色后于510 nm处测定吸光度 (该吸光度为芸香苷和氯原酸显色产物吸光度的加和),根据样品中芸香苷的含量和芸香苷与亚硝酸钠显色的工作曲线可算出芸香苷显色产物的吸光度,总吸光度减去芸香苷显色产物的吸光度可得氯原酸显色产物的吸光度,由该吸光度根据氯原酸与亚硝酸钠显色的工作曲线可计算出氯原酸的量。
2 结果与讨论
2.1测定波长的选择
氯原酸、芸香苷及其显色产物的吸收光谱见图1。由图可见,芸香苷与Al(III)显色的合物最大吸收波长为416 nm,氯原酸与亚硝酸钠显色时最大吸收波长为510 nm。因此分别选择416 nm和510 nm作为分析芸香苷和氯原酸的测定波长。
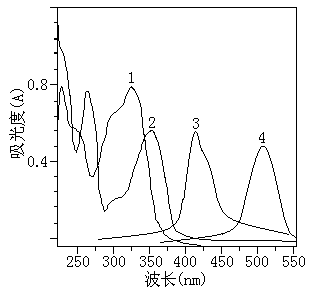
图1氯原酸、芸香苷及其显色产物的吸收光谱图
(1氯原酸;2芸香苷;3芸香苷与Al(III)显色产物;4氯原酸与亚硝酸钠显色产物)
芸香苷与Al(III)的显色反应在弱酸性介质中显色,pH在2.0-3.0范围内吸光度稳定[9],因此选用pH为2.5的缓冲溶液控制酸度。0.1 mol/L三氯化铝用量在8 ~ 15mL内吸光度稳定,实验选用浓度为0.048mol/L的三氯化铝。为了简化操作,本实验配成pH=2.5的氯乙酸-氢氧化钠缓冲(含0.1 mol/L三氯化铝)溶液作为显色液,加12 mL该溶液显色。
在盐酸介质中和钼酸钠存在下,氯原酸及芸香苷可和亚硝酸钠发生亚硝酰化反应,钼酸钠和亚硝酸钠混合液用量在3.5~ 5 mL内吸光度稳定,故实验选用的亚硝酸钠浓度为0.23mol/L;钼酸钠的浓度0.078 mol/L; 盐酸溶液用量在3~ 5 mL内吸光度稳定,选用0.08 mol/L的盐酸。生成的亚硝化合物调到碱性后成鲜红色产物,所以亚硝化反应完全后需用氢氧化钠调到弱碱性,本实验选用1.0 mol/L氢氧化钠调pH,氢氧化钠浓度为0.16 mol/L左右吸光度稳定,实验选用氢氧化钠的浓度为0.16 mol/L。
2.2 显色温度及体系的稳定性
芸香苷与Al(III)的显色反应在室温下迅速进行,放置2 min后吸光度可达到稳定,显色完全后体系至少可稳定2.0 h。室温下氯原酸及芸香苷与亚硝酸钠的亚硝酰化反应在3 min内可完完全,调pH为碱性后该产物迅速变为鲜红色,显色产物至少可稳定2h.。
2.3 工作曲线
在选定实验条件下,芸香苷与Al(III)反应时芸香苷含量在0~0.4 mg/25mL内符合比尔定律,线性回归方程为A=-0.0115+2.729 C(mg/25mL),r=0.9999;氯原酸与亚硝酸钠反应时氯原酸含量在0~0.5 mg/25mL内符合比尔定律,线性回归方程为A=-0.0135+0.993C(mg/25mL),r=0.9999;芸香苷与亚硝酸钠反应时芸香苷含量在0~1.0 mg/25mL内符合比尔定律,线性回归方程为A=0.0046+0.198 C(mg/25mL),r=0.9993。
2.4 体系选择性
芸香苷与三氯化铝反应时烟草中其它黄酮也发生该反应,但是由于烟草中黄酮类多酚以芸香苷为主(含量占总黄酮的90%以上),因此测定结果可近似认为是芸香苷含量;对于氯原酸与亚硝酸钠的反应,氯原酸的异构体4-o-咖啡-d-奎尼酸和5-o-咖啡-d-奎尼酸也发生该反应,且灵敏度相近,因此测定结果为氯原酸及其异构体的总量。对于0.2 mg氯原酸或芸香苷,相对误差为±5%,下列量共存物质不干扰(mg):葡萄糖,果糖,麦芽糖,蔗糖,烟碱,苹果酸,草酸(20);柠檬酸,乳酸,琥珀酸,氯原酸(1),莨菪亭(0.2);K+,Cl-,NO3-,SO42-,PO43-,Na+,NH4+(5);Ca2+,Mg2+(0.5);b -胡萝卜素和叶黄素干扰严重,可在样品前处理时用石油醚回流脱去,未回流样品b -胡萝卜素和叶黄素的允许量为0.05mg,体系选择型较好。
3 样品分析及结果
烤烟样称取0.100g,香料烟称取0.200g,白肋烟和马里兰烟称取1.00g,按实验方法测定,并用HPLC法做对照。测定及回收率实验结果见表1。
表1 测定及回收率实验结果
试样 |
测定值(%) |
HPLC法(%) |
RSD%(n=5) |
回收率实验 |
||||||
氯原酸 |
芸香苷 |
|||||||||
氯原酸 |
芸香苷 |
氯原酸 |
芸香苷 |
氯原酸 |
芸香苷 |
回收量mg/25mL) |
回收率% |
回收量mg/25mL) |
回收率% |
|
烤烟(C2F) |
2.56 |
1.23 |
2.43 |
1.15 |
1.6 |
1.9 |
1.96 |
98 |
2.06 |
103 |
香料烟(JBS) |
1.18 |
0.642 |
1.06 |
0.628 |
2.2 |
2.1 |
2.10 |
105 |
2.04 |
102 |
马里兰烟(JBS) |
0.422 |
0.218 |
0.408 |
0.211 |
2.3 |
2.6 |
1.92 |
96 |
2.06 |
103 |
白肋烟(X1F) |
0.385 |
0.187 |
0.376 |
0.192 |
2.5 |
2.4 |
1.94 |
97 |
1.96 |
98 |
4 结论
本方法测定烟草中的氯原酸和芸香苷所需仪器设备简单,操作简便,灵敏度高,有一定的选择性,方法相对标准偏差在1.6-2.6%之间,标准回收率在96-105%之间,测定结果和HPLC法相符合,方法准确可靠,是一种很有价值的分析方法。
[1] Zhou Z H,Gao K R,Zhang S H. Tobacco Science & Technology (Yancao Keji),1997,19(2): 22-25.
[2] He C X,Cui H,Sun Y G et al. Chinese J Anal Chem (Fenxi Huaxue), 1999,27 (9): 1110.
[3] Han F G.. Journal of Henan Agricultural University (Henan Nongye Daxue Xuebao), 1993,18(1): 95-98.
[4] Snook M.E. Tobacco Sciience, 1960, 4(2): 25-29.
[5] Sakaki H,Takeshi A. Journal of Chromatography, 1982, 224 (2): 145-177.
[6] Court M,William A. Journal of Chromatogrphy, 1977, 130(2):287-291.
[7] Fan L X, Wei Y L,Yang X M. Shanxi Journal of Traditional Chinese Medicine (Shanxi Zhongyi),2000, 21(2): 85-86.
[8] Fan Z G,Li Y L,Yang LB et al. Pharm J Chin PLA (Jiefangjun Yaoxue Xuebao), 2000,16(1):36-38
[9] Li H C, Wang S X. Tobacco. Smoking Chemistry and Analysis (Yancao Yanqi Huaxue ji Fenxi). Zhengzhou: Henan Science and Technology Press, 1991.