http://www.chemistrymag.org/cji/2006/085034nc.htm |
May 1, 2006 Vol.8 No.5 P.34 Copyright |
(1College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006; 2College of Chemistry and Environmental Science, Henan Normal University, Xinxiang 453007; 3Department of Chemistry and Chemical Engineering, Jinzhong University , Jinzhong 030600, China ) Abstract This paper aims at green synthetic chemistry, offered a method for green synthesis of several 3, 3'-(alkanediyldiimino)dibut-2-enoates.The reaction occurs readily without any catalyst. The reactive conditions was moderate and the operation was simple and convenient. The synthetic method using water as the reaction medium may avoid the environmental pollution from organic solvent. Besides, by taking advantage of IR, H1NMR and elementary analysis, we believe that the structure was in Z configuration and N-H···O=C intramolecular hydrogen bond was existed extensively in b-olefin(e) ketone.
Keywords Green Synthesis; 3, 3'-(alkanediyldiimino)dibut-2-enoate; Structure; Hydrogen Bond 3, 3’-烷撑二亚胺基二丁-2-烯酸酯的绿色合成与结构表征 张振峰1,2 温建辉1,3 刘博1
(1山西大学化学化工学院 太原 030006;2河南师范大学化学与环境科学学院 新乡 453007; 3山西晋中学院化学化工系 晋中 030600 )
2006年4月3日收稿;国家自然科学基金资助项目(批准号:20372044)
摘要 研究了几种3, 3’-烷撑二亚胺基二丁-2-烯酸酯类化合物的绿色合成方法,既不需要任何催化剂,也不使用有机溶剂,仅以水为溶剂在常温下即可进行,该方法具有成本低、原子利用率高、易于分离和提纯、纯度高、对环境友好等特点。同时通过红外光谱、核磁共振谱和元素分析等对产品进行了表征,得出了Z构型和N-H…O=C类型的分子内氢键将广泛存在于b-胺基烯酯(或烯酮、烯醛)类化合物中,并且发现分子中环化氢键的存在阻止了进一步发生缩聚反应的重要结论。
关键词 绿色合成; 3, 3’-烷撑二亚胺基二丁-2-烯酸酯; 结构;
氢键
基于杂环化合物在生命过程和环境中的重要意义,它们的研究已成为当今化学界十分活跃的领域之一.尤其是氮杂环,大都具有显著的生理活性,更是受到了生化界的重视.在这些研究中,一个重要的研究方向是N,
N ’-二烯酯基取代的脂肪二胺的合成及应用,如3,3’-(1,2-乙二亚胺基)二丁-2-烯酸酯受到了广泛的关注[1-4]
,它不仅可以用作金属离子的络合剂[2] , 还可以作为进一步合成氮杂环的中间体[3-4] .它们通常是在各种Friedel-Crafts催化剂的作用下,由乙酰乙酸乙酯与脂肪二胺通过缩合反应来制取,所用的是有机溶剂,水的存在被认为对反应是不利的。
直到2000年,Stefai[5]与其合作者报告了水介质中 b-酮酯、1,3-二酮和乙二胺的反应,
然而,其产物的结构与其所提供的1HNMR图谱明显是矛盾的,此外,该文献中提供的分离方法较为烦琐.我们发现该类反应很容易发生,并且是以水为溶剂,得到了纯度很高的晶体产物.本文报道了七种3,
3’-烷撑二亚胺基二丁-2-烯酸酯在水溶液中进行绿色合成的方法,合成路线如scheme
1所示,该方法具有成本低、原子利用率高、易于分离和提纯、对环境友好等特点,为实现绿色合成提供了重要的途径和应用前景。
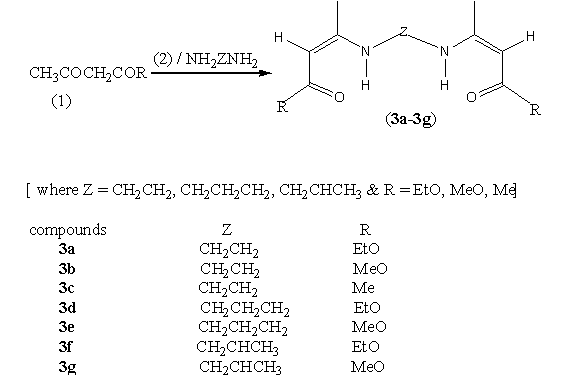
Scheme 1
1 实验部分
1.1仪器与试剂
1HNMR用DRX300核磁共振仪(TMS内标,CDCl3溶剂),元素分析用VarioEL III CHNS 型元素分析仪测得,熔点由SANYO 微熔点仪测得(熔点仪未校正),红外数据由PE-1730 红外光谱仪记录.所用试剂均为分析纯。
1.2 合成和纯化
向配有机械搅拌的三口圆底烧瓶中加入0.5mol的b-羰基酯(或酮)CH3COCH2COR和50ml水,搅拌状态下一次性加入0.25mol所述二胺NH2ZNH2,室温下搅拌约20min,粗产品目标产物迅速生成,冷却反应混合物至室温,产物很容易地以沉淀或油状液体的形式从水溶液中自动分离开来.如果初始产品是沉淀,过滤沉淀,用95%乙醇洗涤,在干燥器中干燥,即得固态产品(3a-3b);如果初始产品是粘稠的油状液体,分离油层,用蒸馏水洗涤,无水氯化钙干燥,目标产品(3c-3g)便缓慢地成为固态.进一步的提纯可以用二氯甲烷(3a)、乙醇(3b)、石油醚(3e)或乙酸乙脂(3c,3d,3f,3g)作溶剂进行重结晶。
1.3 产率与结构鉴定
产物的熔点、产率、元素分析和红外光谱数据见表1,产物的核磁共振谱数据见表2。
Table 1 Physical and elemental analysis data
compd |
m.p./ ℃ |
yield(%) |
elemental
analysis(%,cacld) |
IR (KBr) |
|
3a |
C14H24N2O4 |
126-128 |
92 |
59.13(59.14) 8.53(8.51) 9.85(9.85) |
1648,1607 |
3b |
C12H20N2O4 |
148-150 |
93 |
56.26(56.24) 7.91(7.87) 10.91(10.93) |
1656, 1584 |
3c |
C12H20N2O2 |
105-106 |
95 |
64.28(64.26) 8.96(8.99) 12.46(12.49) |
1613, 1579 |
3d |
C15H26N2O4 |
41-43 |
87 |
60.33(60.38) 8.80(8.78) 9.44(9.39) |
1650, 1609 |
3e |
C13H22N2O4 |
68-70 |
86 |
57.91(57.76) 8.18(8.20) 10.39(10.36) |
1655, 1604 |
3f |
C15H26N2O4 |
39-41 |
85 |
60.35(60.38) 8.73(8.78) 9.42(9.39) |
1649,607 |
3g |
C13H22N2O4 |
84-86 |
85 |
57.40(57.76) 8.20(8.20) 10.27(10.36) |
1650, 1602 |
compd |
1 H NMR(300MHz, CDCl3),d |
3a |
8.59(s, 2H, 2NH), 4.43(s, 2H, 2CH=), 4.06-3.99 (q, 4H, 2CH3CH2), 3.31-3.29(d, 4H, NHCH2CH2NH),1.86(s, 6H, 2CH3C=), 1.21-1.17(t, 6H, 2CH3CH2) |
3b |
8.64(s, 2H, 2NH), 4.50(s, 2H, 2CH=), 3.62(s, 6H, 2CH3OCO), 3.38-3.36(d, 4H, CH2CH2),1.92(s, 6H, 2CH3C=) |
3c |
10.81(brs,2H,2NH),4.93(s,2H,2CH=),3.37-3.34(d,4H,CH2CH2),1.93(s,6H,2CH3CO), 1.86(s,6H,2CH3C=) |
3d |
8.54 (s, 2H, 2NH), 4.45 (s, 2H, 2CH=), 3.62 (s, 6H, 2CH3OCO), 3.35-3.29 (q, 4H, NHCH2CH2CH2NH), 1.92 (s, 6H, 2CH3C=), 1.88-1.79 (m, 2H, CH2CH2CH2) |
3e |
8.55 (s, 2H, 2NH), 4.48 (s, 2H, 2CH=), 4.10-4.03 (q, 4H, 2CH3CH2), 3.32-3.26 (q, 4H, NHCH2CH2CH2NH), 1.90 (s, 6H, 2CH3C=), 1.83-1.79 (m, 2H, CH2CH2CH2), 1.25-1.20 (t, 6H, 2CH3CH2)。 |
3f |
8.70 (s, 1H, NHCH2), 8.52-8.49(d, 1H, NHCH), 4.45-4.43 (d,2H,2NHCH=), 4.09-4.02 (q,4H,2CH3CH2OCO),3.60-3.56 (m, 1H, CH2CHCH3), 3.20 (s, 2H, CH2NH), 1.89 (s,3H, CH3C=), 1.86(s, 3H, =CCH3),1.24-1.22(m,3H,CH3CH;6H,2CH3CH2OCO) |
3g |
8.71 (s, 1H, NHCH2), 8.54-8.51 (d, 1H, NHCH), 4.47 (s, 1H, =CH), 4.45 (s, 1H, =CH), 3.68-3.63 (m, 1H, CH2CHCH3), 3.62 (s, 6H, 2´ CH3OCO), 3.26-3.21 (t, 2H, NHCH2CHCH3), 1.91 (s, 3H, =CCH3), 1.89 (s, 3H, =CCH3 ), 1.27-1.25 (d, 3H, CH3CH). |
2 结果与讨论
2.1 实现了化合物的环境友好合成
水是与环境友好的绿色溶剂,以水为介质的有机反应是“与环境友好合成反应”的一个重要组成部分,水相有机反应的研究正在受到越来越多的关注.我们以水为溶剂,底物按照要求的化学计量数混合以后,二者迅速反应,得到的产物以沉淀或油状液体的形式从水溶液中迅速分离,正是这些产物的简单处理才导致了原子利用率的提高(产率> 85 %)。
2.2 化合物的结构分析
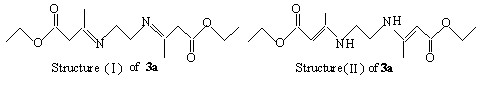
目标化合物3a-3g是合成相应杂环化合物的中间体,文献报道[5]烷基二胺和b-羰基酯的缩合反应得到的是开链化合物3a,其结构被认为是(Ⅰ)[6].我们认为应该是(II)[2],因为1HNMR图谱分析发现3a中有两个乙烯基质子(d 4.43, s) 和 两个N-H 质子(d 8.59, s).此外,结构II中存在两个由C=O双键、C=C双键、N原子和O原子上的孤对电子形成的π68共轭体系,使分子的能量降低,应该是更为有利的结构.如Scheme 2所示。
Scheme 2 此外,本课题组对晶体3a和3g的X射线分析表明[1],它们的C=C双键都属于(Z,Z)构型,C=O双键、C=C双键和N-H 键是共平面的,这可能是由于分子内存在两个较强的N-H…O=C类型的环化氢键,形成了两个稳定的六员环状结构的原因,如Scheme 3.
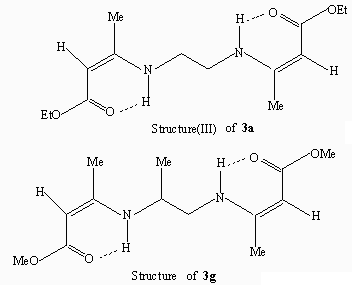
Scheme 3 基于对3a和3g的X射线分析结果,我们认为化合物3b-3f都趋于形成(Z,Z)构型,或者说Z构型和N-H…O=C类型的分子内氢键广泛存在于b-胺基烯酯(或烯酮、烯醛)类化合物中是合理的。
2.3 氢键对反应的影响
氢键作为一种主要的弱相互作用,通常存在于分子间或分子内的不同的基团之间,并影响着体系的理化性质[7,8],目前氢键在超分子化学、生命科学、晶体工程和高分子科学等领域中的作用日益突出,已引起相关学者的极大兴趣和广泛关注[9-12].反应物(1)和(2)都是双官能团化合物,生成3a-3g后本应继续发生缩聚反应生成高分子化合物,我们认为正是由于分子内环化氢键的存在,阻止了产物进一步发生缩聚反应的可能,减少了副产物的产生,从而提高了原子的利用率,实现了目标产物的环境友好合成。 REFERENCES
[1] Zhang Z F, Jin S, Shang Z B. et al. Acta Cryst, 2004, C60, o176-o177.
[2] Costes J P, Laurent J P . Inorg.Chem, 1988, 27: 3235-3237.
[3] Grigoryan G V, Agbalyan S G. Arm. Khim. Zh., 1973, 26 (11): 962–963.
[4] Lulukyan K K, Poshotyan A Zh, Agbalyan S G. Arm. Khim. Zh , 1982, 35 (9): 588–590.
[5] Stefani H A, Costa I M, Silva D O. Synthesis, 2000, 11: 1526-1528.
[6] Moazzam M, Parock J. Pure Appl Sci , 1988, 7: 25-26
[7] Pimentael G C, Mcclellan A L. The Hydrogen Bond. San Francisco and London: Freeman and Company, 1960.
[8] Jeffery G A. An Introduction to Hydrogen Bonding. New York: Oxford University Press, 1997.
[9] Hadzi D. Theoretical Treatments of Hydrogen Bonding. New York: John wiley&Sons, 1997.
[10] Desiraju G R, Steiner T. The weak Hydrogen Bond: In Structural Chemistry and Biology. London: Oxford University Press, 1999.
[11] Wan H J, Diao J Z, Hong Z Y. et al. Chemical Journal of Chinese Universities (Gaodengxuexiao Huaxuexuebao), 2005, 26(1): 129-133.
[12] Dormidontova E, Brink T. Macromolcules, 1998, 31(8): 2649-2660.