http://www.chemistrymag.org/cji/2008/10c059nc.htm |
Dec.
1, 2008 Vol.10 No.12 P.59 Copyright |
Li
Zhengping, Liu Xiuxian, Guo Juanli, Han Jun
(College of Chemistry and Environmental Science, Hebei University, Baoding 071002 )
Abstract In the acetic acid-sodium acetate buffer solution(pH3.5), when the nanoparticles combine with nucleic acids by electrostatic forces, Resonance Light Scattering intensity is enhanced strongly with a maximum wavelength located at 300 nm. Under the optimal conditions, the intensity of the RLS is linear with the concentration of calf thymus DNA in the range of 0.01-0.3 mg/L and the concentration of fish sperm DNA and yeast RNA in the range of 0.01-0.2 mg/L. The detection limit (3s
) of the proposed method is 4.0 mg/L (ctDNA), 2.9 mg/L (fsDNA), 2.7 mg/L (yRNA). Based on the study, a simple and sensitive method for nucleic acids has been established.Keywords nucleic acids; titanium dioxide nanoparticles; resonance light scattering 利用二氧化钛纳米粒子的核酸共振光散射分析研究
李正平 刘秀贤 郭娟丽 韩军
关键词 核酸,二氧化钛纳米粒子,共振光散射
1
引言核酸是生物体内存储遗传信息、控制蛋白质合成的生物大分子。目前核酸的分析方法主要有分光光度法[1],荧光分析法[2],共振光散射(RLS)技术[3,4]等方法。分光光度法灵敏度低,使其应用受到限制;荧光法有较好的灵敏度,但荧光试剂贵,有毒性。近年来,共振光散射技术广泛应用于生物大分子测定中,并以其灵敏度高,操作简便等特点,受到人们的关注[5]。但共振光散射分析一般基于有机小分子与生物大分子的相互作用。近年来,纳米粒子已应用于蛋白质的共振光散射分析[6,7]。本实验利用共振光散射技术研究了二氧化钛纳米粒子与核酸的相互作用。由于静电作用二氧化钛纳米粒子沿核酸分子组装聚集,从而引起强烈的共振光散射,其散射强度与核酸浓度呈现良好的线性关系,据此建立了测定核酸的新方法。
2
实验部分2.1 仪器与试剂
F-4500型荧光分光光度计(日本日立公司);WH-861型涡旋混合器(江苏太仓市科教器材厂)。
小牛胸腺脱氧核糖核酸(ctDNA),鱼精子脱氧核糖核酸(fsDNA),酵母核糖核酸(yRNA)均购自北京欣经科试剂公司,将ctDNA和fsDNA直接溶于二次蒸馏水,yRNA溶于0.5%的NaCl溶液,均配制成100 mg/mL的储备液,0-4ºC保存;0.1 mol/L醋酸-醋酸钠缓冲溶液(pH 3.5);四氯化钛(天津市大茂化学仪器供应站),所用水为二次蒸馏水,试剂均为分析纯。
2.2 二氧化钛纳米粒子的制备
二氧化钛纳米粒子按文献[8]的方法制备。将0.2 mL乙醇,0.1 mL丙酮,0.6 mL乙腈溶于200 mL二次蒸馏水中,在磁力搅拌下冷却至0ºC。四氯化钛预先冷却到固液共存状态(-24ºC),用冷冻后的进样器取1 mL注入上述溶液中,于0ºC持续搅拌3 h后,在0ºC放置陈化16 h,得到无色透明的TiO2纳米粒子胶体溶液,该纳米粒子粒径约为2 nm。
2.3 实验方法
在10 mL比色管中,依次加入110 mL 4.56×10-4 mol/L的二氧化钛纳米粒子胶体溶液,1 mL pH 3.5的0.1 mol/L的醋酸-醋酸钠缓冲溶液和一定浓度的核酸,用水稀释至10 mL,混合均匀,在荧光分光光度计上以lex =lem的方式进行同步扫描,得到RLS光谱。在最大共振光散射300 nm处进行散射光强度测定。依照同样的方法不加入核酸作空白试验。
3
结果与讨论3.1 共振光散射光谱
图1是TiO2纳米粒子胶体溶液,核酸及TiO2纳米粒子与核酸作用后的共振光散射光谱。TiO2纳米粒子的体积很小,粒子直径远小于0.05l,其散射属于瑞利散射,散射强度与TiO2体积的平方成正比,由于其体积小,所以散射强度很小。核酸的水溶液是均相溶液,散射是由浓度涨落引起的,由于其浓度很低,其散射强度也很小。
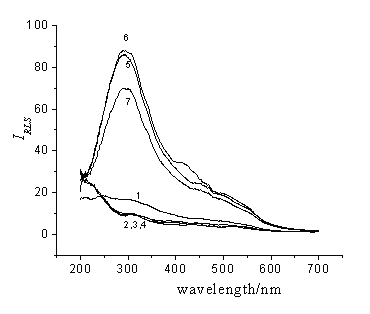
图1 共振光散射光谱
Fig.1 Resonance Light Scattering (RLS) spectra.
1. Titanium dioxide nanoparticles, 2. calf thymus DNA(ctDNA), 3. fish sperm DNA(fsDNA), 4. yeast RNA(yRNA), 5. titanium dioxide nanoparticles and ctDNA, 6. titanium dioxide nanoparticles and fsDNA, 7. titanium dioxide nanoparticles and yRNA.
Titanium dioxide nanoparticles, 5.0×10-6 mol/L; ctDNA, fsDNA, yRNA, 0.2 mg/L. HAc-NaAc buffer(0.01mol/L, pH3.5)
TiO2纳米粒子表面带正电荷,DNA双螺旋结构外围的磷酸根带负电荷,在一定条件下TiO2纳米粒子沿DNA分子组装聚集。一方面使粒子的体积增大,另一方面,当TiO2纳米粒子之间的距离小于其粒子直径时,会发生粒子间的表面等离子体共振,因此共振光散射被强烈增强。RNA分子没有完整的双螺旋结构,通过自身折叠使互补的碱基对相遇,形成氢键,从而表现出部分区域的双螺旋结构,而且RNA分子比DNA分子小,因此,与TiO2纳米粒子作用后的共振光散射强度也相对较小。
3.2 pH值及缓冲溶液浓度的影响
如图2所示,TiO2纳米粒子的共振光散射强度(IRLS)随pH值增大而快速增加,TiO2-ctDNA结合后在pH=3.5时IRLS达到最大,这时TiO2纳米粒子本身的IRLS很小。实验同时考察了0.002-0.02
mol/L pH=3.5的缓冲溶液对体系的影响。结果表明,缓冲溶液浓度对TiO2纳米粒子的共振光散射强度无明显影响,TiO2-ctDNA体系的散射强度在缓冲浓度0.01 mol/L时达到最大,故实验选用0.01 mol/L的缓冲溶液(pH=3.5)控制溶液的pH值。
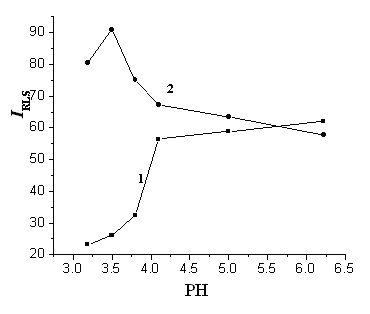
图2 缓冲溶液pH值对共振光散射强度的影响
Fig.2 Influence of pH value on the RLS intensity.
1. Titanium dioxide nanoparticles; 2. titanium dioxide nanoparticles and ctDNA.
Titanium dioxide nanoparticles, 5.0×10-6 mol/L; ctDNA, 0.2 mg/L.
3.3 TiO2纳米粒子浓度的影响
如图3所示,TiO2纳米粒子浓度低于2.5×10-5 mol/L时,TiO2纳米粒子的共振光散射强度较小,高于2.5×10-5
mol/L时散射强度增大。TiO2-ctDNA体系的共振光散射强度在TiO2纳米粒子浓度5.0×10-6 mol/L时最大,因此实验选择TiO2纳米粒子的浓度为5.0×10-6 mol/L。
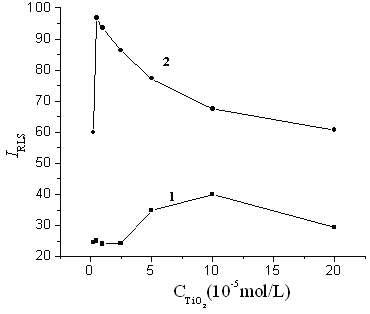
图3 二氧化钛纳米粒子浓度的影响
Fig.3 Influence of titanium dioxide nanoparticles
concentration on the RLS intensity.
1.Titanium dioxide nanoparticles; 2. titanium dioxide nanoparticles and ctDNA.
ctDNA, 0.2 mg/L; HAc-NaAc buffer solution,
pH3.5
3.4 时间和离子强度的影响
考察了0-120 min内时间对TiO2-ctDNA体系的共振光散射强度的影响。TiO2纳米粒子与ctDNA混合后,共振光散射强度迅速达到最大值,且至少稳定120
min,表明TiO2纳米粒子与DNA反应迅速且体系具有良好的稳定性。
3.5 线性范围和检出限
在最佳实验条件下,按照实验方法,测定了不同浓度ctDNA,fsDNA,yDNA与共振光散射强度之间的关系,其线性范围,线性回归方程及相关系数,检出限列于表1中。
表
1 分析参数Table 1 Analytical parameters for the determination of nucleic acids
核酸 |
线性范围 (mg/L)Linear range |
线性回归方程 |
相关系数 |
检出限 (mg/L)Detection limit |
CtDNA |
0.01-0.3 |
I=0.7799+201.1C |
0.997 |
4.0 |
FsDNA |
0.01-0.2 |
I=6.331+268.9C |
0.998 |
2.9 |
yRNA |
0.01-0.2 |
I=1.338+208.9C |
0.997 |
2.7 |
从表1可以看出,IRLS与核酸浓度具有良好的线性关系,该方法测定核酸灵敏度高,操作简单。由于TiO2纳米粒子易制备,无毒且价格便宜,该方法对于测定较低浓度的DNA含量具有良好的应用价值。
REFERENCES
[1] Schy W E, Plewa M J. Anal.Biochem., 1989, 180(2): 314.
[2] Lepecq J B, Paoletti C. Anal.Biochem., 1966, 17(1): 100.
[3] Huang C Z, Li K A, Tong S Y. Anal.Chem., 1997, 69(3): 514.
[4] Huang C Z, Li K A, Tong S Y. Anal.Chem., 1996, 68(13): 2259.
[5] Huang C Z, Li Y F. Anal.Chim.Acta, 2003, 500(1-2): 105.
[6] Zhu C Q, Li D H, Zhu Q Z et al. Fresenius J.Anal.Chem., 2000, 366(8): 863.
[7] Wang L Y, Wang L, Dong L et al. Talanta, 2004, 62(2): 237.
[8] Zhou J F , Zhu Y C, Chen C P et al. Henan Chemical Industry(Henan Huagong), 1994, 7:
11.