http://www.chemistrymag.org/cji/2009/112006nc.htm |
Feb.1,
2009 Vol.11 No.2 P.6 Copyright |
(Department of Chemistry, Resources and Environmental College, Yuxi Normal University,Yuxi 653100)
Abstract In Na2B4O7-H3BO3
buffer solutions(pH 7.8), cobalt (II) react with dimethylglyoxime (DMG) to form a complex
which appears a polarographic wave with peak potential -1.17 V (vs. SCE). When K2S2O8
was added, the peak height was increased. The scond-order derivative peak current of the
catalytic wave was linear to Co (II) concentration in the range of 8.0×10-10-5.0×10-6
mol/L. The detection limit was 5.0×10-10mol/L. The mechanism of the
polarographic catalytic wave was studied, and results show that this wave is an adsorptive
parallel catalytic wave. The method has been applied to determine cobalt (II) in urine、tap water and VB12. The results are satisfied.
Keywords Potassium Persulfate; Cobalt ; Adsorptive Parallel Catalytic Wave
(玉溪师范学院资源环境学院化学系,云南 玉溪653100)
2008年11月30日收稿;云南省自然科学基金项目(NO.2008CD215).
摘要 在
Na2B4O7-H3BO3缓冲溶液中(pH 7.8),Co(Ⅱ)-丁二酮肟(DMG)在-1.17V(vs.SCE)产生灵敏的络合物吸附波,加入K2S2O8后波高进一步增加,其二阶导数峰电流与Co(Ⅱ)浓度在8.0×10-10~5.0×10-6mol/L范围内呈线性关系,检出限为5.0×10-10mol/L。研究了极谱波增敏的机理,表明该极谱波为络合物吸附平行催化波。方法用于尿液、自来水和维生素B12中痕量钴的测定,结果满意。关键词 过硫酸钾,钴,吸附催化波
钴是人体营养必需微量元素,人体中如果缺钴,则可使红细胞的形成受到干扰,出现巨细胞贫血。长期接触钴化物会钴可以引起肺部病变、红细胞增多及接触性皮炎等。痕量钴的分析方法有分光光度法
[1,2]、原子吸收光谱法[3]、ICP-AES[4]等。已报道的测定痕量钴的极谱法大多是利用络合物吸附波体系来测定,如Co(Ⅱ)-a 联呋喃甲醛二肟体系[5]、Co(Ⅱ)-甲基百里香酚-亚硝酸根体系[6]、Co(Ⅱ)中性红-亚硝酸盐体系[7]等,而Co(Ⅱ)-丁二酮肟-K2S2O8体系未见报道。实验发现引入K2S2O8后,Co(Ⅱ)-丁二酮肟体系的极谱波高显著增加,而峰电位基本不变,产生了吸附平行催化波,由此建立了Co(Ⅱ)-DMG-K2S2O8体系吸附催化波测定钴离子实验方法。因为该波不仅有吸附富集作用,且电极反应时产生催化循环,所以测定灵敏度比单独的吸附波和平行催化波法更高。应用此法测定了尿液、自来水和维生素B12中的钴含量,并对吸附催化波进行了表征和机理研究。 1 实验部分1.1 仪器与试剂
JP-303型示波极谱仪(成都分析仪器厂),滴汞电极、饱和甘汞电极和铂电极三电极体系。CHI660型电化学工作站(美国CH仪器公司),三电极系统为303A型静汞电极(美国EG&G PARC公司),饱和甘汞参比电极和铂丝对电极。Co(Ⅱ)标准溶液(1.0×10-3mol/L):称取0.1550g在500-550℃灼烧至恒重的无水硫酸钴,溶于少量的水后转入1L容量瓶中用水定容至刻度,使用时稀释至所需浓度。DMG溶液(1.0×10-3mol/L):称取分析纯DMG 0.05806g,用95%的乙醇溶解,用水定容于50mL容量瓶中。0.2mol/L K2S2O8溶液,2.0 mol/L Na2B4O7,0.5 mol/L H3BO3溶液。试剂均为分析纯,水为二次亚沸石英蒸馏水。实验在通氮除氧和室温下进行。
1.2 实验方法
取标准溶液或样品溶液于50mL容量瓶中,依次加入0.5mol/L Na2B4O7溶液2mL,2.0 mol/L H3BO3 8mL,0.2mol/L K2S2O8溶液1mL,1×10-3mol/L的DMG溶液1mL,用水稀释至50mL,摇匀,取适量溶液于10mL电解池中,在JP-303型示波极谱仪上从-0.90V至-1.40V作阴极化扫描,记录-1.17V的极谱催化波的二次导数峰电流,按校准曲线求得Co(Ⅱ)含量。 2 结果与讨论
2.1 最佳条件的选择
2.1.1 波形分析
二阶导数技术可以较好地消除滴汞电极上的充电电流和法拉弟电流,获得高的灵敏度,且峰形尖锐,容易测量[8]。本法采用二阶导数记录极谱图(如图1),在-0.90V至-1.40V的电位范围内,底液Na2B4O7-H3BO3-DMG- K2S2O8中无极谱峰(曲线a),无氧化剂K2S2O8存在时,Co2+与DMG形成的配合物于—1.17V处产生一还原吸附波(曲线b),当加入氧化剂K2S2O8,该峰电流升高,峰电位基本不变,产生了Co(Ⅱ)-DMG络合物吸附催化波(曲线c)。
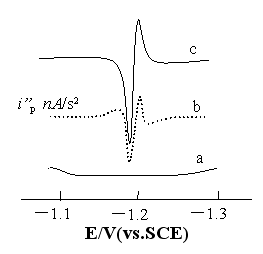 |
图1
二阶导数极谱图 Fig.1 Second-order derivative polarograms a. Na2B4O7-H3BO3 + 5.0×10-6mol/L DMG + 4.0×10-3 mol/L K2S2O8; b. Na2B4O7-H3BO3 + 2×10-5mol/L DMG +1.0×10-6mol/L Co2+; c. a+ 1.0×10-6mol/L Co2+ |
考察了HAc-NaAc、Na2B4O7-H3BO3、NH3·H2O-NH4Cl等缓冲溶液对Co-DMG吸附催化波的影响,试验表明:在微碱性底液Na2B4O7-H3BO3中,在氧化剂K2S2O8存在下峰电流增敏较大,且催化波灵敏稳定。在pH5.8-7.8范围内,峰电流随pH的增加而增加,当pH=7.8时峰电流达最大值,当pH大于7.8时峰电流有所降低。故选取pH=7.8的0.02 mol/L Na2B4O7-0.32 mol/L H3BO3缓冲溶液。
2.1.3 DMG用量的影响
在Na2B4O7-H3BO3缓冲溶液中(pH=7.8),保持Co2+浓度不变,随DMG的浓度从2.0×10-6~5.0×10-5mol/L增加时,峰电流增加。当DMG浓度为5.0×10-6mol/L时峰电流达到最大值且稳定,故实验中选取DMG浓度为5.0×10-6mol/L。
2.1.4 氧化剂浓度的影响
试验了K2S2O8、NaNO2、KIO3 H2O2对Co-DMG吸附波峰电流的影响,结果表明:K2S2O8对极谱峰电流的增敏最大,催化波升高最大,选用K2S2O8作为氧化剂。此外,峰电流i”p随溶液中K2S2O8浓度的增大而增大,当浓度为4..0×10-3mol/L时峰电流达到最大值。本文选用K2S2O8 的浓度为4..0×10-3mol/L。
综上所述,本实验选择的最佳底液是:0.02 mol/L Na2B4O7-0.32 mol/L H3BO3-5.0×10-6mol/L DMG-4×10-3mol/L K2S2O8(pH=7.8)。
2.1.5 稳定性试验
在选定最佳底液中,峰高达最大值,在4h内波高基本不变,时间再延长波高有所下降。
2.1.6 线性范围及检出限
在选定底液中,吸附催化波二阶导数峰电流与Co2+浓度在8.0×10-10~5.0×10-6 mol/L范围内呈线性关系。线性回归方程为:i”p / nA=3.244×109CCo2+/ mol/L-2.031(n=6,r=0.9972),检出限为5.0×10-10mol/L,本方法的分析灵敏度比基于吸附还原波的灵敏度提高了两个数量级。
2.1.7 共存离子的影响
试验表明,Na+ 、K+、NH4+、Cl-、SO42-、NO3-等离子不干扰测定,对于5.0×10-7 mol/L Co2+,相对误差不超过 5%时,下列离子共存(倍数)时无干扰:Mn2+(1000)、Mg2+(500)、Sr2+(500)、Al3+(2000) 、Cu2+(1000) 、Sn2+(2000) 、Pb2+(1000) 、Cr3+(1000) 、Ag+(1000)、Cd2+(1000)、Fe3+(500)、Ni2+(20)、Zn2+ (25)。
2.2 样品分析及结果
准确移取尿液20mL、饮用自来水5mL和VB12注射液2mL分别置于烧杯中,各加8mL1:1 HNO3,置电热板上低温加热硝化,蒸发至近干,冷却后加水溶解并于100mL容量瓶中定容。分取部分样液,按实验方法测定。根据校准曲线求得样品中Co2+的含量,同时在试样中做加标回收实验。并用原子吸收法作对照,结果见表1。
表1 样品分析结果
Tab.1 Analytical results of sample
样品 |
测定值 |
RSD |
加入值 |
测定总量 |
回收率 |
原子吸收法 |
尿液 |
6.30 |
2.8 |
5.00 |
11.2 |
98 |
6.05 |
自来水 |
55.0 |
2.3 |
10.0 |
65.4 |
105 |
51.0 |
V B12注射液 |
2.10 ×104 |
1.6 |
1.00 ×104 |
3.05 ×104 |
95 |
2.02 ×104 |
2.3.1 催化波的表征
首先,在K2S2O8 浓度4.0×10-5-8.0×10-3mol/L范围内,催化波峰电流ipl随K2S2O8浓度的增加而增加,且催化波峰电流和相应的还原波峰电流ip比值 ipl / ipc与K2S2O8浓度平方根成线性关系。关系方程为:ipl/ipc= -132.4CK2S2O81/2(r=0.9948,n=5)。表明K2S2O8参加了平行于电极反应的化学催化反应。其次,按照单扫描极谱法电流理论,吸附波的电流函数定义为ipv-1,实验表明还原波和催化波的电流函数ipv-1不同,催化波电流函数随扫描速率从0.25V/s到0.40V/s的增大而下降,当v>0.40V/s后随扫描速率的增大而基本保持不变。但无K2S2O8时的还原波电流函数随扫描速率增大基本保持不变。以上两实验结果表明:Co(Ⅱ)-DMG在K2S2O8存在下产生了平行催化波[9]。

图2 电流函数与扫描速率的关系曲线
Fig.2 Relation between current function ip v-1 and scan rate v 2.3.2 催化波产生机理
Co(Ⅱ)与DMG配合形成具有吸附性的1:2的配合物,该配合物吸附于电极表面后,配合物中的Co(Ⅱ)得到电子还原为Co并与Hg生成钴汞齐Co(Hg),产生吸附还原波[10]。在强氧化剂K2S2O8存在下,S2O82-可将Co(Hg)中的Co氧化成Co(Ⅱ)回到溶液中,再生原电活性物质Co(Ⅱ)-(DMG)2,该物质再次被还原,形成催化循环,使极谱电流大为增加,产生了配合吸附催化波,电极反应式表示如下:
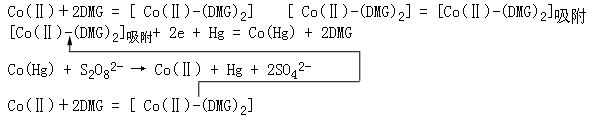
REFERENCES
[1]中华人民共和国国家标准.GB/T 8538.29-87,北京:国家标准出版社,1987.
[2] Mi J P , Li Y Q, Zou X Let al. Spectroscopy and Spectral Analysis(Guangpuxue Yu Guangpuyu Fenxi ), 2007, 27(6):1188-1191
[3] Xue G R ; Xia M Y . Metallurgical Analysis(Yejin Fenxi), 2007, 27 (6):69-71..
[4] Qian Y H. Physical Testing and Chemical Analysis Part B Chemical Analysis(Lihua Jianyan-Huaxue Fence), 2004, 40 (7): 403-407.
[5] Wang X L, Zeng Y , Lu G H.. Journal of Central Chia Normal University(Huazhong Shifan Daxue Xuebao), 2006, 40(2): 230-233.
[6] Yang L Z, Chen D H, Liu W et al. Chinese J Anal Chem (Fenxi Huaxue), 2005,33 (5): 675-679
[7] Zhang Z S, Qiu Z H,Zhou Y L . Physical Testing and Chemical Analysis Part B Chemical Analysis (Lihua Jianyan-Huaxue Fence), 2007,43(2): 128-131
[8] Zhang Z.X, Tu Y F. Chem.J.Chin.Univ.(Gaodeng Xuexiao Huaxue Xuebao), 1985, 6(5): 404-408.
[9] Zhang Z X. Chem. J. Chin. Univ.(Gaodeng Xuexiao Huaxue Xuebao), 1982, 3(4): 466-474.
[10] Nie Y M, Li L, Zhou C et al.. Acta Chimict Sinica (Huaxue xuebao), 1987, 45(10):971.