http://www.chemistrymag.org/cji/2002/041002rc.htm |
Jan. 1,
2002 Vol.4 No.1 P.2 Copyright |
Recent progress in studies of cationic liposome as gene vectors
Zhu Manzhou, Wu Qihua, Guo Qingxiang
(Department of Chemistry, University of Science and Technology of China, Hefei 230026)
Abstract Gene therapy is dependent on the
development of gene vectors. Cationic liposome may be a potential candidate in the gene
delivery. The methods of forming cationic liposome as gene vectors, mechanism of
gene transfection, and structure-activity relationship of cationic liposomes have been
reviewed. The problems and further studies in this area were discussed.
Keyword gene vector, cationic liposome, molecular design, structure-activity
relationship, mechanism
朱满洲
吴其华 郭庆祥(中国科学技术大学化学系,合肥 230026)
2001
年8月4日收稿,国家自然科学基金项目(批准号:29772031)摘要 基因治疗的关键有赖于基因转移载体研究的突破。阳离子脂质体作为基因载体应用前景看好。本文从用于基因转移载体的阳离子脂质体的形成方法,转染基因的机理,形成阳离子脂质体的正离子类脂化合物的结构,以及构
-效关系等方面综述了自1987年第一例阳离子脂质体作为基因转移载体以来该领域的研究进展,并提出了这一领域存在的问题和研究趋势。关键词 基因载体,阳离子脂质体,分子设计,构-效关系,机理 基因治疗是把基因作为药物用于治疗疾病,或为达到治疗的目的通过载体把基因传送到病体并使之表达[1]。基因治疗所面临的首要困难是如何把供治疗用的基因高效的传送到特定的病变细胞或组织中去。 理想的基因载体应具备:1、靶向特异性,并且可被免疫系统识别;2、高度稳定,容易制备,可浓缩和纯化;3、无毒性,对病人及环境安全无害;4、有利于基因高效转移和长期表达[2]。
目前,在基因载体的设计上,大致可分为两大类:病毒类和非病毒类。在临床治疗成为可能以前两类载体都有许多问题亟待解决。阳离子脂质体作为临床上一种有效的基因载体系统,因其理论上无毒,易制备,可容纳很大外源基因而受到青睐,应用前景乐观[3]。 1. 用作基因载体的阳离子脂质体
1987年,Felgner及其同事首先提出了阳离子脂质体在基因转移方面的应用[4]。迄今为止,在基因转移方面已有30余种新的阳离子脂质体问世(见表1),其中一些已进入临床研究。这些脂质体通常由一种合成的正离子类脂化合物和DOPE或另一种中性脂质体组合而成。
1.1 正离子类脂化合物的结构
已经报道的正离子类脂化合物可分为如下几类:DOTMA类似物,复杂烷基胺/酰胺复合物,胆固醇衍生物,芳香环衍生物,双棕榈酰基-L-b -磷酯酰乙醇胺、谷氨酸、咪唑、磷酸盐的衍生物等。
表
1 已知主要的阳离子脂质体[a]已商业化的 |
|
||
正离子类脂分子 |
阳离子脂质体 |
正离子类脂分子 |
阳离子脂质体 |
DOTMA 1 |
DOTMA/DOPE 1:1 |
DMRIE 4 |
DMRIE/DOPE 1:1 |
(lipofectin/GIBCO BRL) |
DORIE 6 |
DORIE/DOPE 1:1 |
|
DOTAP 3 |
DOTAP/DOPE |
YKS—220 9 |
YKS—220/DOPE |
(Bochringer Mannheim) |
14 Dea 2 12 |
14 Dea 2 |
|
DOSPA 5 |
DOSPA/DOPE 3:1 |
GS2888 15 |
G 2888/DOPE 1:1 |
(LipofectAMINE/GIBCO BRL) |
DC-Chol 16 |
DC-Chol/DOPE 6:4 |
|
DOGS 11 |
DOGS |
cholic acid hexamine 19 |
19/DOPE 1:1 |
(Transfectam/Promega) |
lipid 67 22 |
lipid 67/DOPE 1:2 |
|
DiC14amidine 13 |
di C14 amidine/DOPE 1:1 |
CTAP 23 |
CTAP/DOPE 1:2 |
(Clonfectin/Clontech) |
BGTC 25 |
BGTC/DOPE 3:2 |
|
DDAB14 |
DDAB/DOPE 1:2.5 |
DPPES 28 |
DPPES |
(LipofectAce/GIBCOBRL) |
Lys-Pam2-GroPEtn 29 |
Lys-Pam2GroPEtn/Chol/eggPC1.5:3.0:5.5 |
|
Cholesterylspermidine 24 |
cholesterylspermidine |
L-PE 29 a |
L-PE/ECb A 46 6:4 |
(Transfectall/Apollon Inc.) |
2C12-L-Glu-ph-C2-N+Br- 31 |
2C12-L-Glu-ph-C2-N+ |
|
2C14-L-Glu-C2-N+Cl- 32 |
2C14-L-Glu-C2-N+ |
||
DOTIM 33 |
DOTIM/Chol 1:1; DOTIM/DOPE 1:1 | ||
DiC-14:0 27 |
diC-14:0/Tween80 |
||
VitD2 derivatives 20 |
20 /DOPE |
||
VitD3 derivatives 21 |
21/DOPE |
||
OOCE 10 |
OOCE/chol |
||
DOTMA类似物在阳离子脂质体的组成中已得到最为广泛的应用和研究。主 要类似物有DOTAP(3),DMRIE(4)和DOSPA(5)。其它和DOTMA相似的结构还有DORIE(6)和其相应的酯DORI(7),以及DMRIE,DORIE,DORI的同系物。此外还有最近报道的GAP-DLRIE(8),YKS-220(9),肉碱衍生物OOCE(10)及其同系物。在研究DOTMA作为基因载体的构效关系时,还合成了一系列氨基上不同烷基的正离子衍生物,不同长度连接链的二醚,醚/酯,二酯衍生物。


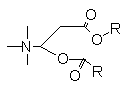
![]()


14 Dea 2 12
DOGS 11


DDAB 14
di C14 amidine 13

GS 2888 15





28 DPPES 29


Lys-Pam-GroPEtn 30 31


2G12-L-Glu-Ph-C2-N+Br- 32
2G14-L-Glu-C2-N+Cl-
33


DOTIM 34
GLB43 35
GLB90 36
由正离子类脂化合物形成阳离子脂质体(有或没有中性类脂化合物)有许多不同的可行性方法。大体上说,这些过程包括超声和/或水溶液的旋转混合、反向蒸发、及乙醇储液的稀释(aqueous dilution of an ethanolic stock solution)。形成阳离子脂质体的方法无疑是很重要的,但这些方法对基因转染的效率的影响尚没有合适的评估。 2. 阳离子脂质体转移基因的机理
阳离子脂质体用于基因转移的机理是很复杂的。最初,Felgner和Ringold 认为阳离子脂质体通过静电作用与DNA结合,并且这种作用不会改变复合物的大小及形状。实际上阳离子脂质体/DNA复合物形状和大小与阳离子脂质体和DNA的摩尔比有关,且存在动态变化。当正负电荷比例接近于1时,结构上发生明显变化。Gershon等人[5]在实验的基础上提出阳离子脂质体可能有效地中和带负电荷的DNA,从而导致DNA的结构上的相应“倒塌”,“倒塌”的DNA由于裸露的表面积变小,所以能够被脂质体有效地包住。从Rüdler等人在研究DOPE/DOTAP(1:1)阳离子脂质体与l-phageDNA复合物的X-衍射中所获得的数据已证实了DNA的这种被包裹的性质[6]。Behr指出DNA可以包裹在阳离子脂质体的表面,并被Easman 等人[7]证实。因此,阳离子脂质体/DNA的相互作用包括两个完全包裹和表面结合的观点也许更接近事实。
阳离子脂质体/DNA复合物进入细胞是阳离子脂质体转移基因的第一步。以前通常认为脂质体与细胞膜间的融合是脂质体转移DNA进入细胞的主要机制,而现有证据表明复合物的整体缓慢内嗜作用才是主要的机制,这种作用通过蛋白多糖相互作用调控。Bohr等[8]首先提出这一假设,Zabner等通过实验观察到这一过程。尽管有关内噬作用和核小体定域作用的证据很充分,但实验表明进入细胞的过程也包含着细胞膜与复合物融合的过程。
阳离子脂质体/DNA复合物进入细胞虽然比较慢,但效率较高。不过,不是所有进入细胞的基因都会发生作用。Zabner等人提出并用实验证明了这一 观点。大量的基因进入细胞后,都不能从核小体进入细胞质,绝大多数DNA以脂质体/DNA超分子的形式聚集在核周围的核小体中。有证据表明,基因脱离核小体束缚的行为发生在内噬作用后, 嵌入核小体的前期,目前这一机理尚不清楚。最近,Xu和Szoka提出了早期核小体断裂的模型[9]。
进入细胞质后,基因在进一步进入细胞核以达到治疗的目的上还面临着更大的困难。当然,如果辅以转移的是mRNA,则没有必要进入细胞核就可以发挥作用。要进入细胞核,就面临着基因转移到细胞核的效率问题。基因的大小是决定它们能否进入细胞核的最主要的因素。小的寡聚核苷酸(约20~30个碱基对),无论是由阳离子脂质体转移的,还是通过胞质注射都易到达细胞核。因为核膜只有能通过40Kda以下的微孔,较大的DNA不能自由进入。当然,这并不是说较大的DNA都不能进入细胞核,否则,转移的基因就不能表达。微孔的大小要求较大的DNA需要在协助下进入细胞核。

3. 阳离子脂质体作为基因载体的构-效关系研究
阳离子脂质体作为基因载体的构-效关系现在尚不十分清楚。形成阳离子脂质体的正离子类脂化合物一般由四部分组成:一个或多个带有正电荷的头部(head),一个有不同长度的连接链(spacer),连接键(linker bond)及疏水尾部(hydrophobic tail)。
正离子头部与DNA磷酸酯离子之间的静电引力是脂质体-DNA复合物形成的主要作用力。同样,静电引力也是脂质体-DNA复合物与细胞膜之间的主要作用力。这种作用力对转染效率及毒性有很大影响。除含脒基的脂质体外,其余阳离子脂质体的极性头部都包含胺类基团,从简单的氨基到被甲基或羟乙基团取代的季铵盐,以及多胺等。在阳离子胆固醇衍生物中,带有叔胺基团的阳离子胆固醇衍生物比季铵盐化合物有更佳的转染效率,并且毒性小得多。而DOTMA及其类似物都是季铵盐。带有多价极性头基团的正离子类脂分子形成脂质体时比那些单价正离子类脂分子排列得紧密,这可能与转染能力较高有关。
连接链的长度对某些脂质体的转染效率十分重要,带有长连接链的类脂分子能显著增强与粘膜表面的相互作用。
连接键是类脂分子很重要的组成部分,它决定了正离子类脂分子的化学结构稳定性和被生物降解的难易程度。如DOTMA和DDAB含有醚键或酰胺键,化学稳定性好,但不易降解,不适用于体内实验。含有酯键的正离子类脂分子如DOTAP较易发生生物降解,细胞毒性小,但它们的化学稳定性通常较差,酰胺键如DOGS,甲酰键如DC-Chol 缩酮(缩醛) 键因其较稳定且可生物降解而被采用。
正离子类脂分子的疏水部分主要有两类:一类是脂肪链,另一类是胆固醇环。胆固醇环作尾部有维持脂质体排列有序化,保持脂双尾膜的刚性,且胆固醇在生物体大量存在,不会引起免疫反应。文献已报道的以胆固醇作为疏水尾部的阳离子用于基因治疗的效果比用脂肪链作尾部的阳离子分子好。迄今为止转染效率最高的两个阳离子脂质体均以胆固醇为尾(Lipid 67和CTAP)。另外面型两亲性正离子类脂分子用于基因转移也具有重要意义。
在探索阳离子类脂分子结构与基因转染效率的关系中,Akao等人提出成功转染的基本要求是阳离子脂质体的相转移温度Tc要小于37℃。但对含DOTMA类似物的脂质体的分析不支持这种观点。转染效率可能部分地是由阳离子脂质体的ξ电势来决定,而细胞毒性可能是影响转染效率的最重要因素。 4. 阳离子脂质体作为基因载体存在的问题及应用前景
阳离子脂质体作为一类有效的基因载体已经进入临床试验,用于黑色素瘤,癌症,艾滋病的治疗。但是阳离子脂质体在应用上仍然存在许多问题亟待解决:阳离子脂质体/DNA复合物对靶组织无定向识别性;阳离子脂质体和基因的结合效率不高,从而导致转染基因所需的阳离子脂质体的量大大超过医疗所需;阳离子脂质体/DNA复合物进入细胞的效率低;阳离子脂质体/DNA复合物进入细胞后,大多数基因被陷于核小体中,释放困难。为了提高阳离子脂质体的转染效率和专一性,一些研究小组设计合成新的阳离子脂质体,使其形成带多个正电荷[10];改进阳离子脂质体和阳离子脂质体/DNA复合物的形成方法,在阳离子脂质体中引入适当的配体,如:含磷的类脂化合物[11]、糖类化合物、蛋白质、肽[12];将阳离子脂质体与病毒类载体混合应用[13-15];加入辅助试剂[16] ,以达到增加细胞识别能力,使DNA混合物很好地到达细胞内,使基因易释放;通过各种研究手段分析阳离子脂质体作为基因载体的机理[17]。相信随着研究工作的进一步深入,问题将会不断得到解决。作为造福人类的新技术,在不久的将来,阳离子脂质体辅助基因治疗定会成为临床现实。 REFERENCES
[1] Miller A D. Angew. Chem. Int. Ed., 1998, 37: 1768-1785.
[2] Crystal R G. Science, 1995, 270: 404-410.
[3] Gao X, Huang L. Gene Ther., 1995, 2: 710-722.
[4] Felgner P L, Gadek T R, Holm M et al. Proc. Natl, Acad. Sci. USA 1987, 84: 7413-7417.
[5] Gershon H, Ghirlando R, Guttman S B et al. Biochemistry, 1993, 32: 7143-7151.
[6] Radler J O, Koltover I, Salditt T et al. Science, 1997, 275: 810-814.
[7] Eastman S J, Siegel C, Tousignant J et al. Biochem. Biophys. Acta., 1997, 1325: 41-62.
[8] Behr J P. Acc. Chem. Res., 1993, 26: 274-278.
[9] Xu Y, Szoka Jr. F C. Biochemistry, 1996, 35: 5616-5623.
[10] Yamazaki Y, Nango M, Matsuura M. Gene Ther., 2000, 7 (13): 1148-1155.
[11] Romero E L, Morilla M J, Bakas L S. Medicina-Buenos Aires, 2001, 61 (2): 205-214.
[12] Murray K D, Etheridge C J, Shah S I. Gene Ther., 2001, 8 (6): 453-460.
[13] Natsume A, Mizuno M, Ryuke Y et al . Jap J. Cancer Res., 2000, 91 (4): 363-367.
[14] Song J J, Kim J H, Lee H et al . Oncology Reports FEB, 2000, 7 (1): 119-124.
[15] Tu G, Kirchmaier A L, Liggitt D et al . J. Biological Chem., 2000, 275 (39): 30408-30416.
[16] Weiss D J, Bonneau L, Liggitt D. Molecular Ther., 2001, 3 (5): 734-735.
[17] Serikawa T, Suzuki N, Kikuchi H et al . Biochim. et Biophys. Acta-Biomembranes, 2000, 1467 (2): 419-430.