http://www.chemistrymag.org/cji/2002/042007nc.htm |
Jan. 2,
2002 Vol.4 No.2 P.7 Copyright |
(Xiamen University, Key Laboratory for Marine Environmental Science of Ministry of Education /Environmental Science Research Center, Xiamen, Fujian,
361005, China; #Fujian Meizhou Bay Environmental Monitoring Station, Putian, Fujian, 351158, China)Received Sep.
20, 2001; Supported by Natural Scientific Foundation of China (No. A20077023). Abstract With the rapid development of port construction and petrochemical industry in Meizhou Bay area, discharge of pollutants (especially for oil spills) is increasing. It is important to assess their impact on the environmental quality and biological effects. In November 2000 , water and marine fish (Pagrosomus major, in the fish cages) samples were collected near a large petrochemical firm (M2 station) and a control site (M1 station) in Meizhou Bay. Polycyclic aromatic hydrocarbons (PAHs) in water samples were analyzed by GC-MS coupled with SIM mode. The activities of catalase (CAT), superoxide dismutase (SOD), glutathione peroxidase (GPX) and lipoperoxide (LPO) in the liver, gill and blood of fish samples were analyzed. Results showed that PAHs concentration in M2 station was higher than that in M1 station; and LPO, GPX activities in liver, gill and blood of Temminck et Schlegel in M2 station were stronger than that in M1 station, on the contrary, SOD activity in liver, gill and blood of Pagrosomus major in M2 station was weaker than that in M1 station; CAT activities in liver, gill and blood of Pagrosomus major in M2 station and M1 station were not significantly different. This study denotes that the indexes of LPO, SOD and GPX could be used as good biomarkers to indicate the PAHs pollution in the marine environment.Keywords Polycyclic aromatic hydrocarbons (PAHs), biomarker, Pagrosomus major, catalase (CAT) ,superoxide dismutase (SOD), glutathione peroxidase (GPX), lipoperoxide(LPO)
真鲷的抗氧化防御系统对海洋环境中的多环芳烃暴露水平的指示作用的初步研究
洪华生,林建清,王新红,黄哲强
#,郑微云(厦门大学海洋环境科学教育部重点实验室/厦门大学环境科学研究中心 厦门 361005; #福建省湄洲湾环境检测站 莆田 351158)
2001
年9月20日收稿,国家自然科学基金资助项目(A20077023).摘要
随着海岸带地区港口建设和工业的迅猛发展,有机污染物的排放(尤其是石油泄漏事件)呈增加趋势,因而有必要监测污染物的排放对环境质量的影响以及所带来的生物效应。基于这些目标,我们于2000年11月采集了湄洲湾某炼油厂附近(M2站位)及参考站位(M1站位)的水样及养殖真鲷的样品。用GC-MSD的SIM模式为手段分析了水样中的多环芳烃含量,并分析了真鲷的肝、鳃及血液中的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、过氧化氢酶(CAT)、脂质过氧化(LPO)的活性。结果显示:M2站位的PAHs含量显著地高于M1站位;M2站位的真鲷的肝、鳃、血液的SOD活性显著地低于M1站位,在M2站位的真鲷的肝、鳃、血液的LPO、GPX活性显著地高于M1站位,M2站位与M1站位的真鲷的肝、鳃、血液的CAT活性无显著差异。这提示真鲷体内的LPO、SOD及GPX指标可用来指示海洋环境中的多环芳烃的暴露水平,也可同时用来指示这些毒物的生态环境效应。关键词 多环芳烃(PAHs), 真鲷,超氧化物歧化酶(SOD),谷胱甘肽过氧化物酶(GPX),过氧化氢酶(CAT),脂质过氧化(LPO),生物标志物
多环芳烃是广泛分布于自然界的一类痕量有机污染物,其主要来源于人类的活动
—油料、木材和其它有机材料的燃烧过程。由于对机体的高度毒性、持久性和生物富集效应;多环芳烃在环境污染物研究中备受关注。美国EPA选定了16种多环芳烃作为水生生态系统优先监测的指标。在正常的生理条件下,动物体内代谢产生的活性氧可被抗氧化防御系统有效清除。但是,当机体暴露于可产生氧化还原循环的污染物如多环芳烃时,若活性氧产生的速度超过机体抗氧化防御系统的清除能力,就可使DNA断裂、脂质过氧化、酶蛋白失活等,从而引发机体的毒性效应。脂质过氧化与抗氧化防御系统的变化相结合,既可反映具有氧化还原活性的污染物的暴露,又可反映生物受到氧化胁迫的程度;因此应用这些生物效应监测来指示海洋环境质量受到高度重视[1]。灵敏的生物监测技术能够提供生态系统的早期预警指标。
过去,环境监测的研究主要集中在监测污染物的浓度及存在形式,这意味着这些研究只能给出污染物的某一方面的信息,而不是对生物体的效应。为了弥补这方面的不足,近来更多的环境监测研究将化学污染物的监测与污染物的暴露及/或效应的生物标志物连接在一起研究。这种研究已经证实是一种评价水生生态环境的有效方式[1]。
本文应用GC-MSD(SIM模式)分析了湄洲湾水环境中的PAHs含量,并测定了真鲷的肝、鳃、血液的LPO、GPX、CAT、SOD的水平,讨论了PAHs水平与抗氧化效应的相关性,并探讨了以LPO、GPX、CAT、SOD指标作为生物标志物的可能性。 1 材料和方法
1.1 试剂
PAH标样(16种PAHs的混标),内标(苊烯-d10, 菲-d10 及屈-d12的混合物)(购自SUPECOTOL公司);牛血清白蛋白(BSA),1,1,3,3-四乙氧基丙烷(TEP)(购自Sigma化学品公司);考马斯亮兰G-250(CBB G-250)(购自Fluka化学品公司);还原型谷胱甘肽(购自AMRESCO公司);其它所有试剂均属分析纯或HPLC级。
1.2 主要仪器
HP Ultra VCA 1024型紫外可见分光光度计(美国HP 公司);F-4500型荧光分光光度计(日本岛津公司);Beckman J2-MC 型冷冻离心机(美国Beckman 公司);HP 6890 Plus气相色谱仪(美国HP 公司)。
1.3 采样站位
图
1.4
水样的预处理将2L的水样加入内标,然后通过ENVI-18 固相萃取柱萃取,再用一定量的乙酸乙酯洗脱,经浓缩、干燥后进色谱仪分析。
1.5 水样中多环芳烃的分析
PAHs用HP6890 plus及MSD检测器来分析。色谱柱:HP-5MS熔融毛细管柱(30m×0.32mm×0.25um);进样温度:280OC; 检测器温度:300 OC。程序升温:60OC保持2min,以10OC/min升至120 OC,再以3 OC/min升至300 OC,保持10min。载气为高纯氦气,流量为1ml/min。进样器:2.0ul(自动进样)。用HPMSD化学工作站收集数据。
1.6 生物样的预处理
取M1和M2站位网箱养殖的体重为250~300克的真鲷样品,现场采集真鲷的血、肝和鰓,并马上置于液氮中保存。回到实验室立即将肝、鳃样品用玻璃匀浆器匀浆20sec,离心(6,000g, 0 OC下离心15min),析出上清液,置于小离心管中,并在液氮下冷冻保存,直至进行生化分析。血液用Milli Q水以1:10稀释,置于小离心管中,并在液氮中冷冻保存,直至进行生化分析。
1.7 生物样的生化分析
用考马斯亮兰法测定样品中的蛋白质含量[2],用活性抑制的紫外可见分光光度法测定CAT的活性[3],用荧光分光光度法测定GPX的活性[4],用硫酸巴比妥荧光分光光度法测定LPO的活性[4],用邻苯三酚自氧化法测定SOD的活性[5]。
 图2 SOD活性的比较 |
 图3 LPO活性的比较 |
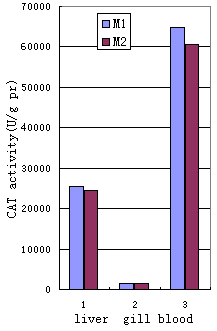 图4 CAT 活性的比较 |
 图5 GPX活性的比较 |
水样中的PAH测定结果见表1,真鲷的血、肝、鳃中的SOD、LPO、GPX及CAT的测定结果见图2到5。M1站位和M2站位的SOD、LPO、GPX及CAT的活性值差异(T值)见表2。
表
1 PAHs在湄洲湾M1站位和M2站位的水样中的含量PAHs(ng/L) |
萘 |
苊 |
芴 |
蒽 |
荧蒽 |
芘 |
屈 |
SPAHs |
站位 M1 |
102.02 |
4.66 |
18.27 |
0.60 |
50.9 |
17.95 |
37.35 |
231.74 |
站位M2 |
158.15 |
5.41 |
14.73 |
43.6 |
16.07 |
80.72 |
318.67 |
注:其它在表中未列出的
PAHs在这些样品中未检测到表
2 M1站位和M2站位的真鲷的肝、鳃及血液中SOD, LPO, GPX及 CAT 的活性差异的显著性比较(T值)T 值 |
SOD |
LPO |
CAT |
GPX |
肝 |
1.945 |
-3.762 |
0.916 |
-2.563 |
鳃 |
3.075 |
-1.008 |
0.385 |
-3.415 |
血液 |
4.292 |
-2.353 |
1.322 |
-3.828 |
从表1的结果可知,湄洲湾M1和M2站位的水质均受到多环芳烃的污染,M2站位的多环芳烃的含量显著地高于M1站位。
超氧化物歧化酶(SOD)是一类金属酶[6,7],它是生物体内消除超氧化物自由基的天然抗氧化剂[8]。它能有效地将O2-歧化或分解为H2O2及O2。生化研究表明,SOD存在于所有的需氧组织中,且在肝、肾的组织中活性最强。多环芳烃在生物体内能被代谢并产生自由基,而自由基能导致氧化损伤。SOD指标与PAH的暴露具有良好的关系[9]。我们的研究结果表明:SOD活性在不同组织的活性次序为:肝>血>鳃(图2),这一活性次序与唐学玺等人以蒽对黑鲪超氧化物歧化酶活性的影响的实验结果一致[9]。我们的现场研究结果同时表明:环境中的PAHs浓度越高,则真鲷体内的SOD活性越低。真鲷体内的肝、血、鳃中的SOD活性可用来指示海洋环境中的PAHs的暴露水平(图2及表2)。
在正常的需氧代谢过程中会产生自由基[10, 11],活性氧的产生可导致脂质过氧化并产生活性产物。这些活性产物可损伤细胞分子及结构。自由基可被抗氧化酶如:SOD,GPX及维生素E和C解毒。如果自由基的浓度超出抗氧化系统的解毒能力,将导致脂质过氧化的发生。研究结果显示:M2站位的真鲷体内的脂质过氧化水平显著地高于M1站位(图3)。这一结果表明:在现场研究中,环境中的PAHs浓度越高, 真鲷体内的脂质过氧化程度越高;因此,真鲷体内的脂质过氧化水平也可以用来指示海洋环境中的PAHs的暴露水平。现场研究结果同时显示:脂质过氧化水平从高到低的次序是:鳃>肝>血(图3);肝组织中的LPO水平比其它组织中的更为敏感(表2)。
谷胱甘肽过氧化物酶(GPX)能够将H2O2解毒,并能将脂质过氧化物转化为无毒的乙醇。Akgul E [12]的研究结果表明:正常人与糖尿病人的红血球中的GPX活性无显著差异。但是,张强[13]的实验结果却不同。他以小白鼠做实验,空气中的苯的浓度越高,小白鼠血液中的GPX的活性越高,且这种差异十分显著。我们的现场研究结果表明:真鲷的肝、鳃及血液中的GPX活性差异显著,且M2站位的GPX活性显著地高于M1站位。在组织中的GPX活性分布次序为:血>鳃>肝。这一分布次序与SOD 的活性分布次序不同。这一结果表明:在肝、鳃及血液中的GPX活性也可以用来指示海洋环境中的PAHs暴露水平(表2,图5)。
过氧化氢酶(CAT)能将H2O2解毒,并能将脂质过氧化物转化为无毒的乙醇[14]。我们发现:真鲷的肝、鳃及血液中的CAT活性,在M1及M2站位之间的变化并不显著(表2,图4)。
4 总结
从我们的现场研究结果表明,PAHs的暴露与真鲷的抗氧化效应(SOD,LPO,GPX)具有良好的相关性,可以用SOD,LPO,GPX指标作为生物标志物来综合指示海洋环境中的多环芳烃的暴露水平,但需要进一步深入探讨它们之间的定量关系。
REFERENCES
[1] Sole M. Trends in analytical chemistry, 2000, 19 (1): 1-9.
[2] Guo M L, Jiang Y M. Prog. Biochem. Biophys (Shengwu Huaxue Yu Shengwu Wuli Jinzhan).
1996, 23 (6): 558-561.
[3] Xu J B, Yuan X F, Lang P Z. Environmental Chemistry (Huanjing Huaxue). 1997, 16 (1):
73-76.
[4] Zhang X M , Shen Q L, Wang C H et al. Henan Medical Research (Henan Yixue Yanjiu).
1996, 23 (2): 175-9.
[5] Li J W, Xiao N G, Yu RY et al. Experimental Theory and Methods on
Biochemistry (Shengwu Huaxue Shiyan Yuanli He Fangfa). Beijing: Beijing Daxue Chubanshe,
2000, 318.
[6] Fridovich I. Accounts Chem. Res.,1972, 5: 321-326.
[7] Fridovich I. Science, 1978, 201: 875-880.
[8] Wilma M F, Klazina S B. Free Radical
Biology & Medicine, 1997, 22: 241-248.
[9] Tang X X, Zhang P Y. Journal of Fisheries of
China (Shuichan Xuebao), 2000, 24 (3): 217-220.
[10] Wolf S P, Jiang Z Y, Hunt J V. Free Radical
Biology & Medicine, 1991, 10: 339-352.
[11] Niwa Y, Kasama T, Miyachi Y et al. Life
Science, 1989, 44: 1655-1664.
[12] Akgül E, Ilhan N, Halifeoglu I et al. Plasma lipid peroxide levels and antioxidant
enzyme activities in Type II diabetics: relationship with diabetic microagiopatic
complications Atherosclerosis Volume: 130, Supplement 1, May, 1997, S9.
[13] Zhang Q, Zhang K, Lin L. J Labor Med (Laodong Yixue), 2000, 17 (2): 73-75.
[14] Mahfouz M M, Kummerow F A. J. Nutr. Biochem,
2000, 11: 293-302.