http://www.chemistrymag.org/cji/2001/034018pc.htm |
Apr. 1,
2001 Vol.3 No.4 P.18 Copyright |
Synthesis and antioxidative activity of rare earth complexes of PMBP-benzoyl hydrazone
Yang Zhengyin, Yang Rudong
(Chemistry and Engineering College, Lanzhou University, Lanzhou 730000)
Abstract The
1-phenyl-3-methyl-5-hydroxy-4-pyrazolyl phenyl ketone benzoyl hydrazone (H2PBB)
was prepared by condensation of 1-phenyl-3-methyl-4-benzoyl-5-pyrazolone with benzoyl
hydrazine. Six complexes of rare earths with H2PBB have been synthesized and
characterized on the basis of elemental analyses, IR, UV, 1H NMR spectra and
thermal analyses. The general formula of the complexes is RE(HPBB)3·3H2O
(where RE(III) = La, Pr, N, Eu,
Gd and Er). Besides, the scavenger effects on O2·- radicals of the ligand and its complexes were
determined.
Keyword Hydrazone, Rare earth complexes, Antioxidative activity
杨正银 杨汝栋
(兰州大学化学化工学院, 兰州 730000)
摘要 通过1-苯基-3-甲基-4-苯甲酰基-5-羟基吡唑酮与苯甲酰肼的缩合反应制备了1-苯基-3-甲基-4-苯甲酰基-5-羟基吡唑酮苯甲酰腙,同时合成了它的六种稀土配合物。并采用元素分析
IR、UV、1HNMR和DTA-TG对配合物进行了表征。配合物的分子式为RE(PBB)3·3H2O (RE(III) = La、Pr、Nd、Eu、Gd和Er)。此外测定了配合物对O2-·自由基的清除作用。关键词 腙 稀土配合物 抗氧化活性
生物体内通常靠超氧化歧化酶(SOD)清除过剩的自由基,使体内自由基浓度维持在健康需要的水平上。因此, SOD作为一种对O2-· 的天然清除剂备受重视。由于SOD价格昂贵且不易保存。所以研究能够歧化O2-·的小分子金属配合物作为SOD的替代物具有重要的意义。前期研究表明1-苯基-3-甲基-4-苯甲酰基-5-吡唑酮(PMBP)与异烟肼缩合的希夫碱金属配合物对O2-· 有明显的清除作用[1,
2], 为了研究PMBP其它衍生物及其配合物的生物活性又合成了1-苯基-3-甲基-4-苯甲酰基-5-羟基吡唑缩苯甲酰腙(H2PBB)及它的六种稀土(La、Pr、Nd、Eu、Gd和Er)配合物。并测定了配合物对O2-· 自由基的清除率。
1 仪器及实验
1.1试剂
氯化硝基四氮唑篮(NBT)A.R.,蛋氨酸(MET)A.R.,三羟甲胺基甲烷(TRIS)A.R.,三氯乙酸.(TCA) P.C.,硫代巴比妥酸(TBA) A.R. (以上均为上海试剂三厂产品)。核黄素(Vit B2) A.R. (上海化学试剂采购共应站分装厂)。a - 酮戊二酸A.R.(中国科学院微生物研究所)。苯甲酰肼A.R.
(上海化学试剂三厂)。
1.2 仪器测试
C、H、N在德国VarioEL元素分析仪上测定,
稀土含量用EDTA容量法测定; IR光谱(4000~200cm-1)
在Nicolet- 170SX FT-
IR波谱仪上用KBr压片法测量; 配合物的紫外光谱(190~300nm)在日本岛津UV- 240紫外可见光分光光度计上用无水乙醇溶剂作参比测量,中心离子的f-f
跃迁电子光谱用硫酸钡作参比,纯固体RECl3·6H2O样作对照压片(1mm)测380~600nm区间内的反射光谱得到;热分析在国产PCT- 2型热天平上,以a
- Al2O3为参比在静态空气中进行。1HNMR在Nicolet FT-
80A NMR波谱仪上用TMS作参比氘代氯仿作溶剂摄谱;
摩尔电导在无水乙醇溶剂中用DSS- 11A型电导仪测量。
1.3 对O2-· 清除率的测量
O2-· 在MET ¤
VITB2 ¤ NBT体系中产生(3),先用0.01M的TRIS- HCl缓冲溶液(pH=7.5)分别配制浓度为9mM的MET,54mM的VitB2和670mM的NBT溶液待用。取配好的NBT和MET溶液各1.5mL加入试管中,然后加入一定量的配合物溶液(对照组不加配合物),在避光条件下加入1.5mL Vit B2溶液,混匀后在日光灯下照射10min。用TRIS- HCl缓冲溶液和NBT等体积混合溶液作参比(不含MET和配合物),测560nm处的吸光度。由样品吸光度(Ai)和对照组吸光度(A0)可求得配合物对O2-· 的清除率 = (A0-Ai) ¤ A0。
1.4 配体的合成
取PMBP 2.224克(8 mmol)、再取苯甲酰肼1.088克(8 mmol)溶于50
ml无水乙醇中、水浴回流2h。开始溶液为黄色清液、最后有大量黄色沉淀生成、抽滤、干燥得黄色结晶2.94克、产率92%、m.p.198-9°C。
1.5 稀土配合物的合成
称取配体(H2PBB) 0.38 g (1mmol)、加水50mL、加热搅拌、用10%的NaOH溶液调pH=8,此时配体全溶、然后加入0.32 g LaCl3·6H2O(过量)、此时溶液pH=5,搅拌10
min后趁热过滤,用少量乙醇洗涤,真空干燥、得粉末样0.31g、产率72%。用同样的方法分别合了Pr、Nd、Eu、Gd
和 Er另外的五种三价稀土配合物。全部配合物均为黄色,产率分别为:73、78、65、79、67%。
2 结果及讨论
2.1 配合物的组成及基本性质
系列配合物为黄色,易溶于无水乙醇、氯仿二甲亚砜等极性有机溶剂,微溶于水,在通常状况下能长期稳定存放。元素分析结果及摩尔电导数值均列于表1。结果表明配合物分子式为RE(PBB)3·3H2O,
摩尔电导值在2.56– 5.01s·cm2·mol-1之间,表明配合物在无水乙醇中为非电解质。这说明配合物中存在着稳定的多啮螯合环。
表1 配和物的元素分析结果及摩尔电导值
| 配合物 | 颜色 | 产率(%) | C% |
H% |
N% |
RE% |
摩尔电导 S·cm2 · mol-1 |
||||
| 计算 | 测量 | 计算 | 测量 | 计算 | 测量 | 计算 | 测量 | ||||
| La(PBB)3·3H2O | 黄 | 72 | 62.70 | 62.59 | 4.61 | 4.63 | 12.20 | 12.28 | 10.08 | 10.32 | 2.56 |
| Pr(PBB)3·3H2O | 黄 | 73 | 62.61 | 62.52 | 4.60 | 4.53 | 12.18 | 12.09 | 10.21 | 10.51 | 3.48 |
| Nd(PBB)3·3H2O | 黄 | 78 | 62.46 | 62.38 | 4.59 | 4.47 | 12.15 | 12.17 | 10.43 | 10.63 | 3.96 |
| Eu(PBB)3·3H2O | 黄 | 65 | 62.11 | 62.09 | 4.56 | 4.48 | 12.08 | 11.98 | 10.92 | 11.01 | 2.77 |
| Gd(PBB)3·3H2O | 黄 | 79 | 61.88 | 61.98 | 4.55 | 4.47 | 12.04 | 12.01 | 11.26 | 11.26 | 3.23 |
| Er(PBB)3·3H2O | 黄 | 67 | 61.44 | 61.35 | 4.51 | 4.39 | 11.95 | 12.03 | 11.98 | 11.89 | 5.01 |
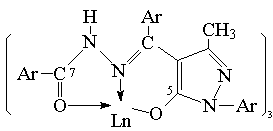
图1 配合物结构示意图
2.2 IR光谱
配体(H2PBB)和配合物的主要IR数据见表2,比较配体及配和物的IR光谱可知,配合物分别在3367和1600cm-1附近新出现了水分子的
表2 配体及配合物的主要IR光谱数据
| 配合物分子式 | nOH | nNH | nC7=O | nC=N | nC5=O | dHOH | dNNH | nC=N (吡唑环) | rC-H (ph) | nM-O | nM-N |
| H2PBB | 3055w | 1645m | 1593m | 1541m | 1521w | 1481s | 754s 700s | ||||
| La(PBB)3·3H2O | 3363m | 3058m | 1629m | 1567m | 1434m | 1599m | 1539m | 1481s | 757s 698s | 458w | 351m |
| Pr(PBB)3·3H2O | 3363m | 3058m | 1629m | 1569m | 1435m | 1599m | 1540m | 1481s | 757s 698s | 455w | 349m |
| Nd(PBB)3·3H2O | 3367m | 3057m | 1630m | 1569m | 1436m | 1600m | 1540m | 1482s | 757s 698s | 454w | 350m |
| Eu(PBB)3·3H2O | 3367m | 3057m | 1630m | 1569m | 1436m | 1599m | 1540m | 1484s | 757s 696s | 455w | 349m |
| Gd(PBB)3·3H2O | 3367m | 3058m | 1632m | 1570m | 1436m | 1602m | 1541m | 1482s | 757s 696s | 455w | 349m |
| Er(PBB)3·3H2O | 3367m | 3058m | 1630m | 1571m | 1435m | 1601m | 1541m | 1485s | 757s 694s | 457w | 348m |
2.3 紫外光谱
配体及配合物的UV光谱有关数据列于表3。配合物有基本相同的UV吸收带,表明系列配合物有相同结构,与自由配体的UV相比,251nm的吸收带紫移到244nm,而300和354nm两条带红移到320和364nm。251nm的吸收带是配体中苯环的p →p * 跃迁,可归属为E2带。由于形成配合物后空间位阻增大而不能与螯合环共面,所以发生了紫移,而300nm的吸收带是苯环和吡唑环的B带。354nm的UV
带是吡唑环的K带,这两条带在配合物中均发生了红移。证明配体以烯醇式参于了配位,并且配合物中存在较大的共轭螯合环体系,这与IR光谱结论是一致。由于配合物在可见区内有吸收,所以中心离子
f-f 跃迁电子光谱(见表4.)有部分带被掩盖,根据仅存的三条带计算d =0.271 和0.341,说明配合物仅有少量的共价性,虽然各中心离子有不同的4f电子,但系列配合物都有相同的UV光谱,表明4f电子对配体影响不大。
表3 配体及配和物的UV光谱数据
|
l max (nm) | e×10-4 (L/ mol ·cm) |
||||
| l 1 | l 2 | l 2 | e 1 | e 2 | e 3 | |
| H2PBB | 251 | 300 | 354 | 2.777 | 1.288 | 1.006 |
| La(PBB)3·3H2O | 244 | 320 | 364 | 6.852 | 2.717 | 4.198 |
| Pr(PBB)3·3H2O | 244 | 320 | 364 | 6.852 | 2.359 | 4.451 |
| Nd(PBB)3·3H2O | 244 | 320 | 364 | 5.443 | 2.370 | 4.355 |
| Eu(PBB)3·3H2O | 244 | 320 | 364 | 7.079 | 2.401 | 4.193 |
| Gd(PBB)3·3H2O | 244 | 320 | 364 | 7.090 | 2.291 | 3.927 |
| Er(PBB)3·3H2O | 246 | 320 | 364 | 7.324 | 2.417 | 4.285 |
表4 中心离子f-f跃迁电子光谱数据及能级归属
| 配合物 | ncom (cm-1) | nquo (cm-1) | 能级归属 | 参数 |
| Pr(PBB)3·3H2O | 16949 | 16807 | 3H4→1D2 | b =0.9993 |
| 17182 | 17153 | 3H4→3P0 | δ =0.271 | |
| 20325 | 20704 | 3H4→3P1 | b1/2 =0.019 | |
| Nd(PBB)3·3H2O | 17007 | 17182 | 4I9/2→4G5/2 2G7/2 | b =0.9966 |
| 18939 | 19011 | 4I9/2→4G7/2 | δ =0.341 | |
| 19531 | 19455 | 4I9/2→4G9/2 | b1/2 =0.041 |
2.4 1HNMR
配体及配合物的1HNMR谱归属如下:配体(H2PBB)、
d (ppm),1.53 (3H,单峰,CH3),7.20~8.10(17H,多重宽峰,3ph-,NH,OH);配合物La(HPBB)3,d (ppm),1.31(3H,单峰,-CH3),6.80~8.16(15H,宽峰,3ph-),8.80(1H,单峰,-NH-)。配体的烯醇式OH和-NH-
均出现在低场,与苯环重叠在一起,形成配合物后,-OH氢被金属离子取代,-NH-向低场位移,与苯环分开。证明配合物确已形成,并且配体的肼基氢仍然存在。这与IR光谱结论一致。
2.5 热谱
配体及配合物热谱有关数据列于表5.自由配体在201℃有一吸热峰,热重曲线上未反映出失重,表明是相变过程,与熔点吻合,从283℃开始到547℃有3个放热峰。配合物在118~121℃范围内出了第一个吸热峰,失重率在4%左右,这是配合物的失水峰,约相当于4个水分子。从395℃开始到743℃配合物共出现了4个放热峰,全过程未观察到熔点。与配体相比形成配合物后分解点提高100℃,显然热温定性大大改善,这是螯合效应的贡献,证明配合物中存在螯合环。
表5 配体及配合物的热谱数据
配合物 |
失水峰 t1℃ | 失水率 (%) | 熔点 t2℃ | 放 热 分 解 峰 ℃ |
残重率 (%) | |||
| t3 | t4 | t5 | t6 | |||||
| H2PBB | 201 | 283 | 454 | 547 | ||||
| La(PBB)3·3H2O | 118 | 4.4 | 411 | 498 | 531 | 689 | 12.6 | |
| Pr(PBB)3 ·3H2O | 121 | 4.1 | 400 | 474 | 529 | 701 | 13.2 | |
| Gd(PBB)3·3H2O | 121 | 4.3 | 395 | 500 | 529 | 743 | 13.5 | |
表6 配合物对
O2-·的清除率| 配合物 | 配合物浓度 (102×mmol/L) | Ai | A0 | 清除率(%) |
| SOD* | 8.5 | 0.01 | 97 | |
| H2PBB | 19.83 | 0.21 | 36 | |
| La(PBB)3·3H2O | 13.63 | 0.19 | 42 | |
| Pr(PBB)3·3H2O | 9.10 | 0.17 | 48 | |
| Nd(PBB)3·3H2O | 8.57 | 0.16 | 51 | |
| Eu(PBB)3·3H2O | 15.52 | 0.16 | 51 | |
| Gd(PBB)3·3H2O | 11.61 | 0.19 | 42 | |
| Er(PBB)3·3H2O | 12.42 | 0.20 | 39 | |
| 对照组 | 0.00 | 0.33 |
2.6 配合物对O
2-·的清除作用由表6可见配体和配合物对O2-·自由基都有一定的清除作用,只是形成配合物后这种作用有所加强。与RE(HL)3·3.5H2O稀土配合物(1)比较,配体和配合物的作用都较差。总体上看配体与中性离子的协同作用使清除作用增强了。但增强比例因配体不同而异。标题配合物与RE(HL)3·3.5H2O的差别仅是配体前者用苯甲酰腙、后者用异烟酰腙。看来选择合适的配体对增强清除O2-·自由基的作用很重要。与SOD比较,标题化合物对O2-·自由基的清除率仅是SOD的一半左右(未考虑浓度的影响)。尽管如此但也证明了希夫碱稀土配合物确有清除O2-·自由基的活性,值得深入研究。
REFERENCES
[1] Yang Z Y, Yang R D, Li F S. Synth. Reac. Inorg. Met-org. Chem., 1999, 29 (2): 205.
[2] Yang Z Y. Synth. Reac. Inorg. Met-org. Chem., 2000, 30 (7): 1265.
[3] Winterbourn C C. Biochem. J., 1981, 198: 125.
[4] Nakamoto K, Infrared and Raman Spec. of Inorg. & Coord. Comp., Wiley &
sons, 1986: 251.