http://www.chemistrymag.org/cji/2001/039043pc.htm |
Sep. 1,
2001 Vol.3 No.9 P.43 Copyright |
Lu Yujuan, Zhu Xihai#
(Chemistry and Biology Department, Normal School, Shenzhen University, Shenzhen, 518060; #School of Chemistry and Chemical Engineering, Zhongshan University, Guangzhou, 5610275, China) Abstract Metal ion complex, [C12H8N2)3Fe2+], with surfactant Sodium dodecyl sulfate (DLS) complex in aqueous phase was carried out by solvent sublation. The best removal efficiency is obtained by the ratio of 20 times of surfactant (4.6×10-4 mol/L), with 90% within 20 min. The effects of electrolytes (e.g. NaCl), non-hydrophobic organics (e.g. ethanol), pH of the solution and solvent upon the process were studied. The solvent sublation process obeys the first kinetic, apparent activation energy of attachment of the sublate to bubbles, as a characteristic parameter, was put forward with the value of 12.18 KJ/mol.
Keyword solvent sublation, thermodynamic, dynamic, ferrous ion
亚铁邻菲啰啉络合物的溶剂气浮研究
吕玉娟 朱锡海#
(深圳大学师范学院化生系,深圳, 518060; #中山大学化学与化工学院,广州,510275)
2001年5月20日收稿
摘要 本文研究了亚铁邻菲啰啉络合物的溶剂气浮回收动力学及热力学规律。表面活性剂十二烷基磺酸钠 (4.6×10-4 mol/L) 与Fe(II) (2.3×10-5mol/L) 的摩尔比为20:1时,在20分钟内富集率达90%。同时考察了空气流速、pH、电解质NaCl、乙醇及不同溶剂对该体系溶剂气浮的影响。研究表明亚铁邻菲啰啉络合物-十二烷基磺酸钠的溶剂气浮过程符合一级动力学方程. 表观活化能被作为溶剂气浮过程的特征参数而提出,其值为12.18 KJ/mol.关键词 溶剂气浮 热力学 动力学 亚铁离子 1. 引言
溶剂气浮是一种水中微量、痕量组分分离与富集同时完成的新型气浮分离技术,它最先是由Sebba[1]作为离子-表面活性剂缔合物气浮的一种改进方法而提出来的。在溶剂气浮过程中,疏水性化合物吸附在气泡表面,随气泡上升遇到有机溶剂层(如矿物油、月桂醇等),气泡则在柱顶溢出,物质则被剥落而带入溶剂层[2,3]。
溶剂气浮方法在去除疏水性分子化合物及离子富集方面很有前景,但这方面的研究较少。本文将探讨溶剂气浮法从溶液中回收金属亚铁离子的方法及机理。本工作将通过加入十二烷基磺酸钠,使Fe(II)与邻菲啰啉形成的稳定的橙红色络合物通过溶剂气浮法来富集,气浮物质随上升气泡进入异辛醇有机溶剂。同时,将研究溶剂气浮过程的动力学和热力学,比较溶剂气浮法与传统分离方法的效率,研究如气流速率,水溶液对有机物的体积比及共溶质等多种参数对溶剂气浮过程的影响。
2. 实验
2.1 仪器与试剂
溶剂气浮实验是在自做的配有控温水套管的玻璃气浮柱内进行的[4],玻璃柱90
cm长,内径3.7 cm,有三个出口,从柱的中间出口取样。微孔径钛板作为布气板导入气泡进入溶液相,压缩空气经过减压阀减压后从布气板进入气浮柱中,转子流量计指示气体流速。
溶液的pH用pHS-3C(上海雷磁)测量, Unico PC2100 UV/VIS光谱仪来测量溶液紫外一可见光谱,测量波长为509
nm。所有的试剂和溶剂均为分析纯,不经进一步纯化。Fe(II)储备溶液:
1.8×10-3 mol/L, 十二烷基磺酸钠 (DLS) 储备液: 5×10-4 mol/L,
邻菲啰啉储备液: 2.2×10-2 mol/L。
2.2 实验方法
Fe(II) 在pH 3-9之间的溶液中与邻菲啰啉生成稳定的橙红色络合物,[(C12H8N2)3Fe2+],其测量波长为509
nm, 摩尔吸光系数为1.1×104。在溶剂气浮实验中,先调气体流量至所需值,通气体约15
min,使气流量保持恒定。柱中实验溶液均为400mL。亚铁初始浓度为2.3×10-5
mol/L 。将一定量的十二烷基磺酸钠、乙醇加入新配制好橙红色的Fe(II)络合物溶液中,用1
mol/L的盐酸或氢氧化钠溶液来调节溶液的pH值。将调节好的亚铁-邻菲啰啉络合物溶液和10
mL
异辛醇依次倒入气浮柱,并开始计时,按一定时间间隔取水样。将样品置于1cm石英比色皿中,用紫外-可见分光光度计测量样品溶液在509nm
处的吸光度。
热力学实验中,先将配制好的亚铁-邻菲啰啉络合物溶液置于恒温槽中约30 min,再将其倒入气浮柱中。通过控温套管来恒定气浮的温度,实验温度为303、325、348
K。
3. 结果与讨论
3.1 DLS对Fe(II)的摩尔比对溶剂气浮的影响
溶液的pH调为7。气流速率为65 mL/min,不同的DLS对Fe(II)的摩尔比对溶剂气浮的影响如图1所示。结果表明气浮效率随表面活性剂DLS对Fe(II)的摩尔比的增加而增加,在20∶1摩尔比例时,即表面活性剂DLS∶Fe(II),Fe(II)的残余浓度最低,大约有90%的Fe(II)在20分钟内被去除。溶剂气浮动力学研究中发现,在20∶1摩尔比例时,有最快的分离速率。但当摩尔比大于20:1时,分离速率及气浮效率均有降低。
这可能是由于过量的表面活性剂离子与络合物-表面活性剂缔合物竞争气泡表面的吸附点。这种结果同于Cu(II)的溶剂气浮中的规律[5],同于Wilson
、Karger等人对甲基蓝、甲基橙等的研究结果[6-9]他们发现染料的去除率随表面活性剂浓度增加而增加(即使大大超计量比),而不同与在化学计量比的表面活性剂浓度时得到最佳分离效率的结论
[10]。
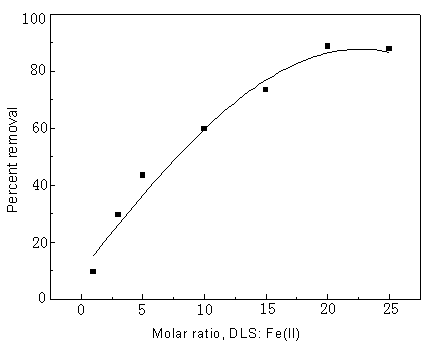
图1 DLS的量对溶剂气浮的影响,Fe(II) 为2.3×10-5
mol/L,气流速率为65ml/min.
Fig.1 Effect of DLS dose
on solvent sublation, Fe(II) (2.3×10-5 mol/L ), rate of air flow = 65mL/min。
3.2 不同空气流速对溶剂气浮的影响
考察了在三种不同空气流速(25、65、130 mL/min)Fe(II)
溶液溶剂气浮过程,实验表明去除速率随空气流速的增加而增加,如图2所示。然而,去除率的增加与空气流速不成比例,这与Valsaraj等人[4]的结果相似,可作以下解释:随着空气流速的增加,平均气泡直径增加,这样单位体积的空气的界面降低(3∕r),同时气泡的停留时间也由于较大气泡较大的上升速率而降低,而且,轴向扩散也随空气流速的增加而增加,这些因素将不利于溶剂气浮过程。
3.3 pH的影响
pH对亚铁-邻菲啰啉络合物溶剂气浮的影响如图3所示。实验表明在pH近中性时的去除速率和效率均最高。
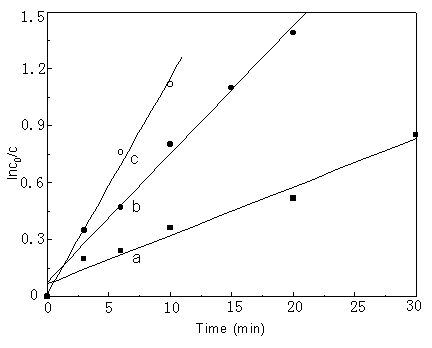
图2 气流速率对溶剂气浮的影响, a: 25 mL/min; b = 65 mL/min; c = 130 mL/ min
Fig.2 Effect of rate of air
flow on solvent sublation,a: 25 mL/min; b = 65 mL/min; c = 130 mL/ min
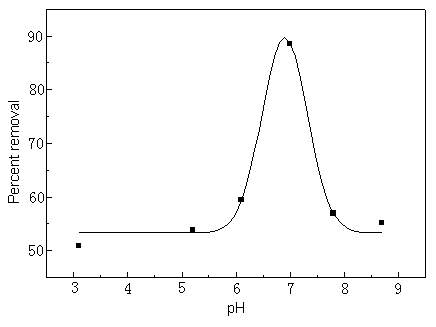
图3 pH对溶剂气浮的影响,DLS:Fe(II) 的摩尔比为20:1,气流速率为65ml/min,气浮时间为10
min
Fig.3 Effect of pH on
solvent sublation, the ratio of DLS to Fe(II) is 20:1, rate of air flow =65mL/min,
duration time of solvent sublation is 10 min.
3.4 电解质NaCl的影响
考察了电解质NaCl这样的共溶质对亚铁-邻菲啰络合物溶剂气浮的影响。不同浓度下溶剂气浮动力学如图4所示,当NaCl浓度的升高时,去除速率显著降低,去除效率也大大降低。这样的结论表明,溶质从溶液中上升至水-有机相界面是一个离子浮选过程[1,11]。
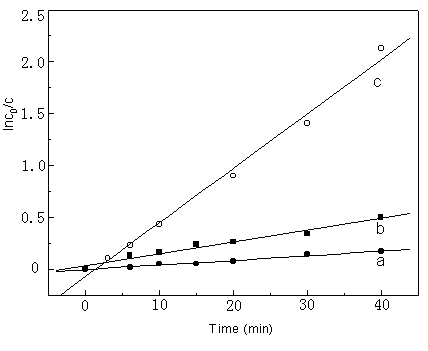
图4 NaCl含量对溶剂气浮的影响,pH 为7.0,DLS对Fe(II)
的摩尔比为20:1,气流速率65mL/min,a:2.5% NaCl, b: 0.5% NaCl, c: 0
Fig.4 Effect of NaCl
concentration on solvent sublation, the value of pH is 7.0, the ratio of DLS to Fe(II) is
20:1, rate of air flow = 65mL/min, a:2.5% NaCl, b: 0.5% NaCl, c: 0
3.5 乙醇的影响
研究了乙醇作为共溶质对溶剂气浮的影响。溶剂过程的动力学如图5所示,乙醇的增加使气浮速率降低,且气浮效率也有降低
(摩尔分率为0.025时,去除率从 94%降到81%)。
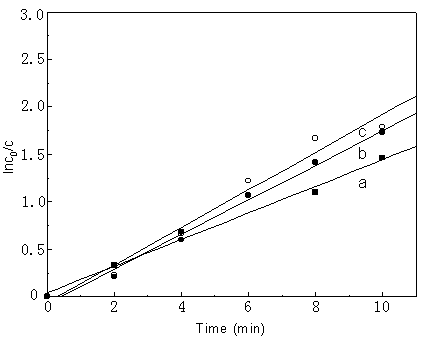
图5 乙醇的摩尔分数对溶剂气浮的影响;pH 为7,DLS对亚铁的摩尔比为20:1,气流速率65mL/min,气流速率为65ml/min,
a: 0.025; b: 0.005; c: 0
Fig.5 Effect of mole
fraction of ethanol on solvent sublation, the value of pH is 7.0, the ratio of DLS to
Fe(II) is 20:1, rate of air flow = 65mL/min, a: 0.025; b: 0.005; c: 0
3.6 不同溶剂的影响
研究了辛醇、异辛醇、异戊醇三种溶剂及无溶剂时对溶剂气浮的影响,如图6所示。实验表明异辛醇的效果最佳,去除率达97%,其去除速率也最快。而在无溶剂时(离子浮选)的去除率达98%,但去除速率低于异辛醇为溶剂时的结果,而且在离子浮选过程中有许多泡沫产生。此实验表明溶剂气浮比离子浮选要方便(因为基本上无泡沫),可直接将溶质收集在上层有机溶剂中。但有机溶剂的选择对其效率有所影响,遵循相似者相溶原理。
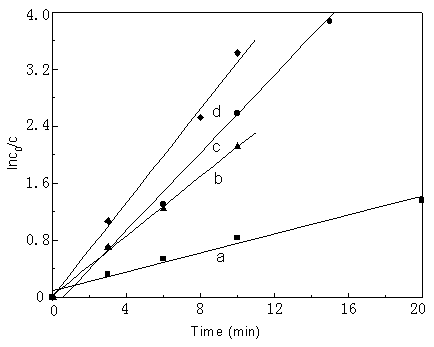
图6 不同溶剂对溶剂气浮的影响;在pH 为7,DLS对亚铁的摩尔比为20:1,气流速率65mL/min,
a: 辛醇; b: 异戊醇; c:无溶剂;d:异辛醇
Fig.6 Effect of solvent
on solvent sublation, the value of pH is 7.0, the ratio of DLS to Fe(II) is 20:1, rate of
air flow = 65mL/min
3.7 溶剂气浮的动力学和热力学机理
在化学反应中,速率遵从以下方程:
-dc/dt = kcn (1)
式中C是反应物浓度,k是表观速率常数,n是化学反应级数.通过实验结果分析,lnc0/c对时间t的关系为线性关系,其斜率为动力学表观速率常数k。因而溶剂气浮过程的动力学服从以下方程:
-dc/dt = kc (2)
这表明此溶剂气浮过程与一级动力学方程一致。
温度对溶剂气浮的动力学影响如图7所示。实验温度为303、325、348K。气浮率随温度的升高而升高。在溶剂气浮过程中,首先是气浮分子与气泡物相互吸引,然后排斥力增加,使气泡液膜层压缩变薄,最后破裂,此过程能量的变化与化学反应过程相似[4],可以用阿仑尼乌斯公式来描述此过程:
Lnk = -Es/RT+ B (3)
式中 k为表现速率常数,R是普适气体常数,B是积分常数,Es为溶剂气浮表观活化能的解。实验结果处理得到lnk与1/T关系呈线性关系,符合阿仑尼乌斯公式。因而由其斜率通过此公式可求得表观活化能为12.18
KJ/mol。
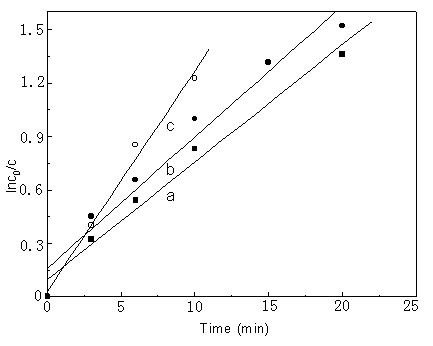
图7 温度对溶剂气浮的影响,在pH 为7,DLS对亚铁的摩尔比为20:1,气流速率为65ml/min,
a: 290K; b: 318K; c: 345K
Fig.7 Effect of
temperature on solvent sublation, the value of pH is 7.0, the ratio of DLS to Fe(II) is
20:1, rate of air flow = 65mL/min, a: 290K; b: 318K; c: 345K
4. 结论
Fe(II)与邻菲啰啉形成的稳定的橙红色络合物, [(C12H8N2)3Fe2+],
它可通过与阴离子表面活性剂的静电作用而有效的从水溶液中去除,
DLS : Fe(II) 摩尔比为20:1时最为有效,20分钟内大约90%的Fe(II)
从溶液中去除。在保持气泡尺寸足够小的情况下,增加气流速率可加快溶剂气浮过程。然而,在更高的气流速率下,产生轴向扩散将抵消这种作用。
pH近中性条件下则最合适。乙醇使溶剂气浮的去除速率和去除效率降低。NaCl浓度的增加将大大降低溶剂气浮去除速率。
不同的有机溶剂对溶剂气浮的影响有区别,异辛醇为溶剂时具有最佳的去除率和最大的气浮速率。有机相在溶剂气浮过程中并非决定性量,气浮体系的表面活性才是决定性量。
溶剂气浮的动力学遵从一级反应动力学。通过研究溶剂气浮过程的热力学机理,表观活化能作为溶剂气浮过程的动力学的特征参数被提出来,它的值为12.18KJ/ml。
REFERENCES
[1] Sebba F. Ion Flotation, New York: Elsevier, 1962, 112.
[2] Lemlich R. Adsorptive Bubble Separation Techniques, New York: Academic, 1972.
[3] Carleson T F. Surfactant Based Separation Process, New York: Dekker, 1989.
[4] Ren X, Chen W G, Zhu X H. Acta Scientiarum Naturalium Universitatis Sunyatseni
(Zhongshan Daxue XueBao), 1996, 35 (6): 23.
[5] Cervera J, Cela R, Perez-Bustamante J A. Analyst, 1982, 107: 1425.
[6] Carger A B, Karger B L. Anal. Chem., 1966, 38 (4): 652.
[7] Karger B L, Carger A B, Lee S B. Sep. Sci., 1967, 2: 39.
[8] Karger B L, Pinfold T A. Sep. Sci., 1970, 5 (5): 603.
[9] Womack J L, Lichter L C, Wilson D J, Sep. Sci. Technol., 1982, 17 (7): 897.
[10] Cheng M H, Huang S D. J. Colloid Interface Sci., 1988, 126 (1): 346.
[11] Rubin A J, Johnson J D, Lamb J C. Ind.Eng.Chem., Process Des.Dev., 1965, 5: 368.