http://www.chemistrymag.org/cji/2003/051001pc.htm |
Jan. 1, 2003 Vol.5 No.1 P.1 Copyright |
Xia Bingle,
Peng Dungeng, Liu Qingliang
(Department of Chemistry, University of Science and Technology of China,
Hefei 230026)
Abstract On the basis of reading a large
number of articles, we reviewed the development of the research in mechanism and
application of several peroxidases. We made a compare the commonness and individuality of
the peroxidases in the mechanism and the application. The insufficiency in the researches
was pointed and a prospect of the researches, which we thought were necessary in these
fields in the following years, was made in this review.
Keywords peroxidase, reaction mechanism, application, development
(中国科学技术大学化学系,合肥,230026)
2002年9月16日收稿;国家烟草专买局科研基金资助课题。
摘要
在本文中我们将各种来源的过氧化物酶的可能的反应机理并尽量结合它们的结构以及应用作了综述。在介绍反应机理和应用的时候展示了它们的个性,并总结了它们的共性;指出了目前研究工作的不足并对今后过氧化物酶在这些领域的研究作了展望。
关键词 过氧化物酶,反应机理,应用,进展
过氧化物酶
(Peroxidase,EC1.11)是广泛存在于生物体中的一类酶,大部分含有血红素,是一种结合蛋白。它可以催化H2O2或相关有机过氧化合物与有机、无机化合物的氧化反应[1-5]。人们对这类酶的分离纯化、反应机理、结构和应用都作过相应的研究。目前,过氧化物酶在酶的构建、免疫测定技术和药物诊断技术上应用较为广泛。另外应用在生物传感器,药物的改进,化学试剂的生产,芳香化合物的降解,环境监测,在材料科学领域也有应用,比如生产无需甲醛做溶剂的树脂涂料;它还用于糖链成分的酶学测定,尤其适用于糖尿病的诊断。大批的植物过氧化物酶的同工酶,它们普遍的性质和在许多灵敏的比色分析方法使得过氧化物酶作为一种便利的酶标记物,在基因学、生理学和病理学研究中发挥了重要作用。过氧化物酶还被常常应用于有伸展蛋白参与的多糖链接、吲哚乙酸的氧化、抗病性及细胞生长发育的调节。
下面结合过氧化物酶的结构,从它们的反应机理和它们在实际生活中的应用两方面,综述国内外在这些工作上的进展。 1. 机理
过氧化物酶的催化机理一直是人们研究的一个热点,倍受关注的原因是基于它们在木质化、细胞分化、细胞壁信号传递、IAA新陈代谢、抗病性及抗虫性中可能扮演极其重要的作用。下面结合过氧化物酶的的结构对其催化反应机理的研究进展作一介绍。
1.1 HRP的催化机理
HRP是人们较早利用和研究的过氧化物酶。相对于其他过氧化物酶,对它的研究更为系统和详细,以下就它在反应和应用中的作用机理作一简单介绍。HRP的X衍射结构已于1997年被解出。结果显示,它和来自同一家族(第三家族)的花生过氧化物酶、大麦过氧化物酶有一个共同点,即在血红素的口袋处(pocket)分为近端和远端的两个部分,蛋白折叠中包埋着两个钙离子。
Anderson等人 [1]用动力磁场效应研究了 HRP的中间化合物 ,认为 HRP循环反应的立体结构可用图1表示 .刘均洪等用辣根过氧化物酶催化木素与酚在反相微乳液系统中进行了共聚反应,实验显示改变内部的氢键结构[2]。
对于反应中间体的存在勿庸置疑,种种实验手段都证明了它的存在,但中间体到底是何种结构,却众说纷纭。Dunford,Haesun等人都认为在中性和酸性溶液中化合物 I 的形成过程如下所示:
H2P→HP→P+H2O2→HRP-I
不同的是,二人在速控步骤上有争议,后者认为在形成HRP-I之前还有一个有七种可能结构的化合物0的存在,并提出了过氧化物酶的转化步骤,详细内容可参阅文献[3]。
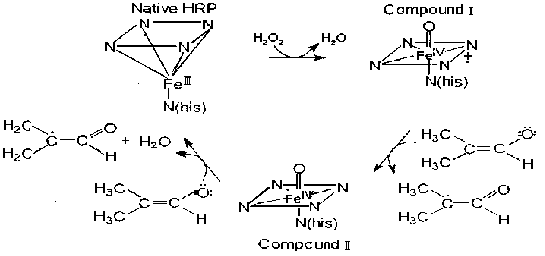
图1 辣根过氧化物酶的催化循环
1.1.2 HRP
生物电极上的生物电催化还原机理过氧化物酶修饰电极在 H2O2芳香胺、酚类、葡萄糖等物质的测定中有着很重要的作用 ,所以近年来得到了较为广泛的研究和发展[4]。
HRP在电极表面上被氧化形成中间化合物 I 和 II, H2O2直接从电极上得到电子而被还原 (直接电子转移 ),或者从氧化还原媒介物上得到电子而被还原 (间接电子转移 ),这两种电子转移方式也可能同时发生 [5],两种方式得到的还原电流都和过氧化物的浓度有关。而且 ,当过氧化物浓度很高时 ,HRP可能形成一种不活泼的形式化合物 (氧化态为 +6).检测最简单的 HRP修饰电极 ,是在基体电极表面吸附上一层 HRP分子构成。HRP电极在催化循环过程中发生的反应如下:
HRP(Fe3+)+H2O2 →Compound-I (1)
Compound-I +AH2 →Compound-II +AH· (2)
Compound-II +AH2 → HRP(Fe3+) +AH· +H2O (3)
当把此电极放入待测样品中 ,并保持电极电位低于600m V(SCE)时 ,HRP氧化反应的中间化合物从电极上得到电子而被还原 ,还原电流与H2O2的浓度成比例 ,同时要保证溶液中必须有H2O2存在。在这种条件下,HRP与电极之间的电子是直接转移的[4]。
HRP反应中间体化合物I和化合物II更常见的还原方式 ,是从底物上得到电子。HRP催化反应形成的氧化产物取决于底物 (电子供体 )的性质。芳香胺类及酚类等电子供体 ,在氧化后形成自由基 AH·;有的底物如六氰合铁酸盐II(hexacyanoferrate II)失去一个电子或碘离子失去两个电子后 ,并不形成自由基。电子供体被氧化后形成的产物 (自由基 AH· ),可再发生如下反应[5]:
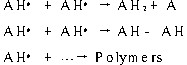
其中Fe3+为 HRP的辅因子 ,AH2为电子供体 ,常为芳香胺或酚类化合物 ,AH·为氧化后产生的自由基。反应 中 HRP被 H2O2或低分子量的有机过氧化物氧化 ,失去两个电子生成中间化合物I (氧化态为 +5价 ),该中间体由含氧铁(Fe4+=O)和一个卟啉阳离子组成 ;在随后的反应中 ,化合物 I 从第一个电子供体AH2上得到一个电子 ,被还原为中间化合物II (氧化态为 +4价 );在最后一步反应中 ,中间化合物II从第二个电子供体 AH2 上又得到一个电子 ,至此 HRP被还原为初始状态。Annika Lindgren等人报道了过氧化氢在HRP或TAP修饰的电极上的直接还原过程,并发现在这个生物电还原过程中HRP的催化性能更佳[4]。
1.2 哺乳动物过氧化物酶(Mammalian peroxidase)
与植物过氧化物酶的起源相似,哺乳动物过氧化物酶也是从一个远祖基因演变而来的。它在甲状腺激素的合成和抵御疾病中发挥着重要作用[6]。
在哺乳动物过氧化物酶中研究较多的有甲状腺过氧化物酶(TPO,thyroid peroxidase),髓过氧化物酶(MPO,myeloperoxidase),嗜曙红细胞过氧化物酶(EPO,eosinophil peroxidase),乳过氧化物酶(LPO,lactoperoxidase)。
大多数哺乳动物过氧化物酶(P)都可以通过以下反应氧化碘离子得到次碘酸和碘:
P compound I +I- →POI- (1)
POI-+H+→P+HOI(2)
POI-+I-→P+I2+OH- (3)
酪氨酸或异质生物质的无酶碘化在HOI或I2的作用下很容易发生。然而通过过氧化物酶-次碘酸盐复合物过程,有酶参与的碘化可以在LPO等哺乳动物过氧化物酶中发生:
POI-+Tyr+H+→ìmonoiodotyrosine(MIT)+LPO+H2O (4)
POI-+MIT+H+→ìdiiodotyrosine(DIT)+LPO+H2O (5)
1.3烟草过氧化物酶催化机理的研究进展
同其它维管植物一样,烟草中有着庞大的过氧化物同工酶,而且对内源底物有迭加反应,有人认为它们使用H2O2或O2 作为电子接受体按照单电子历程参与反应。但烟草过氧化物酶的催化机理尚未形成定论. 有观点认为在HRP的催化反应中,自由基过程对整个机理作了贡献,而在TOP催化过程中却是由化合物I扮演着重要的角色[7、8]。
1996年Irina G.Gazarian通过对吲哚乙酸(IAA)的研究提出该反应中的酶的循环过程:
E3++IAA→ E2++IAA。+ (1)
E2++O2→ compound III (2)
Compound III+IAA→E2++CO2+H2O+indole-aldehyde(吲哚乙醛) (3)
另一种可能的作用机理如图2所示:
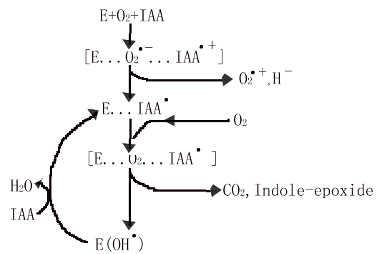
Fig.2 The mechanism of the reaction of O2 with IAA catalyzed by heme peroxidase
1998
年Gazarian通过在中性条件下以HRP、TOP对IAA和O2的催化反应动力学的研究,结果显示:含有血红素的植物过氧化物酶可以在没有外生的过氧化氢物的情况下完成催化反应。在缺少H2O2的情况下由植物过氧化物酶催化O2与IAA的反应是一个极重要的生理反应。IAA在过氧化物自由基催化下的降解反应早从1955年就开始被人们研究。由于有许多错综复杂的残基反应,对其反应机理,意见并不统一。最为普遍的观点是(1)~(6)E,EI,EII 为原酶及相应的复合物。IAAOOH 来源于IAA,IAAOH是其对应的醇
IAA+O2→ IAA.+? (1)
IAA.+ O2→ IAAO2. (2)
IAAO2. +IAA +? → IAAOOH+IAA. (3)
E+ IAAOOH→ EI +IAAOH (4)
EI +IAA→ EII +IAA. (5)
EII+ IAA→ E +IAA. (6)
Irina G.Gazarian已经在文献[7]中阐述了,在稳定状态下,TOP催化IAAOH明显受到过氧化氢酶的影响,已知HRP催化反应与过氧化氢酶无关。另外在对TOP/HRP的GANSIENT动力学研究中化合物I都没有观察到.
第二种针对HRP提出的机理是建立在化合物III的参与基础上的:
E+ IAA→ E2+ +IAA.+ (7)
E2++ O2→ EIII (8)
EIII+ IAA→ E2++ IA +CO2+ H2O (9)
EIII+ 2IAA→ EII +2IAA. (10)
EII+ IAA→ E-IAA.+ H2O (11)
E-IAA. +O2→ EII+In-CH2O +CO2 (12)
文献[7]认为在无氧情况下酶和IAA 反应中等式(7)是不存在的,因为没有足够的证据表明这种残基形成的可能性。因而产生这种主要的残基的过程还是不清楚。
Inna G. Gazaryan等认为主要的残基的生成(当有微量金属离子存在时,IAA降解时同时产生残基)就是由酶本身催化形成的[8]:
E+ O2+ IAA → [IAA-E-O2] (13)
[IAA-E-O2] → E +IAA.+ +O2.- (14)
1.4 LiP(Lignin peroxidase)
LiP
木质素过氧化物酶(LiP)由343个氨基酸残基,370个水分子,血红素,4个糖和两个钙离子组成。木质素过氧化物酶显示了典型的过氧化物酶的空间折叠情况,而且血红素有一个和在其他过氧化物酶中一样的封闭环境(close environment)。已有报道在Trp171处还存在第二个底物结合位点,这和已报道的其他的过氧化物酶的经典血红素边缘不同。Itakura和Henriksen分别对经典的血红素边缘(在其他的过氧化物酶中血红素边缘是和底物相互作用的部位)相似的小的底物通道进行研究并建立了模型 。1998年Blodig和Doyle分别发现在LiP表面上的具有氧化还原活性的色氨酸残基就是第二例新的“无血红素边缘”远程电子转移位点并通过化学修饰和定点突变展示了这个活性位点。目前细胞色素C过氧化物酶是唯一的一种被证实的在色氨酸残基上有阳离子的过氧化物酶。在CCP中靠近血红素携带原子团到酶-底物复合物(complex)的色氨酸的部位上,LiP有一个不能被氧化的苯丙氨酸残基。EPR谱图给出了在LiP-I中存在卟啉环s阳离子(a porphyrin s-cation radial)的谱线[9]。
1993年Piontek以及Edwards等人分别解出了LiP的晶体结构。这两个结构的共同结果时在LiP的中心部位有着和CcP一样的折叠结构,血红素空穴(heme cavity)以及活性基团的排列情况都非常相似。显然作为生物高聚物的木质素是无法接触到血红素的[6]。在Trp171位点上使用自旋捕获的方式形成,并证实了Trp171 是一个有氧化还原活性的氨基酸,参与藜芦醇的氧化。在此模型的基础上,与藜芦醇的氧化和可能的木质化相关的Trp171到血红素的单电子通道已被观察到。 在开放的通往亚铁血红素的边缘的通道旁边(可以结合小的芳香底物分子的部位),有一个小的通道可以到达远端的亚铁血红素口袋(可以让过氧化氢分子进入)。而且发现在LiP中的血红素铁离子和近端的组氨酸残基上的N原子的键长明显比在细胞色素C过氧化物酶的长。在LiP中较弱的Fe-N键呈现更快的电子传递不稳定和的高氧化态,可以较好地解释LiP比CcP有更高的氧化还原能力。LiP有一个接近球形的轮廓,三维尺度大约是50Å×40Å×40Å,并被血红素分割为两部分近区域核远区域。血红素完全被植入到蛋白中,并可以通过两个狭小的通道接近。单个LiP分子有8个主要的a螺旋,8个小螺旋,3条短的反平行a折迭片,每一个都是只由两个残基组成。血红素中有两个有钙离子结合部位,一个在远区域,一个在近区域。从铁原子的方向看,两个都位于活性位点的组氨酸残基之后;同时和7~8个氧原子配位,氧原子之间的距离在2.34到2.72Å[9]。
血红素的空穴(cavity)是由40个残基组成,血红素上的铁原子和最接近的His176的氮原子结合,键长为2.15Å,第六个和铁结合的位点是一个水分子,它通过氢键和远端的His47以及其它的两个水分子结合。在丙酸酯和Arg43、Ala180、Asn182与Asp183之间,血红素通过氢键和蛋白结合。血红素和蛋白之间保留的氢键是在Arg43和Asn182之间形成的,它们相应要弱一点,间距是3.20Å。EPR光谱图和共振拉曼谱图显示血红素的铁原子主要为高自旋的三价铁[9]。
Haemmerli S.D.等人曾提出了如图3的木质素过氧化物酶在氧气存在时催化氧化藜芦醇催化机理示意图。但是Rimko ten Have和他的合作者在研究木质素过氧化物酶在氧气存在时催化氧化藜芦醇的过程中提出异议,他们认为在反应中副产物的形成并不是由于水对VA自由基阳离子的作用所造成的,而认为是先进行的是氧气与VA自由基阳离子的作用,然后才是水的“进攻”。
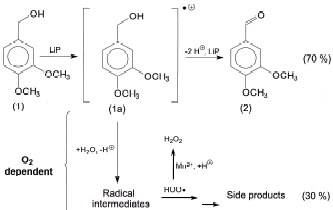 |
图3
在VAD的以及木质素过氧化物酶催化VA氧化过程中副产物形成的反应机理的示意图(VA:藜芦醇;VAD,藜芦醛)[10] Fig.3 A schematic representation of the reaction mechanism involved in the formation of VAD and side products by the LiP catalyzed oxidation of VA |
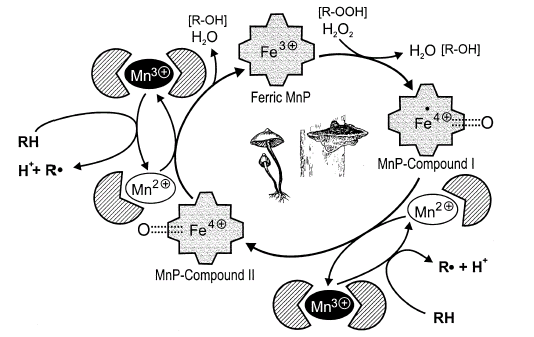
图
4. 锰过氧化物酶的催化循环图Fig. 4 The catalytic cycle of manganese peroxidase (MnP)[11] 1.5 锰过氧化物酶(MnP,Manganese peroxidase)
已有报道,三种不同的MnP锰过氧化物酶已经得以纯化,其中一种已经得到其序列。通过电泳分析,MnP的分子量为43Kda,其等电点是3.75。这种酶是一种含5%的糖基的糖蛋白。按其分子量为43Kda计算,各种氨基酸残基的数目是:50Asp,15Thr,49Ser,37Glu,33Gly,36Ala,17Val,4Met,11Ile,17Leu,7Tyr,21Phe,6His,5Lys,11Arg和19Pro(Cys和Trp数目不确定)。
Mnp的两个同工酶通过SDS-PAGE电泳测得为44KDa,在N端去糖基化过程中,MnP-I的分子量降到了42.7Kda,显示了有3%的N链接的醣类。MnP1的等电点是3.45,MnP2的等电点是3.35(通过IEF测得)。两种LiP的分子量是48Kda,n端去糖基化的则为45.5Kda,表明有5%的N链接的醣类。去糖基化后两个同工酶的等电点分别是3.1和3.0。分析结果显示来源于 B. adusta 的过氧化物酶氨基酸残基的组成是(MnP1, LiP2): Asx (49, 56), Thr (26, 41), Ser(30, 19), Glx (39, 39), Gly (37, 39), Ala (47, 60), Cys(6, 6), Val (24, 22), Met (6, 10), Ile (19, 21), Leu (27,30), Phe (28, 36), His (9, 9), Lys (8, 7), Arg (10, 11),Pro (35, 35) and Tyr (0, 0) (Trp 还没有得到确定),在 LiP 或 MnP的同工酶之间没有发现什么细微的区别[10]。
锰过氧化物酶是所有过氧化物酶中独特的一个,它允许它的还原底物成为Mn2+复合物。MnP的化合物I还可以氧化一系列芳香化合物,例于愈创木酚和2,6-二甲氧基酚(2,6-dimethoxyphenol), (Whitwam et al.,1997)但要比Mn2+的效率低,化合物II的还原需要Mn2+作为底物.它的可能的反应机理是:
Ferric enzyme+H2O2→Compound I+H2O (1)
Compound I+RH→Compound II+R· (2)
CompoundII+RH→Ferric enzyme+R·+H2O (3)
Compound II+RH→Compound II--RH→Ferric enzyme+R·+H2O(4)
Compound II+H2O2→Compound III (5)
RH是还原底物,R*是单电子氧化后的还原底物[12]
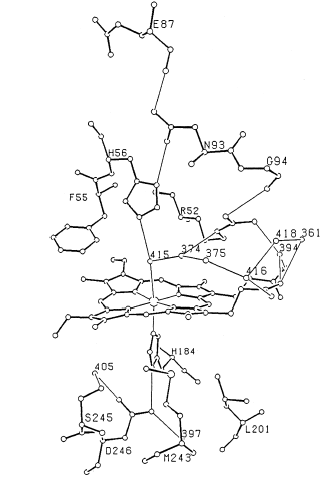 |
图5 ARP中血红素环境 Fig.5 Heme environment of ARP |
1.6 ARP(A.ramosus peroxidase)的催化机理
含有亚铁血红素的过氧化物酶有两个His残基和一个Arg残基,这是在所有的过氧化物酶中都是不变的。还有的研究结果显示在很多的过氧化物酶中一个His残基在近端和血红素中的铁原子配位连接,另一个则是和Arg残基一起在远端和该铁原子配位。晶体学研究表明在ARP(the A. ramosus peoxidase)中His 184和His 56分别对应于近端和远端的His, Arg 52对应于远端的Arg 。最近的研究表明血红素的第六个协同作用位点是氨分子(pH为7.5时)(用‘415’表示)Toru Nakayama解释这是由于在结晶的时候使用氨分子造成的,如图5所示。
有结果显示ARP的催化反应机理是按照如下的步骤进行的:
ARP[Fe(III)]+H2O2→compound I[Fe(IV) ]+H2O (1)
Compound I[Fe(IV) ]+AH2→compound II[Fe(IV)]+AH (2)
compound II[Fe(IV)]+AH2→ARP[Fe(III)]+AH +H2O (3)
2AH →A+AH2(或A2H2) (4)
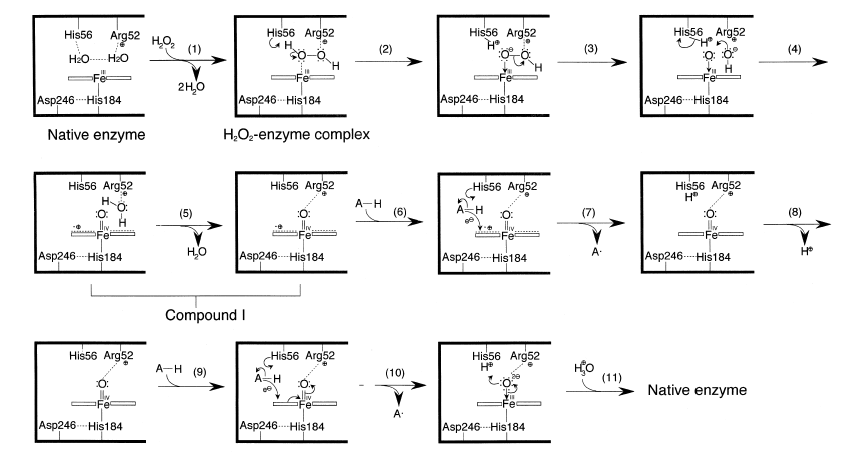
图6 Fukuyama和Abelskov等人推测的ARP的催化机理。(步骤1-4表示化合物I的形成,6-11表示化合物I和II的修饰过程,步骤5是为了连接两部分而引进的。粗线表示ARP蛋白,平面矩形表示血红素平面;虚线表示包括氢键在内的弱相互作用。过氧化物酶的光学数据表明化合物I包含一个带有正电荷的卟啉环的FeⅣ=O。)[14].
Fig.6 Proposed mechanism of ARP catalysis as depicted by Fukuyama 、Abelskov et al.. Steps 1 – 4 and 5 for reductions of compounds I and II , steps 6 – 11 with modifications. To tie both proposed mechanisms, step 5 has been introduced in this scheme. The bold line represents the ARP protein and the horizontal open rectangles indicate the heme plane. The broken lines indicate weak interactions including hydrogen bonding. Spectral studies of peroxidases show that compound I contains an oxygenated Fe IV with the cation radical.
图
6中所示的化合物I、步骤1-4是建立对(ARP-I3-)复合物的结晶学研究的基础上的。在催化机理上,ARP和HRP的极为相似。远端的血红素提供了过氧化物酶的催化活性部位,保守的His和Arg残基在催化的过程中起了很重要的作用。但是,ARP的化合物I和II的稳定性和pH值以及缓冲液的浓度有很大的关系。在ARP中化合物I通过两种途径在氢供体的作用下产生原酶(native peroxidase)。这预示着在ARP中和细胞色素c过氧化物酶和HRP一样,化合物I和化合物II都有相似的结构特征。在ARP中,化合物I和化合物II由氢供体还原可能发生在血红素边缘,Fe=O是和远端的色氨酸是通过氢键结合的。
1.7 其他
Andrew T. Smith在他的文章中将所有的植物超家族中过氧化物酶的催化反应作了一个归纳(表1),指出虽然在所有的反应中酶都是将H2O2转化为H2O,但不能忽略它们广泛地参与其他反应,而且大部分都是有生物学特异性的。他还撇开反应底物的不同造成的产物的差别,将被还原的底物底物用Sred表示,用Sox表示氧化产物,从而得到一个植物超家族过氧化物酶催化有H2O2参加的反应方程通式。表1中E表示过氧化物酶,Fe表示酶中的血红素,(1)表示酶和过氧化氢反应生成化合物I,铁离子的价态有+3价变为+4价;(2)化合物I和底物作用得到氧化产物和化合物II;(3)底物又和化合物II作用生成氧化产物的同时生成水,酶也作为还原产物得到复原。
表
1 植物超家族过氧化物酶的催化反应机理[15]Table.1 The catalytic reaction mechanism of plant superperoxidases
E(FeIII,R)+H2O2
→E(FeIV=O,R·+) [Compound I]+H2O (1)E(FeIV=O,R·+)+Sred→E(FeIV=O,R)[Compound II]+Sox (2)
E(FeIV=O,R)+Sred→E(FeIII,R)+H2O+Sox (3)
L.DE Gioia等人报道了在血红素过氧化物酶,尤其是大多数植物过氧化物酶一般都遵循图7中的催化循环机理[16]。Gilda H.Loew还对过氧化物酶的结构部分作了量子化学计算,得到了一些过氧化物酶的构象、键级、键长等数据,并由这些数据推断了酶的构象。人们从分子生物学和生物化学、生理学、病理学等各个方面对过氧化物酶作了大量的研究工作,也针对一些过氧化物酶提出了一些理论模型。
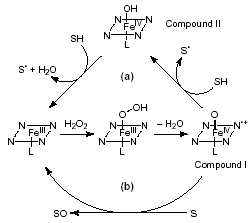 |
图7 血红素过氧化物酶的催化循环图(a)为单电子氧化过程(b)为双电子氧化过程 Fig.7 Catalytic cycles of heme peroxidases:(a) one-electron oxidation classical peroxidase reaction;and (b) twoelectron oxidation (oxygen transfer).Abbreviations: S, SH,substrate; SO, oxidized substrate. |
自从1811年Thenard发现过氧化氢酶,并指出它可以针对活体内特定的底物进行降解后,过氧化物酶的研究拉开序幕。人们对它的催化性能、结构(尤其是它的活性中心)以及催化的机理进行了很多研究,使人们对它的认识有了质的提高。最初,研究手段有限,人们主要做的是热力学的研究,进展也很有限。随着技术手段的提高,在1936年Stern证实了其中原卟啉IX是活性基团。1937年,牛肺过氧化物酶的晶体制备出来,为人们从结构上认识过氧化物酶活性中心提供了研究对象。在这之后人们开始从晶体学、光谱学、分子生物学、遗传学等各种角度对过氧化物酶开展更加深入的研究。
2.1非水体系的研究
在非水体系中仍具有催化活力。非水介质中酶催化反应具有水溶液中所不具备的优点 ,如酶的热稳定性有显着提高等。有机相中酶催化酚类氧化聚合是有工业应用前景的有机相酶催化反应 ,可制得性能优良的树脂材料 ;与甲醛法合成的酚醛树脂相比 ,酶法合成的酚树脂具有结构均一、耐热性强、低电阻等特点 ,有望用作性能优良的涂料、纪录材料等 ,且不造成污染。Akkara、Dordick等研究了非水介质中过氧化物酶催化酚类聚合 ,得到了较高相对分子质量的酚树脂 ;但是 ,聚合时存在着酶失活较快的问题 ,酶的使用周期较短 ,从而严重影响了酶法合成的酚树酯材料的成本和聚合度的提高。国内有上海生化所的蒋太松等人研究了PEG修饰的辣根过氧化物酶及其在非水介质中的性质[5] 。通过氧化过氧化物酶 (HRP)的糖链后引入氨基再连接甲氧基聚乙醇 (PEG5000)和在酶的肽链上连接 PEG5000 ,发现 HRP多肽链上修饰后的酶在水相中的活力几乎没有变化 ,但通过氧化糖链连接 PEG的酶在水相中的活力下降近 2倍。在甲苯及二氧六环含量较高的体系中 ,修饰酶活力均呈上升趋势。特别在甲苯体系中两种修饰酶活力都比未经修饰的酶提高了近 2倍。稳定性研究表明 ,不论在水相中还是在有机相 (二氧六环或甲苯)中 ,直接在 HRP多肽链上连接 PEG5000都使酶的稳定性明显增加。氧化糖链连接 PEG的酶在水相中的稳定性比没有修饰的酶高而在有机相 (甲苯或二氧六环)中的稳定性比没有修饰的酶低[5]。
2.2化学发光技术上的应用
在化学发光技术上过氧化物酶也有它的应用,如HRP就是一种具有生物放大作用的过氧化物酶,它通常与显色底物配合使用,用于酶联免疫吸附测定 (ELISA)及其它医学检验。伍莉萍等人 报道在CPD(化学发光自显影检测法)技术中 ,化学发光使X光胶片感光显影并可以根据胶片上产生的黑斑大小和颜色浓淡进行半定量分析。该技术测定HRP的检测限为 0.08~ 0.4pg(即 2× 10-18~ 2× 10-17 mol) ,比斑点显色法灵敏度高 50~500倍 ,比平板ELISA灵敏度高700~ 1600倍。在HRP或TAP修饰电极的应用上,Annika Lindgren等人还报道了一种在电极上将酶一步固定的方法。伍莉萍报道其实验室所配的底物溶液基本达到应用要求 ,测定辣根过氧化物酶 (HRP)的灵敏度可达到 10-18 mol数量级 ,用于测定DNA,检测限低于 1pg。并发现发现不同的发光增强剂同时使用时对发光有协同增强作用 ,可进一步提高测定的灵敏度。厦门大学的现代化学研究所在1994年报道了由HRP酶联放大镧系螯合物发光的研究工作,使HRP的检测限在酶联后降低了一个数量级,并对具体反应机理作了探讨。
最近,还有报道从非洲油棕榈Elaeis guineensis中提取得到的过氧化物酶在发光技术上的应用。该种过氧化物酶催化过氧化氢和发光氨的反应的最适合条件得到检测。最大的化学发光强度适宜的pH范围是:8.3~8.6(这一点ATPOP和HRP和Arthromyces ramosus 过氧化物酶催化时是相似的,烟草过氧化物酶催化的时候最适宜的pH是9.3);提高缓冲液的浓度会降低化学发光强度。AOPTP 的催化效率并不倚赖反应介质中增强剂(4-靛酚和4-羟基肉桂酸的存在的这一特性以及它的高的稳定性将可能使它在催化领域大有前途[17]。
2.3生物传感器
过氧化物酶也可以被用作生物探针。近年来由于在探针上固定后的酶可重复使用 ,稳定性好 ,对抑制剂和激活剂的敏感性降低 ,比较经济 ;再加上酶本身的特效反应性和灵敏度,辣根过氧化物酶修饰电极得到了较为广泛的研究和发展。它在 H2O2 、芳香胺、酚类、葡萄糖等物质的测定中有着很重要的作用,这为酶电极提供了广阔的应用前景。Wolenberger、Tatsuma等人制备了HRP/聚吡咯膜电极,提出了聚吡咯的作用。王雅琴将介体对甲酰苯基二茂铁 (FPF)与辣根过氧化物酶 (HRP)共价结合 ,然后同单体吡咯一起电聚合到铂电极上 ,再通过戊二醛将葡萄糖氧化酶 (GOD)交联固定在电极上 ,制成共价修饰的HRP/GOD介体酶传感器。结果显示共价修饰的酶传感器响应电流增大 ,底物测试范围 0~ 40mmol/L ,电极稳定性增强。
厦门大学固体表面物理化学实验室在中性溶液中利用邻苯二胺电聚合实现了酶的固定化,解决了聚吡咯可能降解的问题,为HRP找到了新载体。陈滨晖等人还在他们的文章中结合前人的工作介绍了用酶的电化学固定化方法制备辣根过氧化物酶 /聚邻苯二胺膜 (HRP/ PPD)电极的方法,并对其过程的动力学因素进行了探讨。王朝瑾等人研究了以N-甲基吩嗪作为介体 ,通过牛血清白蛋白和戊二醛使其作为结合到玻碳电极上去的辣根过氧化物酶生物传感器。该酶电极对过氧化氢有较好的响应,N-甲基吩嗪还原电流的增值与过氧化氢浓度在 1× 10-6~ 5× 10-4 mol/ L范围内有良好的线性关系,该传感器灵敏度高,检出限为10-7 mol/L,对过氧化氢的响应时间小于10s。
有文献报道用该电极检测芳香胺及酚类化合物的研究方法及进展,阐述了芳香胺能够促进直接和间接的酶电极还原反应 ,酶电极还原电流的增加与芳香胺的浓度相关。酚类化合物在被酶中间体氧化后 ,能够在电极上电化学还原 ,还原电流与其浓度成比例[4,18]。
另外在工业生产、环境保护中,要对水溶液中 H2O2 的含量进行检测;而HRP 有很高的催化效率 ,每个HRP分子在一分钟内可以将 25000个 H2O2分子催化还原为H2O分子[20],因此 HRP修饰电极对H2O2的检测很灵敏。用直接电子转移方式.检测 H2O2时 ,通常选择控制电位为 0 V(SCE),在此电位下 ,噪音和其它物质的干扰都很小 ,但此时高反应性的酶中间体 (化合物 - I /化合物 -II )可能通过酶反应引起干扰 ;用间接电子转移方式时 ,电极电位通常选择接近电子供体的标准电位。直接和间接测量H2O2的检测下限可达到 1.0× 10-8mol/L。对H2O2来说 ,电极上无论是固定单纯的HRP还是加以修饰的 HRP,酶催化反应的表观米氏常数是相近的 ,这说明修饰与否不大影响酶的催化活性。但用不同底物进行酶修饰则可提高反应活性和选择性 [20]。
Ruzgas等以 HRP修饰的碳糊电极和固体石墨电极检测了苯酚及相关的一些芳香族化合物 ;Lindgren等用包括 HRP在内的几种酶分别修饰的石墨电极检测了一系列酚类化合物 ,对甲酚的检测限达到了10-7 mol/l;Dominguez-Sanchez等人用 HRP修饰的碳糊电极检测苯胺 。HRP修饰电极对 H2O2的检测有很高的特效性 ,但对芳香胺及酚类化合物的检测则缺乏选择性 。酶电极目前还很少用于酚和芳香胺类混合物的测定 ,将酶电极与液相色谱相结合使用或许能够解决这个问题[20] 。有人以对苯二酚等有机物为例研究有机物存在对 HRP/ PPD酶膜电极上 H2 O2 还原速度的影响 ,并讨论如何根据动力学实验结果确定有机物检测的合适条件。Kulys等曾经利用辣根过氧化物酶 (HRP)修饰的石墨电极对某些有机物进行测定并初步探讨了其动力学。.实验表明当溶液中存在被称为激活剂 (activator)的芳香物时 ,HRP酶电极上 H2O2 还原电流明显增大。
检测有机过氧化物也是近年来研究的一个热点。关于HRP修饰电极检测有机过氧化物的原理及HRP与 ROOH基团如何发生催化氧化反应,文献中已有多次报道。还有研究表明,HRP修饰电极对 H2O2 响应的降低或升高与溶液中抑制剂或激活剂的量有对应关系[19]。据此可检测 HRP抑制剂和激活剂。国内外在这方面都做了很多工作:Bogdanovskaya等以 HRP修饰的碳黑电极检测 HRP抑制剂氟化物 ,检测限为 2.0× 10 -4 mol· L- 1 [21];Smit等以二茂铁为媒介物 ,检测 HRP抑制剂氰化物 ,检测限可达 ng· m L- 1 级。Smit等还利用锰对HRP的激活作用检测微量锰 ,可检测到 5× 10 -7 mol· L- 1 的锰[22、23]。对于金属离子抑制剂的检测,韩树波等用以亚甲基蓝为介质的 HRP修饰电极检测 Hg2 +,检测限可达到 pg· m L-1级。Wang J等在有机相中 ,以 HRP修饰电极检测了好几种不易溶于水的 HRP抑制剂。此外 ,HRP激活剂的检测也有研究[18、20]。在用于有机溶剂/水混合物中物质的测定以及膜电极,酶电极也显示了很好的稳定性和选择性。
2.4其它
在光度分析中,HRP的氢供体底物主要有三类 :苯酚类衍生物 ,苯胺类衍生物和各种染料的隐色体,它们在HRP催化下被H2O2 氧化为醌式结构而发色。而在荧光分析中,人们不仅利用HRP催化反应测定环境样品中微量H2O2,还可用作酶促偶联反应体系中的指示反应 ,或间接检测多种氧化还原酶、辅酶和一些底物的含量等等。这种快速、专一、较高灵敏度的检测方法在荧光分析中具有重要意义。杜建云、Mohanty JG在前人的工作基础上HRP催化不同底物引起的荧光淬灭或增强入手,对酶催化反应的实质进行探讨并提供了一个新的思考角度。
过氧化物酶在环保方面的应用也是大家所关心的热点之一,尤其是在生物除污方面。以前在除污上研究较多的有吸附和化学氧化等手段,但它们在处理污染物的过程中都缺乏较高的的选择性。后来人们发现来自白腐菌Phanerochaete chrysosporium中的木质素过氧化物酶,它可以降解很多种污染物,比如DDT,PAH,PCB。对于LiP,人们还研究了在生物漂白过程中和工业废水中LiP对各种聚合型染料的降解。其中由于偶氮染料是颜色品种最为丰富的一类,所以对它的研究也是最多的。Paszczynski A等人发现白腐菌Phanerochaete chrysosporium中的酶不但可以脱去偶氮染料中的颜色还可以将它们转化为CO2。Helena Podgornik等人进一步研究,他们还对24种染料作了测定,发现来自白腐菌Phanerochaete chrysosporium中的木质素过氧化物酶可以对来自不同化学结构和种类的染料脱色,并不具备特异性,可适用的底物范围非常广[24]。Sami Sayadi等人在对橄榄加工厂的废水的生物处理时发现,LiP对其中的大部分有害的多酚组分有着较高的脱色和解聚作用。Monika Wagner等人发现在H2O2的作用下HRP不但可以催化降解牛皮纸再生过程中排放的含酚类物质的含量(<1mg/L)还可以降低冷凝物的毒性多达46%。 3. 结论与展望
人们结合结构对多种过氧化物酶的催化过程、催化机理以及应用等方面作了很多研究工作,对辣根过氧化物酶、木质素过氧化物酶等研究的尤为详细。除此之外,其他的过氧化物酶的反应机理尤其是从实际利用的角度出发的研究上还未得到充分和系统的研究。如人们在研究中发现各种离子对酶的活性有不同的影响,以及现在也有报道过氧化物酶只有在铁离子的价态是+3价的时候才具有催化作用等等,都需要从酶的结构出发去研究它们的反应机理,进而更好的利用它们。
过氧化物酶是一种稳定性(无论是pH还是热稳定性等等)很好的酶,本身又是一种生物催化剂。随着科学技术的提高,研究手段的改进,人们可以解析它们的结构和反应机理,更好的应用于工业生产和科学研究。 REFERENCES
[1] Marc B, Marc A. J. Am. Chem. Soc., 1997, 119: 576.
[2] Liu Junhong, Yang Fengke. J. Polymer Materials Science and Engineerin (Gaofenzi cailiao yu gongcheng), 2001, 17: 173-175.
[3] Haesun K, Harold E. Biochem., 1989, 28: 5714.
[4] Gaspara Szilveszter. Sensors and Actuators B, 2001, 72: 63-68.
[5] Jiang Taijiao, Jie Xingsong. Acta Biochemic et Biophysic Sinica (Shengwuhuaxue yu shengwuwuli xuebao), 1998, 30: 132-133.
[6] O'Brien, Peter J. Chemico-Biological Interactions, 2000, 129: 113-139.
[7] Gazarian Irina G. Biophysical Chemistry, 1998, 72: 231-237.
[8] Gazaryan Inna G, Lagrimini L Mark, Ashby Gilian A. J.Biochem., 1996, 313: 841-847.
[9] Choinowski Thomas, Blodig Wolfgang. J.Mol.Biol., 1999, 286: 809-827.
[10] Ten Have Rimko, Maurice C R Franssen. FEBS Letters., 2001, 487: 313-317.
[11] Hofrichter Martin. Enzyme and Microbial Technology., 2002, 30, 454-466.
[12] Heinfling Annaette, JesuE S MarEa. FEMS Microbiology letters., 1998, 165: 43-50.
[13] Mester Tuende, Tie Ming. International Biodeterioration & Biodegradation, 2000, 46: 51-59.
[14] Nakayama Toru, Amachi Teruo. Journal of Molecular Catalysis B: Enzymatic, 1999, 6: 185-198.
[15] Smith Andrew T, Veitcht Nigel C. Curr. Opin.Chem. Biol., 1998, 2 (2): 269-278.
[16] De Velde Fred van, Rantwijk Fred van, Sheldon Roger A. Trends in Biotechnology, 2001, 19 (2): 73-80.
[17] Sakharov I Y. Biochemistry (Moscow), 2001, 66 (5): 515-519.
[18] Ruan C, Yang F, Lei C. J. Anal. Chem., 1998, 70: 1721.
[19] Liu Y, Qian J, Fu X. J. Enzyme Microb.Technol., 1997, 21: 154.
[20] Jiao Kui, Zhang Shukui. Journal of Qingdao Institute of Chemical Technology (Qindao huagongxueyuan xuebao), 1999, 4: 333.
[21] Bogdanovskaya V A, Fridm an V A, Tarasevich M R et al. J. Anal. Lett., 1994, 27: 2823.
[22] Smit M H, Cass A E G. J. Anal. Chem., 1990, 62: 2429.
[23] Smit M H, Rechnitz G A. J. Anal. Chem., 1992, 64: 245.
[24] Podgomik Helena, Grgic Irena, Perdih Anton. Chemisphere, 1999, 38: 1353-1359.