http://www.chemistrymag.org/cji/2003/051007rc.htm |
Jan. 1, 2003 Vol.5 No.1 P.7 Copyright |
Wang Jianji, Li Ruxiong
(Beijing Inst. Petrochem. Technol. Beijing 102617, China)
Abstract Reaction in aqueous media is one
of important methods in organic synthesis,it can substitute some reaction in organic
solvent. In this paper ,its specialty, application and researching progress are
systematically introduced.
Keywords Water, Media, Organic Synthesis, Reaction
王建基
李汝雄(北京石油化工学院 102617)
2002年10月18日收稿。
摘要
以水为介质的有机合成是取代有机溶剂作反应介质的方法之一。本文论述了以水为介质的有机合成的优缺点,综述了化学家研究的以水为介质的有机合成实施方法及应用的具体反应。
关键词 水 介质 有机合成 反应
近年来,为实现可持续发展,实现环境友好的有机合成成为迫切的课题,是绿色化学的重要内容。传统的有机合成往往要以有机溶剂为介质,因而造成有机溶剂对环境的污染。各国的化学家研究了许多取代传统有机溶剂的方法,如无溶剂反应、以水为介质的反应、以超临界流体为溶剂的反应、以氟两相体系为介质的反应、以室温离子液体为溶剂的反应等等[1,2]。这些方法除了可取代传统有机溶剂、减少污染外,还因为它们为反应分子提供了新的分子环境,因而使反应的选择性、转化率得到改变和提高,或使分离提纯等过程较容易进行等。相对来说无溶剂或以水为介质的有机合成反应,因为溶剂的成本最低,在其它条件相近时,应当成为首选。本文综述以水为介质的有机合成反应的研究进展。
1.1有机合成反应以水为介质的优点
☉水是与环境友好的绿色溶剂。
☉与其它溶剂相比水在地球上分布广,来源丰富,价格便宜。
☉水不会着火,安全可靠。
☉反应的处理和分离容易,可循环使用。
☉为反应提供了新的分子环境,有可能造成不同于传统溶剂的新的反应,例如反应物中有的官能团在传统溶剂中需要保护的,以水为介质时可能不用保护也可以,从而缩短合成路线。
1.2有机合成反应以水为介质的问题
☉有机反应物一般不溶于水,通常要用表面活性剂或者共溶剂打破分层反应才可能顺利进行,许多反应根本不能进行。
☉若反应的触媒、中间体或生成物在水中不稳定时,也会造成反应不能进行。
☉在水中进行有机电解合成,则可能分解放出H2和O2。 2 以水为介质的有机合成反应方法及实例[3-12]
2.1 均一系统和非均一系统的反应[3,4]
(1)自由基反应,以Et3B为自由基引发剂
反应1:
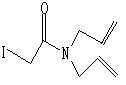 1
1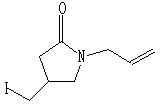 2 过去用苯为溶剂
2 过去用苯为溶剂反应2:
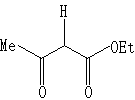
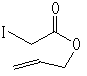 3
3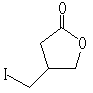 4 转化率78%,用苯为溶剂则为0
4 转化率78%,用苯为溶剂则为0反应3:
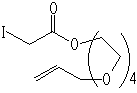 5
5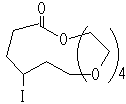 6 转化率98%,用苯为溶剂则为14%
6 转化率98%,用苯为溶剂则为14%(2) 非均一系统的反应
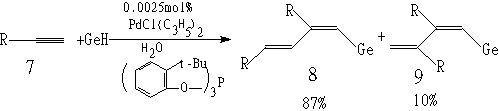
其中  , 此反应为以水为介质的非均一系统反应,所用催化剂量很少,只有0.0025mol%。在无溶剂或在有机溶剂条件下,用如此少的催化剂量,反应基本不能进行;加入界面活性剂使系统乳化,反应速度也很慢。
, 此反应为以水为介质的非均一系统反应,所用催化剂量很少,只有0.0025mol%。在无溶剂或在有机溶剂条件下,用如此少的催化剂量,反应基本不能进行;加入界面活性剂使系统乳化,反应速度也很慢。
2.2 用两亲高分子负载催化剂在水中反应[5,6]
将PEG、PS、PS-PEG(聚苯乙烯-聚乙二醇)的一端引入膦基团,负载Pd催化剂,文献[4]研制了几种有差异的该类催化剂,如PEG担持的Pd催化剂称为触媒2,PS-PEG担持的Pd催化剂记为Pd-PEP的称为触媒4。反应中有机反应物、水、固态触媒三相(有气体时为四相)一起搅拌,反应完成后触媒回收再利用。
(1)烯丙基上的置换反应

其中R、R’可以是Ph、h、Me等,X为Cl、OCOCH3、、OCOC(CH3)2等。NuH可为如下物质之一:
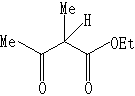
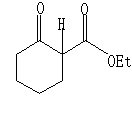
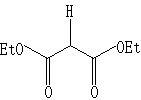
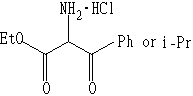
NuNa可为NaN3,NaSO2Ph之一。
例如:
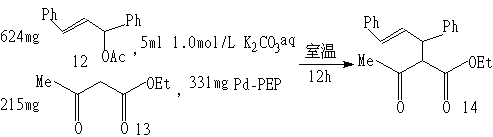 平均产率
平均产率
(2)
水中发生的插入反应一般反应式为:

例如:
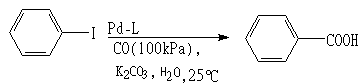
L=PEG-C6H4·PPh2时30次平均转化率为97%, L=PS-C6H4·PPh2时转化率为13%, L=PPh3时转化率为0%。在实验中,有碱的水溶液、有机相、固相触媒、CO气体共四相,反应完成后分离容易,触媒可以回收再用,产品为钾盐,酸化后得到酸。
又如如下两反应:
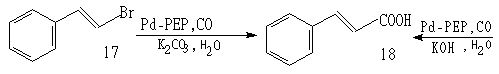
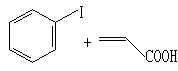
转化率78% 转化率92%
(3)偶合反应
反应1:

R=H、2-CH3、4-CH3等,R’=H、CH3、OCH3等,X=I、Br。
反应2:

R=H、CH3、C2H5、n-C6H13、CH(CH3)2等。
2.3
以水为介质使用界面活性剂的反应[7-10]对多数反应,由于反应物、触媒与介质水的溶解问题,因此反应速度慢,为了使反应系统分散均匀,常使用界面活性剂。如反应:
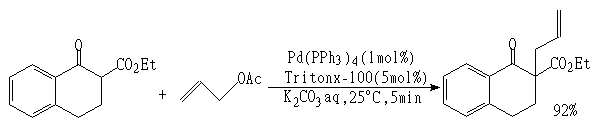
使用非离子表面活性剂Triton X-100(比用其它类型表面活性剂反应速度快)转化率达92%。但一般使用表面活性剂的量必需大,反应操作烦杂,而且产物中混入表面活性剂,产生分离精制问题。
小林修等人[7]研制了表面活性剂-Lewis酸一体化触媒,如十二烷基硫酸钪〔记为Sc(DSa)3〕和十二烷基磺酸钪〔记为Sc(DSo)3〕,其阴离子是表面活性剂,阳离子是Lewis酸作为触媒。当有机反应物、水及一体化触媒形成O/W乳状液时,作为触媒的阳离子Sc3+分布在有机液滴周围;而上例中使用Triton X-100和Pd催化剂时,催化剂是均匀分散于水中。显然使用一体化触媒时,触媒效率高。另外,当反应完成后经离心分离,水、一体化触媒、有机液体可以分为三层,易于分离。使用一体化触媒研究的反应有:
(1)Aldol反应

(2)Michael反应
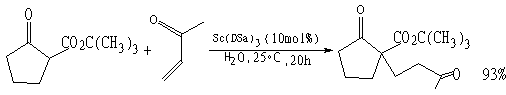
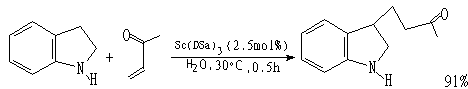
(3)Mannich型反应
Cu(DSa)3催化剂:
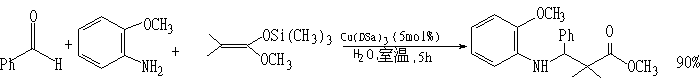
Sc(DSa)3
催化剂: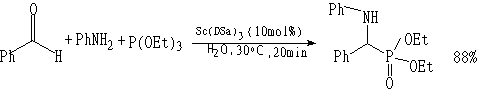
质子酸催化剂:
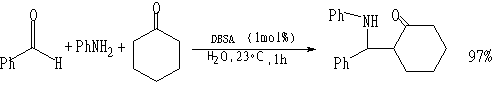
DBSA
为 对-十二烷基苯磺酸,H+为催化剂。2.4 用稀土类催化的水溶液中的反应[11]
研究表明,稀土类金属的三氟甲基磺酸盐作为催化剂,如Sc(OTf)3、Y(OTf)3、Ln(OTf)3等 (OTf=CF3SO2,Ln代表镧系) ,可以使许多有机化学反应在水溶液中进行:
(1)Aldol反应
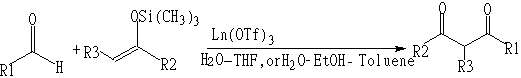
(2)烯丙基化反应
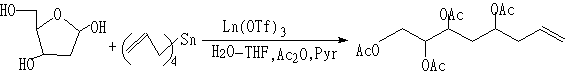
(3)Mannich型反应
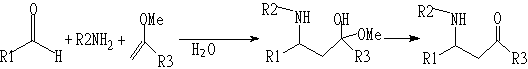
(4)Michael反应
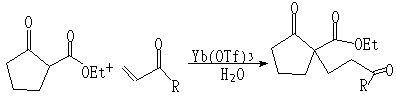
(5)Diels-Alder反应
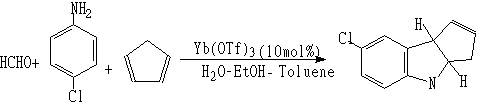
(6)Streker反应(用于合成α氨基酸的中间体)
2.5
以水为介质的有机电解合成[12]有机电解合成早己有之。近年的应用之一是与环境保护有关的含卤素化合物的电解还原,以除去废水中的微量卤代烃等。因为有机反应物大多不易溶于水,因此在二十世纪七十年代又发明了乳液系统的有机电解合成,O/W乳液系统的电导率一般比有机溶液高,因而乳液系统的有机电解合成比用有机溶液时耗电量会下降,有的反应产率高,且选择性好。例如近年研究的电环化合成反应:
![]()
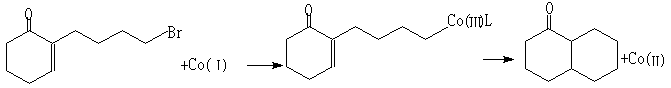
在
CTAB(C16H33NMe3Br)-H2O-十二烷组成的微乳液中(10-100nm)产率为90%,且产物中trans:cis=14:1。而在0.1mol/dm3Bu4NBr的DMF溶液中反应产率低,为74%,产物中trans:cis=2.5:13 结语
有机合成反应在有机溶剂中进行几乎是常识,但进入二十一世纪的今天,对有机溶剂对环境的污染,几乎是不能容忍的。而自然界中的有机物,都是在生命过程中以水为介质合成的,这种合成对生态环境不造成污染。在生态环境保护形势日益严重的今天,研究把在有机溶剂中进行的有机合成反应改为以水为介质进行,应当是很自然的事。
但将有机合成反应改为以水为介质并不是顺利的,由于反应物、触媒等在水中的溶解度问题,中间体或产物在水中不稳定等问题,许多反应不能简单地在水中进行。需要创造一些新的方法,使反应不但能进行,而且比在有机溶剂中进行有更高的产率、更好的选择性,产品的分离提纯不至于太难等。过程太复杂也不好,不利于工业应用。本文提到的就是一些以水为介质的有机合成反应方法,更多的内容请参见文献[13-15]。
总之,以水为介质的有机合成是化学家们努力探索的新的有机合成方法之一。 REFERENCES
[1] Kong F, Tian J, Jin Z. Petrochemical Technology (Shiyou Huagong),2002, 31 (5): 387-392.
[2] Li Ruxiong, Wang Jianji. Chemical Industry and Engineering Progress (Huagong Jinzan), 2002, 21 (1): 43.
[3] Shinokubo H. Chemistry and Chemical Industry (In Japanese), 2002, 55 (2): 133-136.
[4] Yorimitsu H, Nakamura T, Shinokubo H et al. J.Am.Chem.Soc., 2000, 122 (45): 11041-11047.
[5] Uozumi Y. Kagaku To Kogyo (In Japanese), 2001, 75 (11): 540-545.
[6] Uozumi Y, Shibatomi K. J.Am.Chem.Soc., 2001, 123 (12): 2919-2920.
[7] Kobayashi S, Manabe K. PETROTECH (In Japanese), 2001, 24 (8): 641-645.
[8] Manabe K, Mori Y, Wakabayashi T et al. J.Am.Chem.Soc., 2000, 122 (30): 7202-7207.
[9] Mori Y, Kakumoto K, Manabe K et al. Tetrahedron Letters, 2000, 41 (17): 3107-3117.
[10] Kobayashi S, Lam W, Manabe K. Tetrahedron Letters, 2000, 41 (32): 6115-6119.
[11] Kitazume T. Function & Materials (In Japanese), 2000, 20 (1): 54.
[12] Tokuda M. Electrochemistry (In Japanese), 2002, 71 (1): 33-37.
[13] Oshima K. Kikan Kagaku Sosetsu (In Japanese), 2000, (47): 115-125.
[14] Siskin M, Katritzky A. Chem.Rev., 2001, 101 (4): 825-834.
[15] Katritzky A, Nichols D, Siskin M et al. Chem.Rev., 2001, 101 (4): 837-892.