http://www.chemistrymag.org/cji/2003/057053nc.htm |
Jul. 1, 2003 Vol.5 No.7 P.53 Copyright |
Shi Xiaobo, Wang Deixian, Wang Saiying,
Li Chungen
(College of Chemistry,Jiangxi Normal University,Nanchang 330027)
Abstract The polyoxometate particles, K3PMo12O40·8H2O and K3PW12O40
·H2O were synthesized by solid-state reaction at room temperature. Their structure, particle size, thermal properties and surface nature were characterized with elemental analyses, IR, XRD, TEM and TG-DTA techniques. The results show that these two polyoxometate particles have the same Keggin structure and the size is about 42nm and 34 nm. Their stability of the hetoropoly anion decreased when nanoparticles were formed.Keywords nanoparticle, solid-state reaction, polyoxometate, Keggin structure
室温固相反应合成钼磷酸钾、钨磷酸钾纳米微粒
石晓波 汪德先 王赛英 李春根
(江西师范大学化学学院,南昌 330027)
2003年4月10日收稿; 国家自然科学基金资助项目(No.20261003)
摘要
采用室温固相反应法合成了钼磷酸钾、钨磷酸钾两种多金属氧酸盐纳米微粒,用元素分析确定其分子组成,它们的结构、性质、颗粒大小、表面形状分别用红外光谱、X-射线粉末衍射、透射电镜和热分析等手段进行了研究。结果表明:两种多金属氧酸盐都为Keggin结构,晶粒大小分别在42nm和34nm左右,形成纳米微粒后,两种杂多阴离子的热稳定性均明显降低。
关键词 纳米微粒;固相反应;多金属氧酸盐;Keggin结构
多金属氧酸盐是一类早已为人们所熟知的无机化合物,其显著特点[1]是,结构组成多样性,同时具有酸性和氧化性,可作为性能优异的酸型、氧化型或双功能型催化剂,在酯化、烷基化、水合、酯交换以及烯烃环氧化等多种类型的有机反应中,起着重要的催化作用。然而,在众多研究中发现,受其低比表面积的限制,导致其固有的高催化活性和选择性等优异的功能特性在表面反应的应用中难以充分发挥[2]。将纳米合成技术应用于多金属氧酸盐催化剂的合成,对于提高其催化性能具有十分积极的意义。目前对于多金属氧酸盐的合成,主要还是通过液相反应进行[1],由于方法所限,很难得到纳米微粒。研磨固相合成法不使用溶剂,对环境友好,同时还具有独特的节能、高效、工艺过程简单等优点,是制备纳米多金属氧酸盐值得研究的新方法[3]。我们在用研磨固相反应法合成了铁酸盐纳米微粒催化剂之后[4],又对纳米多金属氧酸盐的合成进行了初步探讨,制备出了两种具有Keggin结构的钼磷酸钾、钨磷酸钾纳米微粒,并对它们的结构和性质进行了表征。
1.实验部分
1.1 主要试剂与仪器
钼酸按文献[5]制备,得组成为MoO3·2H2O;活性粉状白钨酸按文献[6]制备,得到组成为WO3·1.2H2O;H3PO4(85%)、K2C2O4·H2O均为分析纯。
Perkin-Elmer公司Aanalst 300型原子吸收光谱仪;Jarrell-Ash
Division Atomscan 2000 ICP原子发射光谱仪;日本岛津DT-30型热分析仪(室温速率10℃/min,参比物为a-Al2O3);美国Nicolet-5DX
Fourier红外光谱仪(KBr压片,扫描范围4000-450cm-1);日本理学D/max-
1.2 钼磷酸钾、钨磷酸钾纳米微粒的合成
分别称取新制备的钼酸54.0g(约0.3mol)、磷酸7.0g(约0.06mol),置于玛瑙研钵中充分研磨,再加入K2C2O4·H2O 6.7g(约0.036mol),继续充分研磨,开始出现粘稠,后逐渐变干爽,研磨40 min后,将所得混合物粉末用无水乙醇洗涤,离心分离,如此反复5~6次,然后在50~60℃真空干燥24 h,得钼磷酸钾粉末49.2g,产率94.5%(以钼酸计)。
分别称取活性白钨酸76.1g(约0.3mol)和磷酸5.8g(约0.05mol)和K2C2O4·H2O 6.7g,按上述相类似的方法制得钨磷酸钾粉末73.5g,产率93.2%(以钨酸计)。
2. 结果与讨论
2.1 纳米微粒的形成
本方法合成过程可能包括以下两步反应:
MO3·nH2O + H3PO4 ―→ H3PM12O40
H3PM12O40·xH2O + K2C2O4·H2O ―→ K3PM12O40·yH2O + H2C2O4·2H2O
由于研磨和水的参与,使得固相反应能够在室温下进行下去。在反应过程中,可认为水在固相界面间形成了无数的微小水池,反应物在水池中溶解并反应,就像在溶液中反应一样。由于Keggin结构的K3PM12O40·yH2O难溶于水,一旦形成会逐渐从微小水池中结晶析出,由于受水池的限制,使生成物的颗粒控制在纳米尺寸范围。随着反应的进行,生成物中的H2C2O4也在微小水池中逐渐饱和,从水相中析出,包裹在K3PM12O40·yH2O纳米粒子的表面,起到保护层的作用,防止K3PM12O40·yH2O纳米粒子进一步生长和团聚。因此,草酸在该反应制备纳米微粒过程中起到重要作用,若采用KCl或K2SO4作钾源,则得不到较理想的结果。
实验还发现,若用水作洗涤剂,产物易团聚,因此,我们选用乙醇作洗涤剂来除去剩余的反应物和反应生成的H2C2O4·2H2O,这样可避免产物颗粒变大。此外,K2C2O4·H2O的用量也不能过量,否则得不到纯净的K3PM12O40·yH2O纳米微粒。
2.2 样品组成的确定
样品用碱分解后,配成0.1g/10ml的溶液,由ICP原子发射光谱仪分别测定Mo、W、P的含量,由原子吸收光谱仪测定K的含量,由热重分析得出结晶水的含量,推算出合成样品的组成。结果见表1。
表1 合成样品的组成分析结果/ %
Table 1 Results of composition analysis for
synthesized samples/%
Compound |
Mo(W) |
P |
K |
H2O |
K3PMo12O40·8H2O |
55.12 (55.26) |
1.54 (1.49) |
5.82 (5.63) |
7.10 (6.91) |
K3PW12O40 ·9H2O |
69.72 (69.90) | 1.02 (0.98) | 3.80 (3.73) | 5.30 (5.13) |
*括号内数据为计算值
2.3 红外光谱表征
钼磷酸钾、钨磷酸钾纳米微粒的红外光谱特征吸收谱带及归属列于表2。从表2中红外光谱数据可见,两种多金属氧酸盐在700cm-1-1100cm-1之间均出现了很强的Keggin结构特征振动峰,表明产物为完好的Keggin结构多金属氧酸盐。我们将本方法制备的K3PM12O40纳米微粒的红外光谱同由液相法制备的K3PM12O40常规晶体的红外光谱进行了比较,发现纳米微粒的红外特征吸收频率均较常规晶体有所降低,并且各红外吸收峰均出现明显宽化。这说明多金属氧酸盐形成纳米微粒后,由于固体产物的表面原子和体相原子之比以及表面缺陷随晶粒粒径的减小而增高,易造成晶格松弛,原子间键结合力下降[7],使键的振动频率存在着较大分布,所以引起红外吸收峰发生红移和宽化。另外在晶粒细化过程中,纳米微粒结构的有序度下降,也有可能发生由高对称向低对称的转变,结果导致晶体场减弱,能级间距减小,红外吸收频率降低。
表2 红外光谱特征吸收峰值(cm-1)
Table 2 IR Spectra data of polyoxometalate
nanoparticles(cm-1)
Compound |
n(O-H) |
n(P-Oa) |
n(M=Od) |
n(M-Ob-M) |
n(M-Oc-M) |
钼磷酸钾纳米 钼磷酸钾晶体 钨磷酸钾纳米 钨磷酸钾晶体 |
3430, 1623.7 3425, 1619.4 3438, 1632.4 3420, 1632.2 |
1046.5 1062.4 1056.4 1068.5 |
953.2 966.4 969.8 976.6 |
869.5 878.6 880.5 889.9 |
787.6 801.3 795.2 813.5 |
2.4 XRD和TEM表征
在5°≤2q≤60°范围内,测定了合成产物的X射线粉末衍射谱图,以确定其结构性质和晶粒大小,结果见图1。
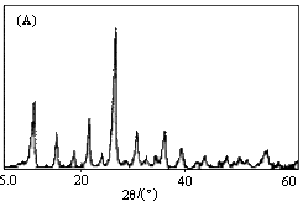

图1 钼磷酸钾(A)和钨磷酸钾(B)纳米微粒XRD谱图
Fig.1 XRD patterns of K3PMo12O40·8H2O
(A)and K3PW12O40·9H2O(B) nanoparticles
由图1可见,两种多金属氧酸盐在8°≤2q≤40°范围内有较强的衍射峰出现,与液相法制得的相同化合物的X射线衍射峰位置相吻合,且两种纳米微粒的衍射峰有明显宽化。测量
XRD谱上衍射峰的半峰宽,并扣除仪器本身引起的宽化度后,根据Scherrer公式估算出所制备的多金属氧酸盐样品的平均晶粒尺寸分别为:K3PMo12O40·8H2O
40nm ,K3PW12O40·9H2O 30nm。
为了进一步证实所制样品确实是纳米微粒,用透射电镜观测了两种多金属氧酸盐颗粒大小和形貌(见图2)。从图2的TEM照片可以看出,产物粒子的形状基本为球形,通过测量,得出K3PMo12O40·8H2O的粒径分布范围为30~55nm,平均粒径为42nm
,K3PW12O40·9H2O的粒径分布范围为18-58nm,平均粒径为34nm。


图2 钼磷酸钾(A)和钨磷酸钾(B)纳米微粒的TEM照片
Fig. 2 TEM images of K3PMo12O40·8H2O
(A)and K3PW12O40·9H2O(B) nanoparticles
2.5 纳米微粒的热稳定性
利用差热热重分析以及不同温度下的IR分析,研究了钼磷酸钾、钨磷酸钾纳米微粒的热分解情况,并与液相制备的相应常规晶体进行了比较。由实验可知,该系列多金属氧酸盐有相似的TG-DTA曲线,说明它们有相似的热解性质。DTA数据见表3。
表3 多金属氧酸盐的热分析数据/K
Table 3 DTA data of
polyoxometalates/K
Compound |
第一吸热峰温度 |
第二吸热峰温度 |
放热峰温度 |
第三吸热峰温度 |
钼磷酸钾纳米 钼磷酸钾晶体 钨磷酸钾纳米 钨磷酸钾晶体 |
349.4 353.8 359.2 362.5 |
386.3 393.4 397.9 405.3 |
643.6 668.8 654.2 675.7 |
760.8 783.2 774.4 798.5 |


图3 K3PMo12O40·8H2O的TG-DTA谱图 图4 K3PMo12O40·8H2O的不同温度下的IR图
现以K3PMo12O40
·8H2O为例(见图3),讨论其热分解性质,从TG曲线上可看出,失重从320K左右开始,到540K左右达到恒重,失水大体分为两步,第一步失重温度范围为320~380K;第二步失重温度范围为380~540K;在DTA曲线上分别出现两个较强的吸热峰,说明在化合物中存在两种不同的结晶水,但在TG曲线上,当第一步失重后没有出现明显的平台,紧接着就是第二步失重,说明两种结晶水与化合物分子结合的强度相差不大。当温度升至620K以上,DTA曲线上出现一个放热峰,测定放热峰前后温度下样品的IR光谱(见图4),发现在放热峰出现之前的样品仍保持Keggin结构的IR特征吸收峰,而放热峰出现之后的样品的IR谱图发生了较大变化,这说明放热峰对应的是杂多阴离子结构的分解。由表3中放热峰温度可看出,钼磷酸钾、钨磷酸钾放热峰温度均明显低于常规晶体,表明多金属氧酸盐形成纳米微粒后,热分解提前,热稳定性降低,这可认为是由于纳米微粒具有较高的表面原子与体相原子比和众多的表面缺陷,易造成晶格松驰,因而致使其热稳定性下降。REFERENCES
[1] Wang E B
[2] Peng G, Zhang D W, Hu C W. Industrial Catalysis (Gongye Cuihua), 2000, 8 (1): 12-15.
[3] Zhou Y M, Xin X Q. Chin J Inorg Chem (Wuji Huaxue Xuebao),1999, 15 (3): 273-292.
[4] Shi X B, Fu H P, Li Ch G et al. Chin J Appl Chem (Yingyong Huaxue), 2003, 20 (1): 55-58.
[5] Shitu J S. Inorganic Chemical Products, Beijing: Chemical Industry Press, 1993.
[6] Gu Y D, Zhu S S. Chem J Chin Univ (Gaodeng Xuexiao Huaxue Xuebao), 1982, 3 (2): 138-140.
[7] Shi X B, Li Ch G, Wang D X. Chin J Synth Chem (Hecheng Huaxue), 2002, 10 (2): 183-185.