http://www.chemistrymag.org/cji/2003/05b087pc.htm |
Nov. 1, 2003 Vol.5 No.11 P.87 Copyright |
Yang Xuwu, He Shuiyang*, Chen
Junli, Peng Ke, Zhao Jianshe, Shi Qizhen
(Department of Chemistry Northwest University, Shaanxi, Key Laboratory of
Physico-inorganic Chemistry, Xian 710069)
Received Sep.3, 2003; Supported by the Natural Science Foundation of Shaanxi Province (No.2002B05).
Abstract Salicylaldehyde Salicylhydrazone (C14H12N2O3, H3L) and its two new complexes of rare earth (III) K[RE(HL)2]·nH2O(RE=Eu,Gd, HL= [C14H10N2O3]2-) were synthesized. The constituent, coordination mode and thermal stability were confirmed by chemical analysis, elemental anaylysis and ICP analysis, IR,1H NMR,XRD,UV,TG-DTG and molar conductance. The standard formation enthalpy for the complexes were calculated by the determination of the constant-volume combustion energies.Keywords Salicylaldehyde Salicylhydrazone; Rare earth complexes; Thermal stability; Combustion energies; Standard formation enthalpy 稀土与水杨醛水杨酰腙配合物的合成、表征及恒容燃烧能的测定 杨旭武,何水样*, 陈军利,彭科,赵建社,史启祯
(西北大学化学系,陕西省物理无机化学重点实验室,西安710069) 摘要 合成了水杨醛水杨酰腙配体(C14H12N2O3,文中简称H3L)及相应的新稀土配合物。通过容量分析、元素分析及ICP分析确定了其组成为K[RE(HL)2]·nH2O(RE= Eu、Gd, HL=[C14H10N2O3]2 -为配体水杨醛水杨酰腙的二价阴离子)。通过IR、1H NMR、XRD、UV、 TG-DTG和摩尔电导率的测定,讨论了其成键情况和热稳定性. 通过恒容燃烧能的测定计算了配合物的标准生成焓。
关键词 水杨醛水杨酰腙 稀土配合物 热稳定性 燃烧能 标准生成焓 由于腙类化合物具有生物活性、强的配位能力及多样的配位形式,使其在农药、医药和分析试剂等方面的应用受到了广泛关注 [1]。水杨醛芳酰腙对人和老鼠 DNA的复制和细胞生长有抑制作用,它可有选择地抑制特定的细胞,特别是在抗癌变细胞筛选中,引起了人们的极大兴趣。有关过渡金属腙类配合物的报道较稀土配合物为多[2-4],我们曾合成了稀土与水杨醛-1H-苯并三唑-1-乙酰腙的配合物并研究了其热化学性质[5]。水杨醛水杨酰腙稀土配合物很少见文献报道 [6,7],更未见关于该类配合物热化学性质的研究。本文合成了两种新的组成为K[RE(HL)2]•nH2O的配合物, 对其进行了表征,研究了配合物的热稳定性,并通过恒容燃烧能的测定,计算了它们的标准燃烧焓和标准生成焓。
1 实验部分
1.1 主要试剂与分析仪器
水杨醛,水杨酸甲酯,水合肼, DMF,无水乙醇,KOH, 浓盐酸,丙酮等试剂均为分析纯, RE(NO3)3 nH2O是用99.95%的RE2O3自制。
P.E.2400型元素分析仪,RE3+含量用EDTA容量法测定, IR、UV、1H NMR、TG-DTG和XRD数据分别采用EQUINO×55型红外光谱仪(KBr压片), UV-1100 型紫外可见分光光度计, FT-AC400核磁共振仪,TG-DTG用NETZSCH STA 449C热分析仪(N2气氛,升温速率为10K/min)和日本理学D/max自动X射线衍射仪。K含量用 TJA公司的IRIS Advantage全谱直读等离子体发射光谱仪测定; 采用DDS-307型电导率仪测定电导。
1.2 量热仪器及实验条件
配体及配合物的恒容燃烧能使用RBC-II型精密转动弹热量计测定, 主要实验方法和步骤与文献[8]相同。 实验的起始温度为(25.0000±0.0005)℃,初始氧压为2.5Mpa,热交换校正值依Linio-Pyfengdelel-Wsava公式计算[9]。终态产物(气体、液体和固体)的分析方法与文献[8]相同,分析结果显示燃烧反应是完全的。
热量计使用纯度为99.999%的热值基准物苯甲酸 [25℃ 热值为(-26434±5.8)J/g] 进行标定。 热量计的能当量经标定为(18000.71±8.42) J·K-1,精度4.68×10-4。
1.3 配体及配合物的合成
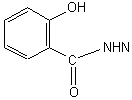
配体水杨醛水杨酰腙的合成参考文献[6],但在合成方法上细化并有所改进,如将反应物的下料比(摩尔比)由1:1改为1:1.1,将配体(b)的粗品改用无水乙醇和DMF的混合溶剂重结晶,得淡黄色晶体,洗涤、恒重后得配体(b)的纯品,其熔点为275℃,与文献[6]值一致,产率为91%。其合成路线为:
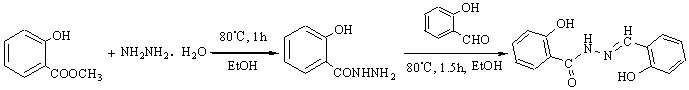
将5mmol配体(b)和100ml乙醇/水(1:1体积比)混合溶剂加入烧瓶中,在搅拌下滴加10mL 1mol/L 的KOH,溶液逐渐变清,呈黄色,然后滴加含10mmol稀土硝酸盐的醇/水溶液,逐渐出现黄色沉淀,搅拌2h,抽滤,烘干。用玛瑙研钵研细,分别用乙醇和丙酮充分洗涤, 放入真空干燥器中至恒重,得配合物产率约为90%。
2 结果与讨论
2.1 配合物的表征
2.1.1 配体和配合物的组成与摩尔电导率
配体和配合物的元素分析结果见表1。由表1可见,实验值与理论值相符。室温下以DMF为溶剂,测定了配体的摩尔电导率为32.1 S.cm2.mol-1,配合物的摩尔电导率分别为93.5和97.5 S.cm2.mol-1。依据文献[10],配体为非电解质,各配合物为1:1型的电解质,结合组成分析,并通过ICP分析证明在配合物外界有与稀土等摩尔的K+存在。说明我们确定的配合物的组成是正确的。
| 样品 | ∧m/S.cm2.mol-1 | C% |
H% |
N% |
K% |
RE% |
H3L |
32.1 |
65.43 |
4.78 |
10.92 |
||
K[Eu (HL)2] |
93.5 |
48.29 |
3.24 |
8.32 |
5.15 |
21.62 |
K[Gd(HL)2] |
97.5 |
47.92 |
3.35 |
7.70 |
5.05 |
22.42 |
以配体、稀土盐及K[Eu(HL)2] 配合物为代表,进行了Xray粉末衍射测定,其结果列于表2,配合物与稀土盐和配体三者相比,其晶面间距与衍射峰的相对强度均有明显不同,而且也不是相互叠加,证明生成了新物相。 表2 配体及配合物的XRD数值
| K[Eu(HL)2] | Eu(NO3)3·H2O | H3L |
d/nm I/I0/% |
d/nm I/I0/% |
d/nm I/I0/% |
| 1.4062 100 | 8.18 100 | 0.9302 100 |
| 0.7880 46 | 5.30 89 | 0.3456 93 |
| 0.3779 55 | 5.64 82 | 0.4586 43 |
| 0.3153 37 | 5.15 63 | 1.8706 25 |
| 0.3033 41 | 4.287 57 | 0.3534 23 |
| 0.2192 28 | 3.831 55 | 0.3227 19 |
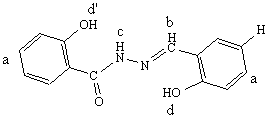
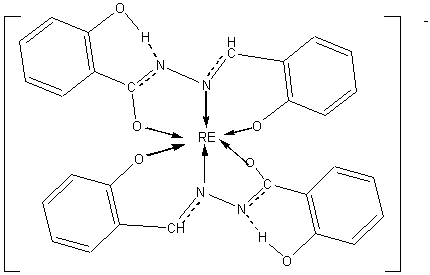 图1 配体H2L的标识
图2配合物中配体的配位形式
2.1.3 配合物的IR光谱分析
图1 配体H2L的标识
图2配合物中配体的配位形式
2.1.3 配合物的IR光谱分析水杨醛水杨酰腙(H3L)及其配合物红外光谱的指认,是根据文献[6,11,12,]进行的。配体(H3L)的IR图谱中3250cm-1、2661和2570cm-1、1655cm-1(弱)、1618cm-1、1558cm-1、1231cm-1、1156cm-1被分别指认为υ(NH)峰,υ(OH)(酚),Amide Iυ(C=O), υ(C=N)和υ( +HN=C(R)=O )的叠加峰,AmideⅡυ(C-N+),酰胺的烯醇结构υ(CO)和酚羟基υ(CO)。在配合物中,酰胺Ⅱ的υ(C-N+)紫移10~20 cm-1, 说明C-N+键的加强,推测变为C=N;酰胺的烯醇式υ(CO)紫移了20 cm-1,说明C-O键(烯醇式)明显增强;而在1610 cm-1附近出现一个新的强吸收峰,可认为是υ(C=NN=C);而υ(CO)(酚羟基)红移6 cm-1,说明C-O键(烯醇式)相对减弱;配合物在3400 cm-1处出现水的吸收峰,说明配合物含有水分子,但在520cm-1和820cm-1附近未见伸缩振动峰,说明配合物中水可能未配位。根据以上分析,我们推测配合物中配体以如图2所示的三齿形式配位,与稀土离子形成一个五元环和一个六元环的稳定结构。
2.1.4 配合物的 1H NMR
配合物的1H NMR在DMSO-d6氘代溶剂中测定。配体H3L 的1H NMR数据摘自文献[6],其质子标识如图1。文献[6]中,配体H3L的1H-NMR化学位移δ11.27, δ12.00分别以尖峰和宽峰出现,指认为水杨醛和水杨酰肼的酚羟基质子的化学位移(d,d')。在配合物的图谱中,水杨醛羟基H(d)的化学位移消失,归因于羟基脱质子后氧和金属离子的配位;δ10.20处出现一个扁平的峰,可解释为水杨酰肼的羰基以烯醇式配位,羟基氧与酰胺的N形成了氢键,其羟基氢(d’)向高场移动的结果。苯环上的a位多个质子的化学位移相对于配体 (H3L)由δ6.20~7.90变为δ7.00-7.40,间接地说明了配体的配位对它们的影响。另外,腙基上的质子(b)化学位移为8.70,配合物中水的化学位移为2.00。
以上分析进一步证明了配体如图2所示的配位方式。
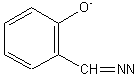
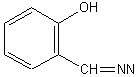
2.1.5 配合物的 UV光谱
以DMF为溶剂,测定了配体(10.9×10-5molL-1)和配合物(5.04×10-5 molL-1)的UV,二者差别较大,而各配合物之间则相似。对于配体H3L,300.8nm为水杨酰腙( )的π-π*跃迁的吸收峰波长;配位后,水杨酰腙脱质子以烯醇式出现,水杨甲酰胺的共轭性增大,其吸收峰发生红移(300.8→314.0nm)。333.0nm为水杨醛席夫碱基团( )的π-π*跃迁的吸收峰波长;O、N参与配位后,减弱了这一基团的共轭性,其吸收发生紫移至327.9nm。此外在390.8~407.8nm处出现了新的L→RE3+的荷移跃迁吸收峰,在302.5 nm处出现了新的 基团的吸收峰。
2.1.6 配合物的热稳定性
配合物K[Eu(HL)2]·2H2O的TG-DTG曲线(10K/min)如图3所示,第一阶段(25-110-217℃,中间为峰温)为脱去两个水分子,失重率为4.59%(理论值4.89%);第二阶段(218-281.9-335℃)为脱去配体中的2N2,失重率为7.85%(理论值7.61%);第三阶段为其它碎片的失去,加热至1100℃的残余物经分析为0.5K2O+0.5RE2O3+10C,残留率为47.64%(理论值48.24%)。这个过程也进一步佐证了配合物的组成。
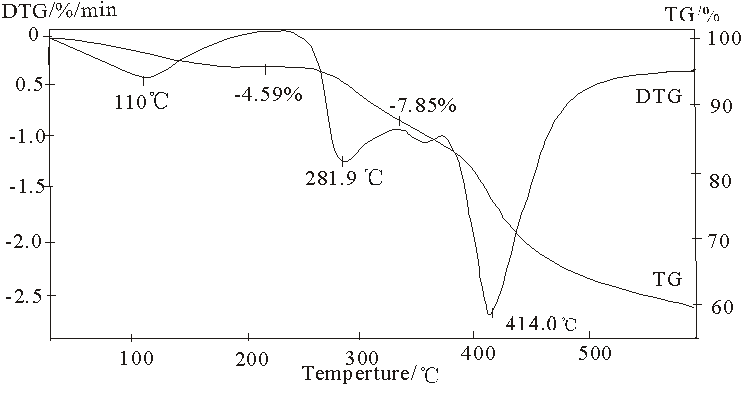
图3 K[Eu(HL)2]·2H2O的TG-DTG曲线
2.2 配合物的标准生成焓2.2.1 配合物的恒容燃烧能
配合物的恒容燃烧能的测定方法与用苯甲酸标定热量计的方法相同. 试样的燃烧能使用公式(1)进行计算:
式中,
| 样品 | No. |
m / g |
qc / J |
qN / J |
- DcU/g |
|
K[Eu (H L)2] |
1 |
1.00562 |
12.60 |
35.20 |
1.0105 |
18040.51 |
2 |
1.00347 |
12.60 |
35.12 |
1.0073 |
18021.86 |
|
3 |
1.01020 |
12.58 |
35.36 |
1.0165 |
18065.51 |
|
4 |
1.00515 |
12.60 |
35.18 |
1.0111 |
18059.73 |
|
5 |
1.00726 |
10.81 |
35.26 |
1.0132 |
18061.54 |
|
6 |
1.00473 |
11.76 |
35.17 |
1.0085 |
18021.54 |
|
K[Gd(HL)2] |
平均值 | 18045.05 ± 8.17 |
||||
1 |
1.01250 |
12.60 |
36.50 |
1.0013 |
17753.10 |
|
2 |
1.01676 |
12.60 |
36.65 |
1.0070 |
17779.46 |
|
3 |
1.00983 |
11.76 |
36.40 |
1.0013 |
17800.97 |
|
4 |
1.00758 |
12.70 |
36.32 |
0.9986 |
17792.62 |
|
5 |
1.01025 |
10.84 |
36.42 |
1.0019 |
17805.15 |
|
6 |
1.01321 |
12.60 |
36.53 |
1.0027 |
17765.50 |
|
| 平均值 | 17782.80 ± 8.40 |
配合物的标准燃烧焓
RE=(Eu,Gd),下同。
配合物的标准燃烧焓依下式求得:
式中,Dn为产物与反应物气态物质的量之差,R = 8.314 J·K-1·mol-1, T = 298.15 K. 配合物的燃烧焓计算结果见表3.
2.2.3 配合物的标准生成焓
依据方程式(5)用Hess定律可计算出配合物的标准生成焓:
配合物的标准摩尔生成焓亦列于表4。 表 4 配合物的恒容燃烧能,标准燃烧焓和标准生成焓(kJ·mol-1)
| 配合物 | |||
K[Eu (HL)2] |
12623.42± 5.72 |
12620.94± 5.72 |
2267.89 ± 6.84 |
K[Gd(HL)2] |
12534.03 ±5.92 |
12531.55± 5.92 |
2433.58 ± 7.19 |
[1] Katyal M, Dutt Y. Talanta, 1975, (22): 151.
[2] Duggal H K, Agarwala B V. Synth. React. Inorg. Met.-org. Chem. , 1988, 18 (9): 871.
[3] Mandal S K, Thompson L K, Newlands M J et al.. Inorganica Chimica Acta, 1990, 178: 169.
[4] Hu Y H, Zhang Y L, Wu S Z. Synth. React. Inorg. Met.-Org. Chem., 1995, 25 (3): 451.
[5] He S Y, Cao W K, Hu T et al. Acta Phys.Chim. Sin.(WuLi HuaXue XueBao), 2002, 18 (10): 865.
[6] Navaneetham N S, Kalyanasundaram R, Soundararajan S. Inorganic Chimica Acta, 1985, (110): 169.
[7] Sallomi I J, Al-Fadhel M S. Dirasat: Natural and Engineering Sciences, 1997, 24 (2) : 419.
[8] Yang X W, Chen S P, Gao S L et al.. Instrumentation Sci. & techn., 2002, (30): 311.
[9] Popov, M.M. Thermometry and Calorimetry[M]. Moscow Univ: Publishing House, Moscow, 1954, 382.
[10] Geary W J. Coord. Chem. Rev., 1971, (7): 81.
[11] Kazuo N (Translated by Huang D R, Wang R Q). Infrared and Raman Spectra of Inorgnic and Coordination Compounds(Wuji He Peiwei Huahewu De Hongwai He Laman Guangpu). Beijing : Chemical Industry Press (Huaxue Gongye Chubanshe),1986,199.
[12] Zhang L, Fang X Q, Zhang G M. React. Inorg. met.-org. Chem., 1988, 18 (2):127.
[13]Huber E J, Hollcy C E. Experimental Thermochemistry [M]. New York: Insterscience Publishers, 1961, 77.
[14]Cox J D ,Drowart J, Hepler L G et al. J Chem.Thermodynamics, 1978, (10): 903.