http://www.chemistrymag.org/cji/2003/05b088nc.htm |
Nov. 1, 2003 Vol.5 No.11 P.88 Copyright |
Studies on the adsorption of Zn2+ for chitosan with high degree of deacetylation
Ma
Zhiguang, Gao Jungang, Liu Xiuying, Du Baoan, Shan Jinhuan, Shen Shigang
(College of Chemistry & Environmental Science, Hebei University, Baoding 071002,
China)
Abstract The effects of various
factors, such as adsorption time, temperature, the pH value of the solution, initial Zn2+
concentration, and different kinds of anion, on the adsorption behavior of zinc ions
for chitosan with high degree of deacetylation were investigated. The results showed that
the adsorption isotherms behavior of chitosan to zinc ions obeyed the Langmuir equation,
the optimal conditions of adsorbed Zn2+ by chitosan were determined, the
counter anion species in Zn2+ solution was sulfate, the pH value of the Zn2+
solution was 5-6, the initial concentration of Zn2+ was 0.05-0.06 mol/L.
Keywords Chitosan, Zn2+, Adsorption
高脱乙酰度壳聚糖与锌离子吸附作用的研究
马志广
高俊刚 刘秀英 杜保安 单金缓 申世刚
(河北大学化学与环境科学学院 保定 071002)
2003年9月19日收稿
摘要
本文研究了高脱乙酰度壳聚糖对Zn2+的吸附作用,探讨了吸附时间、温度、溶液的pH值、Zn2+起始浓度和不同锌盐等方面对壳聚糖吸附性能的影响。结果表明:壳聚糖对Zn2+的吸附具有Langmuir吸附特征,其吸附最佳条件是锌盐为硫酸锌,Zn2+溶液的pH值为5-6,Zn2+起始浓度为0.05-0.06
mol/L.
关键词 壳聚糖 Zn2+ 吸附
壳聚糖[CTS,(1,4)-2-氨基-2-脱氧-β-D-葡萄糖]是自然界中资源极其丰富的甲壳素脱乙酰基后得到的一种天然高分子化合物,是迄今为止发现的唯一天然碱性多糖。由于其分子中含有自由胺基,可吸附很多金属离子,在医药、水处理及环保等方面的应用受到重视。壳聚糖在溶液中对重金属离子的吸附作用有很多报道[1-3]。对壳聚糖吸附Zn2+的系统研究较少,且局限于水溶性壳聚糖[4]或高分子量(分子量>9×105)壳聚糖对Zn2+的吸附研究[5]等。本文从几个方面研究高脱乙酰度(脱乙酰度大于99%)、相对低分子量(分子量约为4.65×105)的壳聚糖对Zn2+离子的吸附性能,为其在医药及环保方面的应用创造条件。
1.实验部分
1.1仪器与试剂
TG-328B型光电读数分析天平(湘仪天平仪器厂),pHS-3C数字酸度计(国营杭州万达仪器仪表厂)。
EDTA、硫酸锌、乙酸锌、氯化锌、氨水等试剂均为分析纯;壳聚糖(生化试剂,脱乙酰度≥99%,上海伯奥生物科技有限公司,粘度法测定其粘均分子量为4.65×105)。
1.2实验方法:
准确称取一定量壳聚糖,加入到一定浓度的Zn2+(除研究不同阴离子的影响外,都使用硫酸锌)溶液中,置于水浴震荡器中振荡。控制摇速120r/min,过滤吸附液,用EDTA络合滴定法测定Zn2+含量。实验中溶液的pH值用稀硫酸或稀氨水调节;溶液总体积100mL。用下式计算吸附量q:
![]()
式中V为Zn2+溶液的体积(ml);m为壳聚糖质量(g);C0
、C分别为吸附前后溶液中Zn2+浓度(mol/L);q为吸附量(mmol/g)。
2.结果与讨论
2.1 Zn2+起始浓度对吸附量的影响
100mL吸附液中含壳聚糖0.8g,恒定温度为25℃,当吸附时间为10h时,测得壳聚糖对不同起始浓度的Zn2+吸附量见表1。
表1 不同Zn2+起始浓度下的吸附量
Table 1. The absorption capacity of
CTS to Zn2+ in different initial Zn2+ concentration
初始浓度(mmol/L) |
23.16 |
30.45 |
38.79 |
42.89 |
53.61 |
61.33 |
76.34 |
吸附量(mmol/g) |
2.13 |
2.14 |
2.24 |
2.32 |
2.41 |
2.44 |
2.52 |
从表1可以看出,随着Zn2+起始浓度浓度的增加,平衡吸附量逐渐增加;随浓度继续增大则平衡吸附量趋于平缓,并接近饱和吸附量。
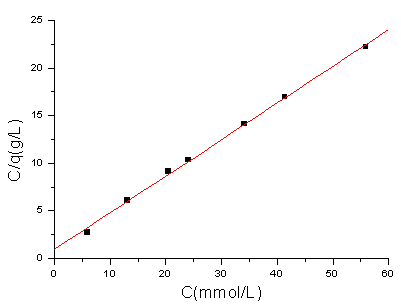
图1 壳聚糖对Zn2+的吸附等温线
Fig.1 Adsorption isotherm of CTS to
Zn2+
图1为平衡浓度/吸附量(即C/q)与平衡浓度C关系曲线,呈良好的直线关系(求得直线方程为C/q=0.38421C+0.97154,相关系数R=0.9992)。说明壳聚糖对Zn2+的吸附符合Langmuir吸附等温式:C/q=
C/q0+1/(q0b)。由得到的直线方程求得饱和吸附量为:q0=2.60
mmol/g。与实验值接近。
2.2 吸附时间对吸附量的影响
Zn2+初始浓度为0.04289 mol/L,恒定温度为25℃,100mL吸附液中含有壳聚糖0.8
g,改变吸附时间,测得的吸附量见表2。
表2 不同吸附时间下CTS对Zn2+的吸附量
Table 2. The adsorption capacity of
CTS to Zn2+ in different times
时间(h) |
1.0 |
1.5 |
2.0 |
3.0 |
5.0 |
8.0 |
13.0 |
18.0 |
21.0 |
吸附量(mmol/g) |
1.49 |
1.77 |
2.03 |
2.09 |
2.20 |
2.25 |
2.30 |
2.33 |
2.35 |
从实验结果可知,当吸附开始时,吸附速度较快,吸附量迅速上升,5h后吸附量增加不明显。
用时间/吸附量(即t/q)对时间t作图,得到线性关系良好的直线,其方程为:t/q=0.4152t+0.21485,相关系数r=0.99995(见图2)。这表明该条件下壳聚糖吸附锌离子的行为符合庄国顺等根据质量作用和单分子层吸附机理提出的动力学方程[6]:
t/q= t/ qe+M/ KCM(0)。
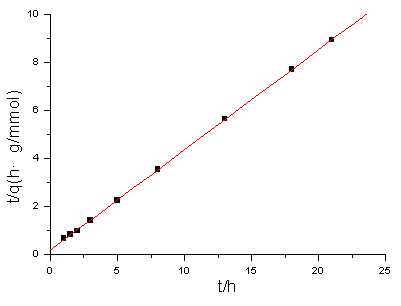
图2 壳聚糖吸附Zn2+的动力学曲线
Fig.2 The kinetic curve of adsorption
2.3 pH值对吸附的影响
保持其他条件相同,只改变吸附溶液的pH值,得到结果如下。
表3 pH值对Zn2+吸附量的影响
Table 3 The effect of the pH value on
the adsorption capacity of CTS to Zn2+
pH |
2.0 |
2.5 |
3.3 |
4.0 |
5.0 |
5.2 |
5.4 |
5.7 |
6.5 |
吸附量(mmol/g) |
1.74 |
1.98 |
2.22 |
2.31 |
2.37 |
2.38 |
2.39 |
2.40 |
2.07 |
* Zn2+初始浓度为0.04289 mol/L,其它条件同表1。
*The initial concentration of Zn2+ is 0.04289 mol/L; The other condition is the
same with table 1.
在强酸性条件下(pH<2),-NH2会以-NH3+形式存在,对锌离子的络合能力大大减弱,因此壳聚糖对锌离子的吸附量很小。随着pH值增大,游离氨基含量增加,与锌离子的络合能力也随之提高,吸附量逐渐增大。当溶液pH值达到5~6时,壳聚糖与Zn2+络合程度趋于最大。当pH>7时,因Zn2+以Zn(OH)2的形式沉淀出而使吸附量减小。
2.4 温度对吸附量的影响
温度对平衡吸附量有一定影响,但影响不大。平衡吸附量随温度的升高而有所增加。该结论与文献[5]的研究结果一致。
表4. 不同温度下CTS 对Zn2+的吸附量
Table 4. The adsorption capacity of
CTS to Zn2+ at different temperature
| 温度(℃) | 29.4 | 34.7 | 38.9 | 44.8 | 49.7 |
| 吸附量(mmol/g) | 2.21 | 2.22 | 2.23 | 2.28 | 2.30 |
* Zn2+初始浓度为0.04218 mol/L。
*The initial concentration of Zn2+ is 0.04218 mol/L.
2.5 不同锌盐阴离子的影响
选择了ZnSO4、 Zn(Ac)2、ZnCl2三种锌盐进行对比研究,结果表明,不同阴离子对Zn2+的吸附量有影响,二价阴离子(SO42-)锌盐吸附量高于一价阴离子(Ac-1、Cl-1)锌盐的吸附量。这说明在不同锌盐与壳聚糖的反应中二价阴离子也参与了配位反应。对于一价阴离子锌盐吸附量之间的差别目前尚不清楚。
表5 不同阴离子时的Zn2+吸附量
Table 5 The adsorption capacity of
CTS to Zn2+ with different anions
锌盐 |
ZnSO4 |
Zn(Ac)2 |
ZnCl2 |
吸附量(mmol/g) |
2.57 |
1.85 |
1.55 |
*其他条件同表1。
* The other condition is the same with table 1.
3.结论
高脱乙酰度壳聚糖(脱乙酰度≥99%,粘均分子量为4.65×105)对Zn2+吸附具有Langmuir吸附特性,其最佳吸附条件是:锌盐为硫酸锌;溶液的pH为5-6;100
mL吸附液含有壳聚糖0.8 g左右时,Zn2+起始浓度为0.05-0.06 mol/L。
REFERENCES
[1] Liu Y X, Fan Z R, Sun X H. Journal of Shenyang Institute of Chemical Technology
(Shenyang Huagong Xueyuan Xuebao), 2002, 16 (3): 202-205.
[2] Liu J H. Jouranl of Hangzhou Teachers College (Hangzhou Shifan Xueyuan Xuebao), 2000,
(6): 74-77.
[3] Chen T,Wang S X. Journal of Jiangsu Agricultural College (Jiangsu Nongxueyuan Xuebao),
1996, 17 (2): 63-66.
[4] Liu Y R,Chen S, YU P. Jouranl of Fujian Teachers University (Natural science) (Fujian Shifan Daxue Xuebao), 1998, 14 (2): 58-61.
[5] Huang X J, Wang A Q, Yuan G P. Ion Exchange and Adsorption (Lizi Jiaohuan Yu Xifu),
2000,16 (1): 60-65.
[6] Zhuang G S, Chen S, Ai H T. Acta Chimca Sinica (Huaxue Xuebao),1984, 42: 1085-1088.