http://www.chemistrymag.org/cji/2004/06b082nc.htm |
Nov. 1,
2004 Vol.6 No.11 P.82 Copyright |
Li Zhengping1, Wang Yucong1,
Zhang Weiwei1, Zhang Shuhong2
(1College of Chemistry and
Environment Science, Hebei University, Baoding 071002; 2Bioinorganic
Chemistry Laboratory, Agricultural University of Hebei, Baoding 071001, China)
Abstract
Ferric nanoparticles interact with proteins by electrostatic forces and aggregate to form large particles, which result in strong absorption to incident light. The absorbance is well proportional to the concentration of proteins in the range of 0.1-10.0 mg/L. Based in these, a new spectrophotometry assay for protein determination was established by using ferric nanoparticles as probes. The detection limit for bovine serum albumin (BSA) is 34 mg/L. The proposed method has been employed for the determination of total proteins in human serum with satisfactory results.Keywords Ferric nanoparticles; Protein; Spectrophotometry
氢氧化铁(Ⅲ)纳米粒子为探针的蛋白质吸光光度分析研究
(1河北大学化学与环境科学学院,保定 071002; 2河北农业大学生物无机实验室,保定 071001)
2004年9月27日收稿;国家自然科学基金(
No.20375011)和河北省自然科学基金(No.203711)资助项目摘要
Fe(OH)3纳米粒子与蛋白质通过静电力相互作用,形成大的聚集体,产生强烈的光吸收,其增强的吸光度与蛋白质的浓度在0.1~10.0 mg/L 范围内呈良好的线性关系。由此建立了以Fe(OH)3纳米粒子为探针, 用吸光光度法灵敏测定蛋白质的新方法。该方法对牛血清蛋白的检出限为34 mg/L,用于测定人血清中蛋白质含量,获得了可靠的分析结果。关键词 Fe(OH)3纳米粒子,蛋白质,吸光光度法
蛋白质的定量分析在生命科学研究及临床诊断等诸方面都占有很重要的位置。蛋白质的测定方法主要有吸光光度法、荧光法[1]、化学发光法[2]及共振光散射分析法[3]。其中吸光光度法,如双缩脲法[4]和考马斯亮蓝法[5],由于仪器简单,结果可靠,一直被作为实验室中测定蛋白质的标准方法。其主要缺点是检测灵敏度低,只能测到
2.0 mg/L 以上的蛋白质。随着蛋白质组学的发展,人们需要定量分析浓度更低的生物样品或提纯的蛋白质。本文研究了Fe(OH)3纳米粒子与蛋白质之间的相互作用,并建立了以Fe(OH)3纳米粒子为探针的蛋白质吸光光度分析方法,该方法的灵敏度可以与荧光法相媲美,应用于生化样品的分析,取得了可靠的结果。1 实验部分
1.1 仪器与试剂
2501PC型分光光度计(日本岛津公司);756MC型分光光度计(上海第三分析仪器厂);pHS-10A型酸度计(上海雷磁仪器厂);QL-901旋涡混合器(江苏省海门市麒麟医用仪器厂)。牛血清蛋白(BSA,SIGMA)、人血清蛋白(HSA,天津市灏洋生物制品有限责任公司)、g-球蛋白(g-globulin,天津市灏洋生物制品有限责任公司)、鸡蛋白(Egg albumin,SIGMA)、明胶(gelatin,SIGMA)和胰岛素(insulin,SIGMA),分别配制成100 mg/L 水溶液,置于4℃冰箱中保存,使用前稀释为所需浓度的工作液。pH 7.4的二甲胂酸钠(AMRESCO)缓冲溶液用于控制酸度。FeCl3(天津市北辰跃化学试剂厂)及其余试剂均为分析纯。Fe(OH)3纳米粒子按文献[6]的方法制备,最终在0.1 mol/L 二甲胂酸钠缓冲溶液中(pH 7.4)的浓度为2×10-3 mol/L (以Fe3+含量计算)。本文用水为去离子二次蒸馏水。
1.2 实验方法
在10 mL 具塞刻度比色管中依次加入1.5 mL Fe(OH)3胶体溶液、一定量的蛋白质标准溶液或被测样品,用水稀释至刻度并混合均匀。在2501PC型分光光度计上扫描并测定其吸收光谱,确定其最佳测定波长之后,以756MC型分光光度计在365 nm 处测定其吸光度A。以Fe(OH)3胶体溶液为空白,测定其吸光度A0 ,以DA = A-A0作为测定蛋白质的响应信号。

(1) (2)
图 1 Fe(OH)3纳米粒子及其与牛血清蛋白(BSA)的聚集体的透射电子显微镜图
Fig. 1 TEM photograph of ferric nanoparticles and the aggregates of ferric nanoparticles and BSA
2 结果与讨论
血清白蛋白的等电点在pH 4.7,在二甲胂酸钠缓冲溶液中, Fe(OH)3纳米粒子在pH 1.8~7.6带正电荷[6],所以二者在pH 4.7~7.6会发生静电力的相互作用。如图1(1)所示,本文制备的Fe(OH)3纳米粒子的直径10 nm 左右,且粒度分布均匀。当它与BSA相互作用后,形成了大约1.0mm 的聚集体(如图1(2)所示),但溶液中并未形成聚沉现象,说明该聚集体是高度水合的松散结构。根据Pasternack等的理论解释[7],该聚集体溶液对入射光的吸收应正比于其吸收参数Cabs
Cabs=(pr2)4xIm[(m2-1)/(m2+2)]
式中r是聚集体的半径,m是聚集体的折光指数nsph和周围介质折光指数nmed的比值,x是聚集体的体积参数等于(2prnsph)/ l,I是入射光的强度。由此可见,其吸光度应与入射光的波长成反比,与聚集体的半径成正比。如图2所示,Fe(OH)3的胶体溶液以及它与蛋白质的混合物的吸光度都随入射光波长的增加而线性降低,但在l > 450 nm 时,其降低的斜率大大降低了。由于蛋白质和Fe(OH)3纳米粒子形成大粒子聚集体,其吸光度增加,在365 nm 吸光度的增加达到最大值。本文选用365 nm 为测定蛋白质的波长。
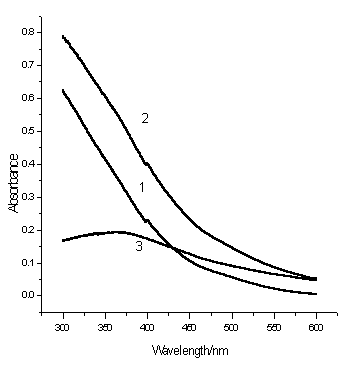
图2 Fe(OH)3的胶体溶液及其与蛋白质的混合物的吸收光谱
1. Fe(OH)3胶体; 2. BSA与Fe(OH)3胶体溶液混合物; 3. 2和1的差谱; Fe(OH)3胶体(mol/L),3×10-4;BSA(mg/L),5.0 ;pH 7.4.
Fig.2 The absorption spectra of ferric colloid solution and its mixture with protein
2.2 实验条件的优化
2.2.1 pH值的影响
在pH 6.0~8.0范围内,分别在二甲胂酸钠、磷酸盐及Tris-HCl缓冲溶液中,试验了1.0 mg/L BSA对吸光度的响应,结果表明,在二甲胂酸钠缓冲溶液中,BSA的响应信号稳定,其吸光度在pH 7.4达到最大值,本文选择pH 7.4的二甲胂酸钠缓冲溶液控制体系的酸度。
2.2.2 反应时间与稳定性
在室温下,BSA与Fe(OH)3
2.2.3 Fe(OH)3纳米粒子浓度的影响
在1.0×10-4~1.0×1.0-3 mol/L 范围内,Fe(OH)3胶体溶液及其与BSA的混合溶液的吸光度都随Fe(OH)3纳米粒子的浓度升高而增加,在Fe(OH)3纳米粒子浓度为3.0×10-4 mol/L 时,二者吸光度差值最大,该浓度被确定为测定蛋白质的最佳浓度。
2.2.4 离子强度的影响
以加入NaCl控制溶液中的离子强度。当NaCl浓度在0.1~1.8 mmol/L 变化时,Fe(OH)3纳米粒子与BSA的混合溶液的吸光度一直保持稳定不变,说明二者之间的静电作用很强。但Fe(OH)3纳米粒子溶液的吸光度在NaCl浓度大于0.1 mmol/L 时缓慢随离子强度的增大而增加,可能是在强电解作用下Fe(OH)3纳米粒子发生了聚合所致。此实验表明,以Fe(OH)3纳米粒子溶液为空白,当NaCl浓度小于0.1 mmol/L 时,对蛋白质的测定无影响。
2.2.5 校正曲线与灵敏度
在优化条件下,按实验方法,研究了BSA的响应信号与其浓度的关系,所有分析参数列于表1。结果表明,该方法具有良好的线性关系以及较宽的线性范围,用于蛋白质的测定,灵敏度高,精密度好。
表1 蛋白质测定的线性范围与灵敏度
Table 1 Analytical parameters for the determination of protein
蛋白质 |
线性范围 ( mg/L) |
标准曲线方程 |
线性相关系数 |
检出限( mg/L) |
牛血清蛋白 BSA |
0.1 ~1.0 |
DA= 0.00657+0.0671C | 0.9829 |
34 |
牛血清蛋白 BSA |
1.0 ~10.0 |
DA = 0.0477+0.013 8C | 0.9998 |
C = BSA的浓度( mg/L); Fe(OH)3胶体溶液(Ferric colloid solution):3×10-4 mol/L; pH 7.4; l = 365 nm
2.2.6
共存物质的干扰试验了常见的金属离子及氨基酸对测定1.0 mg/L BSA的干扰,结果列于表2。结果表明,当金属离子浓度小于10-6 mol/L及等量的氨基酸均不干扰蛋白质测定。由于该分析方法是基于生物大分子与纳米粒子相互作用,故对于少量小分子共存物质不敏感,具有较强的抗干扰能力。
表
2 共存物质的干扰Table 2 Interference of foreign substances
干扰物质 |
浓度 (×10-5 mg/L) |
相对误差 (%) |
Cu2+ |
1.0* |
-4.3 |
Zn2+ |
1.0* |
0.25 |
Mn2+ |
0.1* |
-3.9 |
Cd2+ |
1.0* |
2.6 |
Fe3+ |
0.1* |
2.8 |
Co2+ |
1.0* |
-4.2 |
L- 谷氨酸 |
1.0 |
2.9 |
L- 丙氨酸 |
1.0 |
-3.6 |
L- 精氨酸 |
1.0 |
-0.26 |
L- 组氨酸 |
1.0 |
2.5 |
L- 白氨酸 |
1.0 |
4.4 |
DL- 苏氨酸 |
1.0 |
1.9 |
DL- 铬氨酸 |
1.0 |
0.20 |
D- 甲硫氨酸 |
1.0 |
3.1 |
L- 半膀胱氨酸 |
1.0 |
0.90 |
* mol/L; Fe(OH)3
胶体溶液(Ferric colloid solution):3×10-4 mol/L; pH 7.4; l = 365 nm2.2.7
人血清总蛋白含量的分析血清样品由河北农业大学医院提供,新鲜的血清样品经稀释后同时用该方法及考马斯亮蓝法[8]进行测定,如表3所示,测定结果与考马斯亮蓝法一致,测定的相对标准偏差小于2.0 %。表明该分析方法可靠,可用于实际样品的测定。
表
3 血清样品分析结果( n = 5 )Table 3 Results of protein assay in human serum samples ( n=5 )
样品 |
本法平均值 (g/L ) |
相对标准偏差 (%) |
考马斯亮蓝法平 (g/L ) |
相对标准偏 (%) |
血清 1 |
60.4 |
1.6 |
62.0 |
2.0 |
血清 2 |
57.2 |
1.6 |
56.8 |
1.7 |
血清 3 |
58.5 |
1.9 |
58.6 |
1.8 |
2.2.8
不同蛋白质的响应差别在相同的条件下测定了1.0 mg/L 不同蛋白质的响应值DA,并与BSA相比较。如表4所示,该方法对HAS、BSA的响应值变化较小,但鸡白蛋白和g-G的响应值分别降低和升高了约30%,明胶和胰岛素的响应较弱。其响应信号的大小符合各蛋白质分子量的顺序,说明该分析方法的响应信号取决于蛋白质体积大小。不同蛋白质的响应差别对于样品中蛋白质总量测定的准确度影响很大。Stoscheck曾评价了双缩脲法和考马斯亮蓝等标准方法中的不同蛋白质的响应差别[9],结果表明双缩脲法中各类蛋白质的响应差别最小。与Stoscheck的评价相比,本文所建立的分析方法与双缩脲法中不同蛋白质的响应差别相当,表明该方法适于生物样品中蛋白质总量的测定。
表
4 不同蛋白质的响应差别Table 4 The results of the different proteins
蛋白质 |
吸光度 |
相对值 (%) |
牛血清蛋白 |
0.080 |
100 |
人血清蛋白 |
0.093 |
116 |
胰岛素 |
0.036 |
45.0 |
明胶 |
0.023 |
28.7 |
鸡白蛋白 |
0.056 |
70.0 |
| g-球蛋白 | 0.107 |
133 |
Fe(OH)3
胶体溶液(Ferric colloid solution):3×10-4 mol/L; 蛋白质: 1.0 mg/L; pH 7.4; l = 365nm。REFERENCES
[1] Li N, Li K A, Tong S Y. Anal . Biochem., 1996, 233 : 151.
[2] Li Z P, Li K A, Tong S Y. Microchem. J., 1998, 60: 217.
[3] Li Y F, Huang C Z, Hu X L. Chinese J. Anal. Chem. (Fenxi Huaxue), 1998, 26(12):
1508.
[4] Lowry O H, Rosenbrough N J, Farr A L et al. J. Biol. Chem., 1951, 193: 265.
[5] Bradfors M. Anal. Biochem., 1976, 72:248.
[6] Seno S, Akita M, Ono T et al. Histochem, 1985, 82: 307.
[7] Pasternack R F, Bustamante C, Collings P J et al. J. Am. Chem. Soc., 1993,115:5393.
[8] Zhang L X, Zhang T F, Li L Y. The Method and Technology of Biochemical Experiment
(Sheng Wu Shi Yan Fang Fa He Ji Shu). Beijing: Higher Education Press, 1997: 138.
[9] Stoscheck C M. Anal. Chem., 1987, 160 : 301.