http://www.chemistrymag.org/cji/2005/071011pc.htm |
Jan.21, 2005 Vol.7 No.1 P.11 Copyright |
Shao Shouyan
(Jiangsu Suopo Group Co. Ltd., Zhenjiang 212006)
Abstract Spherical copolymer ligand
from 2-vinyl pyridine and glycol acrylate was prepared, and reacted with
tetracarbonyldichlorodirhodium to form porous polymer catalyst. The state of the bond in
the catalyst was characterized by XPS and IR spectroscopy, and its catalytic capability in
methanol carbonylation was evaluated.
Keywords copolymer, catalyst, carbonylation, catalytic capability
邵守言
摘要 制备聚(2-乙烯吡啶-丙烯酸乙二醇酯)球型共聚物配体,并与四羰基二氯二铑作用形成一种孔型的高分子催化剂。本文用光电子能谱(XPS)和和红外光谱(IR)对其键合状态进行了表征,同时评价了该配合物在催化甲醇羰基化反应中的催化性能。
关键词 共聚物, 催化剂, 羰基化, 催化性能
由高聚物配体制成的羰基铑配合物作为甲醇羰基化反应的催化剂,与以有机小分子为配体的羰基铑配合物的使用方法类似,在较温和的条件下即具有高的催化活性。甚至在多数情况下使用高分子铑催化剂的反应温度和压力可以更低一些。就其稳定性而言,尤其是热稳定性,一般来说要优于同类型的低分子量有机配体催化剂。高聚物催化剂催化的甲醇羰基化反应的产物选择性和催化活性,有可能与同类型的低分子量有机配体催化剂接近甚至于更好[1]。与低分子催化剂的相似,在高分子催化剂中高聚物配体与过渡金属离子之间的结合方式对催化活性的影响,即所选用的配体骨架能与过渡金属形成离子键和非对称单配位键的,其甲醇羰基化催化活性明显高;而形成螯合环或呈简单吸附型的则活性较差。
高分子载体的高分子链上分布着有配位能力的基团,很早以前就发现键合在树脂上的阳离子过渡金属配合物对甲醇羰基化和烯烃氢甲酰化有一定的催化作用[2]。此后,作为羰基化催化剂配体的高聚物被研究与应用的有:环氧乙烷树脂[3]、聚乙胺型螯合树脂[4]、含膦基(Ph2P-)聚苯乙烯树脂[5-8]、含五氯硫酚(C6Cl5S-)聚苯乙烯[9]、聚苯乙烯磺酸盐树脂[4]、吡啶类高聚物树脂[10~13]、邻苯二胺聚合物树脂[14]、联吡啶聚合物[15]、聚乙烯吡咯烷酮[4, 15]和乙烯咪唑高聚物树脂等。最近N.V. Kolesnichko等分别用含有N和O的聚氨基葡萄糖、甲壳素大分子以及吡啶类共聚物与铑配合,所形成的配合物可用于醋酸甲酯羰基化制醋酐,其CO吸收速率可达4.0 mol·dm 3·h-1以上[16]。
本文报道了一种新型的交联高分子配体小球,它以2-乙烯吡啶和丙烯酸乙二醇酯为单体共聚而成。将其与四羰基二氯二铑反应生成相应的配合物,作为甲醇羰基合成醋酸的催化剂。研究证明该催化剂具有良好的催化性能。
1.1 配合物的制备
等摩尔的2-乙烯吡啶和丙烯酸乙二醇酯加入单体质量1.5%的偶氮二异丁腈为引发剂,并加入所需量的煤油、甲苯为致孔剂,混合均匀后为有机相。将5倍于有机相体积的水加入带有搅拌装置的反应器中。加入重量为水相10%的Na2SO4,将有机相加入到水相中,以搅拌速度控制高分子小球的粒度。升温至65℃反应24小时,过滤,用水反复洗涤,干燥后,用丙酮抽提24小时,得到比表面40-60m2/g的交联高聚物配体小球(PVE)。
将一定量的该配体与适量的[Rh(CO)2Cl]2于室温下在甲醇溶液中反应,30min后加入钠盐沉淀剂,过滤,依次用水、甲醇洗涤,干燥后即得到在空气中稳定的淡黄色的固体铑配合物催化剂(PVERh)。
1.2 配体和配合物的表征
XPS测试在KRATOS AEI ES-300 X-射线光电子能谱仪上进行。以Mg Kα1,2 X-射线(Ex=1253.6eV)作激发源。化合物[Rh(CO)2Cl]2在高真空升华,为此采用液氮冷却进样测定。在UR-10型红外光谱仪上以KBr压片测定配合物的红外光谱。
1.3 催化剂的性能评价
PVERh催化剂催化甲醇羰基化反应是在FX-500型锆质高压釜间歇式反应器中进行的。实验按照如下步骤进行:在反应釜中加入一定量的催化剂、助催化剂碘甲烷、反应物甲醇;用一氧化碳置换反应釜内的空气三次后,给系统充入一氧化碳到压力为3.0Mpa,开始搅拌并加热,直至反应体系温度升高到反应温度。甲醇在催化剂的作用下与一氧化碳反应生成乙酸。反应式如下:
反应产物用GC-8810型气相色谱仪鉴定。固定相GDX-203(改性),柱长2m,柱温150℃,热导池检测器,载气为氢气。 2 结果和讨论
2.1 配合物的表征
2.1.1 XPS分析结果
经过X光电子能谱分析可知,共聚物配体的N1s结合能为398.2eV,而所形成的配合物的N1s结合能则升高为399.3eV,这说明在配合物的形成过程中伴有配体中的N原子给出电子。当[Rh(CO)2Cl]2与配体形成稳定的配合物后,各配合物的Rh3d5/2结合能均比配位前[Rh(CO)2Cl]2的Rh3d5/2低,这说明在配合物的形成过程中伴有Rh原子接受电子,致使其结合能降低。N原子与Rh原子在配合物中结合为σ键,其中N是电子给体,Rh是电子受体,即配合物中存在N-Rh配位键。
共聚物配体的O1s峰并未分辨出羰基中两种不同性质的氧,半高宽为3.0 eV。在相应的配合物中,O1s结合能升高到532.5 eV以上,高于配位前的O1s。这不能用配合物分子中增加了[Rh(CO)2Cl]2的羰基氧来解释,因其O1s为532.4eV。唯一的解释是分子中
2.1.2 红外分析结果
PVERh配和物的红外光谱表明,其在2030和2100cm-1处有两组末端羰基的吸收峰。即说明铑是以顺二羰基铑的形态与配体配位。
2.2 高分子配合物的催化性能
表1是不同粒度的高分子配合物催化剂在不同反应条件下的反应结果。这些反应中催化剂的加入量均为8g,甲醇的加入量为6.02mol,碘甲烷的加入量为1.02mol。可以看出,反应基本上在120-145℃的温度范围内就可以反应完全,明显低于工业上的反应温度。铑浓度从250-400ppm不等,但是时间足够长时均能将反应进行完全。反应压力范围为3.0-5.5MPa,它的影响将在后面进一步讨论。
表1 不同反应体系甲醇羰基化反应的条件参数及反应产物组成
Catalyst |
Rh |
T |
P |
t |
G.C. (wt%) |
||||||
CH3I |
AcOMe |
MeOH |
AcOH |
H2O |
Me2O |
(Ac)2O |
|||||
40~60 |
300 |
135 |
3.5 |
277 |
29.65 |
19.49 |
- |
40.29 |
5.77 |
2.38 |
2.42 |
40~60 |
350 |
125 |
5.0 |
230 |
28.44 |
15.11 |
- |
48.22 |
3.88 |
0.76 |
3.59 |
100~120 |
350 |
120 |
5.5 |
257 |
33.67 |
27.33 |
1.82 |
19.02 |
10.2 |
7.13 |
0.83 |
100~120 |
400 |
140 |
3.0 |
134 |
39.21 |
14.94 |
19.98 |
3.28 |
11.31 |
11.34 |
- |
100~120 |
250 |
145 |
4.0 |
300 |
29.73 |
18.65 |
- |
39.76 |
5.82 |
3.01 |
3.03 |
2.2.1 反应时间的影响
羰基化反应中甲醇转化率随时间的变化可以粗略地分为两个阶段,如图1所示(催化剂和初始反应物加入量同表1,Rh浓度为400ppm,反应压力3.0MPa,反应温度130-140℃)。第一个阶段甲醇转化率随反应时间线性增加;甲醇消耗到一定程度时甲醇转化率的增长速率随时间逐渐减小,即进入了第二个阶段,在接近反应终了时曲线接近于与时间轴平行。可见反应体系中甲醇的浓度,对高分子催化剂催化的羰基化反应是有着比较明显的影响的。因为活性金属铑大部分分散于高分子小球的孔隙中,甲醇浓度提高使得甲醇分子向孔隙内铑活性中心扩散的推动力增大,有利于羰基化反应的进行。同时,由表1的结果可以看到,在比表面积均为45m2/g的条件下,不同粒度的催化剂活性有一定的差异,说明催化剂外层表面的铑活性中心对催化反应的作用,大于其孔隙中表面的铑活性中心。
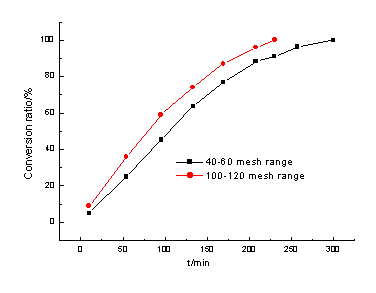
图1 甲醇转化率随反应时间的变化关系
2.2.2 反应压力的影响
反应压力对羰基化反应的影响与文献报道[17]的过程类似,即一氧化碳分压高到一定程度后,反应速率不再依赖于压力。如图2所示(催化剂和初始反应物加入量同表1,Rh浓度为350ppm,反应温度130-140℃),当一氧化碳分压高于1.2MPa时反应速率基本上不再随压力而变化。即在一定的范围内,一氧化碳的压力增高有利于其在液体中良好的分散,并与甲醇发生羰基化反应。但是当一氧化碳在反应体系中分散到一定程度后,压力的增加对反应不再有明显的影响。
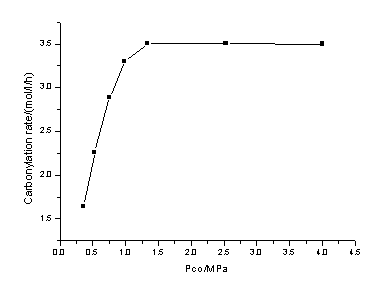
图2 反应压力对羰基化反应速率的影响
2.2.3 Rh浓度的影响
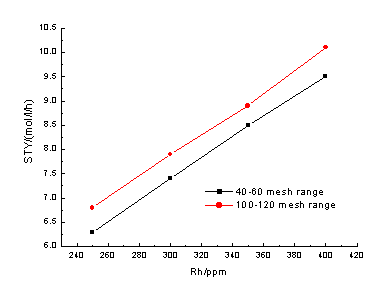
图3 铑浓度对羰基化反应时空收率的影响
羰基化反应速度与反应体系中的铑浓度是直接相关的。如图3所示(催化剂和初始反应物加入量同表1,反应压力3.0MPa,反应温度120-130℃),在我们实验的铑浓度范围内,反应的时空收率是随着铑浓度的增加而线性增加的。
2.2.4 高分子催化剂粒度的影响
高分子小球催化剂的粒径及比表面对反应有直接的影响,这是该催化体系不同于均相催化体系的一个显著特点。图1和图3都很清楚地表明,在比表面积相同的基础上,粒径较小时对反应是有利的。这是因为粒径较小时,催化剂的外层表面积相对较大,这有利于活性金属铑与反应物的直接接触,对催化剂的活性有一定的影响。
由2-乙烯吡啶和丙烯酸乙二醇酯共聚得到的高分子小球,与铑配位得到的甲醇羰基化催化剂具有优良的催化性能。在温和的反应条件下,不仅可将甲醇迅速地全部羰基化为乙酸,甚至可以直接得到乙酐,这是该催化剂的一个明显的优势。 REFERENCES
[1] Liu Z Y, Pan P L, Jiang H etal. Chinese Science Bulletin, 1999, 44 (12): 345-357.
[2] Douek I E, Wilkinson G. J.Chem..Soc., A 1969: 2604.
[3] Vainshitein E F, Lapidus A L, LPopova I. US 1108088(1985).
[4] Shimazu S, Ishibashi Y, Miura M etal. Appl.catal.,1987, 35: 279.
[5] Jarrell M S, Gates B C. J.Catal.,1975, 40: 255.
[6] Ki S R, Seong I W, J.Mol.Catal.,1990, 59: 353.
[7] Hong L , Ruckenstein E, J.Mol.Catal.,1992, 77: 273.
[8] Brasio D N, Tempesti E, Kaddouri A, etal. J.M.Catal.1998, 176 (1): 253-259.
[9] Webber K M, Gates B C, Drenth W, etal. J.Mol.Catal.,1977, 3: 1-5.
[10] Drago R S, Nyberg E D, Zombeck A. Inorg.Chem.,1981, 20: 641.
[11] Drago R S, ELAmma A. US 4328125 (1982).
[12] Marston C R, Geo G L, EP277 824 (1988).
[13] Noriyaki Y, Takeshi M, Ikuo O et al. JP10246361[98 245361](C1.C07C53/08).
[14]Chen D A, Huang S Z. Ion Exchange and Adsorption, 1992, 8 (5) : 437.
[15] Scates M O, Warner R J, Torrence G P. US 5 281 359 (1994).
[16] Kolesnichko N V , Batov A E, Markova N A, et al. Russsian Chemical Bulletin, Intenational Edition, 2002, 51: 259-262.
[17] Yuan G Q. Polymer Bulletin, 1993, (1): 136-141.