http://www.chemistrymag.org/cji/2005/072020nc.htm |
Feb.10, 2005 Vol.7 No.2 P.20 Copyright |
Cheng Jie, Cao Gaoping, Yang Yusheng
( Research Institute of Chemical Defence, Beijing, 100083)
Abstract The objective of the present paper is to demonstrate the possibility to synthesize manganese oxide xerogels as alternative economic materials for supercapacitors. Manganese oxide xerogels were made using sol-gel method. XRD results show that the manganese oxide xerogels have a crystalline Mn3O4 structure. TEM images reveal that the particle size of the manganese oxide xerogels is between 30-50nm. Results of N2(77K) adsorption isotherm show that the Pore size distribution of manganese oxide xerogels is in the regime 1-20nm with a BET specific surface of 70.8m2/g. The capacitive performance was measured using cyclic voltammetry in 7M KOH. Capacitance of manganese oxide xerogels is about 190F/g in potential window 0.05V-0.65V vs. Hg/HgO. High performance obtained indicates that manganese oxide xerogels are promising electrode materials for supercapacitors.
Keywords manganese oxide xerogels, supercapacitor 锰氧化物干凝胶电容性能研究
程杰,曹高萍,杨裕生
( 防化研究院,北京,100083)
摘要 用溶胶
-凝胶法制备了锰氧化物干凝胶。XRD研究表明制得的材料具有Mn3O4的晶体结构。TEM结果显示,制得的材料颗粒粒径分布在30-50nm。液氮吸附结果表明,BET比表面积达到70.8m2/g,材料的孔隙分布集中在1-20nm之间(BJH)。用循环伏安法研究了锰氧化物干凝胶在7M KOH体系的电容性能,此电极材料在电位窗口0.05V-0.65V(参比HgO/Hg电极)具有190F/g的比电容量。测试表明,锰氧化物干凝胶是一种性能优异的电容材料。关键词 锰氧化物干凝胶,超级电容器
1引言
本文制备了一种廉价的锰氧化物干凝胶电容材料,颗粒粒径在30-50nm之间,循环伏安研究表明在7M KOH水溶液体系中具有190F/g的电容量,可逆性、循环性良好,是一种高性价比的电容材料。
2 实验
材料表征:用Rigaku D/MAX-RB型X-射线衍射仪( CuKa ) 测试材料组成和结构,用HITACHI H-9000 NAR TEM测试材料的颗粒尺寸和表面状况,用美国Micromeritics公司ASPA210型快速比表面和孔径分布仪测试材料比表面积和孔隙结构。
电极制备:将锰氧化物干凝胶、镍粉、CMC以66.6:33.2:0.1的质量比混合,加适量水调浆,取两片泡沫镍,每片一面涂部分浆料,夹持成三明志式电极,干燥、辊压,电极面积为1.0´ 1.0cm2,含纳米锰氧化物干凝胶约30mg。
电化学性能测试:以高性能活性炭电极作为对电极,7M KOH水溶液作为电解质,参比电极为Hg/HgO( 同样电解质中) ,组成三电极测试体系,用Solartron 1280Z电化学工作站进行循环伏安测试。
3 结果与讨论
图1为制备的锰氧化物干凝胶的XRD图。对照JCPDF卡片,衍射峰与卡片24-734、80-382 Mn3O4对应较好( 如图2) ,制备的材料应主要含Mn3O4晶态结构。
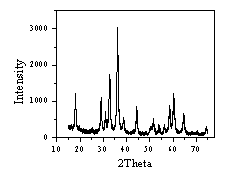
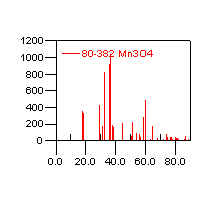
图1 锰氧化干凝胶的XRD图 图2 JCPDF卡片80-382 Mn3O4衍射图
Fig.1 XRD of Manganese Oxide Xerogels Fig2. XRD of Mn3O4(JCPDF80-382)
图
3为锰氧化物干凝胶的TEM图。由图3可见,锰氧化物干凝胶粉体的粒径在30-50nm之间,颗粒间有更细小的结构,次级粒子形态近似球粒状,且分散较为均匀。

(a) (b)
图3 锰氧化物干凝胶的TEM图
Fig.3 TEM of Mn3O4 Xerogels
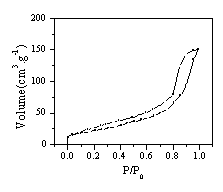
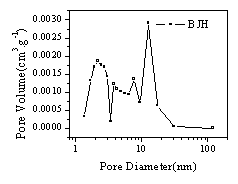
图4 锰氧化物干凝胶N2(77K)吸附等温线 图5锰氧化物干凝胶BJH孔径分布图
Fig.4 N2 isotherm of Mn3O4 Xerogels Fig5. Pore distribution of Mn3O4 Xerogels(BJH)
图
4为锰氧化物干凝胶的N2(77K)吸附等温线,可见制备的锰氧化物干凝胶的吸附等温线为Ⅳ型,具有较多的中孔。测试表明,材料的BET比表面积达到70.8m2/g。图5为锰氧化物干凝胶BJH孔径分布图,可见材料的孔隙分布集中在1-20nm之间,孔径较大,孔隙结构较好。图6 为锰氧化物干凝胶的循环伏安曲线。实验发现,所制备的锰氧化物干凝胶随循环伏安扫描次数的增加,比电容不断增加( 循环伏安曲线计算比容量的方法参见[14,15]) 。表1为第5次扫描的比电容量,可见在初始扫描的情况下,材料的比电容约50-60F/g。表2列出了循环伏安曲线基本稳定后积分电容量,可见当材料性能稳定后,材料的比电容最大达到194.4F/g。
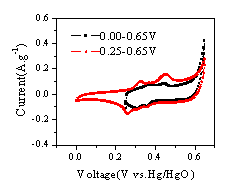
由图6中循环伏安曲线稳定前后的比较可见,锰氧化物干凝胶初始扫描时在电位0.32V(参比Hg/HgO电极,下同)和0.45V处有两个阳极电流峰( 图6( a) ) ,相应的阴极电流峰出现在0.26V和0.36V处。初始扫描时,当电位高于0.6V后有析氧的迹象,而在接近0.0V时储电容量很小。改变循环伏安扫描的电位范围,同样有以上现象( 图6( b) ) 。当循环伏安扫描曲线达到稳定之后,在0-0.65V范围内只有0.49V一个阳极电流峰和0.26V一个阴极电流峰,0.32V处的阳极电流峰和0.36V处阴极电流峰消失。
|
|
|
|
图6
锰氧化物干凝胶在7M KOH中的循环伏安扫描曲线Fig.6 CV curve of Mn3O4 Xerogels(7M KOH, vs. Hg/HgO)
表
1 循环伏安初始扫描时锰氧化物干凝胶的比电容量( 第5周,1mV/s)Table 1 Capacitance for Mn3O4 Xerogels from CV curve( 1mV/s, 5th cycle)
Voltage range /V |
Capacitance /F× g-1 |
Voltage /V |
Capacitance /F× g-1 |
0.25-0.65V |
56.65 |
0.25-0.50V |
40.72 |
0.00-0.65V |
66.84 |
0.25-0.55V |
45.26 |
0.25-0.45V |
23.50 |
0.25-0.60V |
43.08 |
表
2 循环伏安扫描曲线稳定后锰氧化物干凝胶放电比电容量( 1mV/s)Table 2 Capacitance for Mn3O4 Xerogels from CV curve( 1mV/s, stable)
Voltage range /V |
Capacitance /F× g-1 |
Voltage /V |
Capacitance /F× g-1 |
0.25-0.65V |
180.4 |
0.25-0.55V |
128.7 |
0.05-0.65V |
194.4 |
0.25-0.60V |
134.6 |
0.25-0.50V |
74.64 |
0.25-0.62V |
152.6 |
碱性体系中锰氧化物材料可能发生的电化学反应过程如下
[12,16]:因而,锰氧化物干凝胶在循环伏安初始扫描时有一定的结构变化。
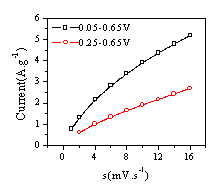
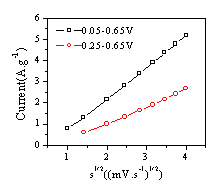
循环伏安曲线稳定后,测试了锰氧化物干凝胶电极阳极峰电流与扫描速度的关系,如图7所示。可见,锰氧化物干凝胶阳极峰电流与扫描速度的平方根呈线性关系,因此,可以推断制备的锰氧化物干凝胶充放电机理是固相质子扩散,并且这种固相扩散起着控制电极行为的作用[17]。当电位范围在0.0-0.65V间时,材料在充电时的固相质子浓度较大(充电是质子由固相脱出),峰电流出现的位置较高( 图6( c) ) ;当电位范围在0.25-0.65V间时,材料在充电时的固相质子浓度相对较小,峰电流出现的位置相对较低( 图6( d) ) ,同时在高电位区出现了质子扩散的动力电流[17]( 图6( d) ) 。
 |
 |
(a) s vs. Ip |
(b) s1/2 vs. Ip |
图7 锰氧化物干凝胶电极循环伏安阳极峰电流与扫描速度的关系
Fig.7 The variation of
anodic peak current for Mn3O4 Xerogels from CV curve(7M KOH)
4 结论
2) 用循环伏安法研究锰氧化物干凝胶的电容性能,结果显示材料有逐渐活化的现象,稳定之后,最大比电容达到194F/g,最高使用电位可达0.65V(参比Hg/HgO电极),是性能优异的电容材料。
3) 在KOH水溶液中,锰氧化物干凝胶材料的电极过程受质子扩散控制。
REFERENCES
[1] Faggiolie, Renap, Dannelv et al. J. Power Sources, 1999, 84 (2): 261-269.
[2] Ashleys. Mech. Eng., 1995, 2: 76-79.
[3] Yoshida A. Denki Kagaku, 1998, 66 (9): 884-891.
[4] B. E. Conway. J. Electrochem. Soc., 1991, 138 (6): 1539-1548.
[5]B.E. Conway. Plenum, New York, NY, 1999.
[6] Deyang Qu, Hang Shi. Journal of Power Sources, 1998, 74: 99-107.
[7] EP1094478.
[8] Mo. Y. Antono M. R. Scherson D. A. In. Situ Ru. Phys. Chem. B, 2000, 104 (9) : 777.
[9] Zheng J P, Jowr J. J. Electrochem. Soc., 1995, 142 (1): L6-L8.
[10] Zheng J P. Solid State Lett., 1999, 2 (8): 359-361.
[11] Liu K C, Anderson M. A. J. Electrochem. Soc., 1996, 143 (1) :124-131.
[12] Junhua Jiang, Anthony Kucernak. Electrochimica Acta, 2002, 47: 2381-2386.
[13] H. Y. Lee, S. W. Kim, H. Y. Lee. Electrochem. Solid-State Lett., 2001, 4: A19.
[14] Kyung-Wan Nam, Kwang-Bum Kim. J. Electrochemical Society, 2002, 149 (3) : A 346.
[15] S C Pang, M A Anderson, T W Chapman. J. Electrochemical Society, 2000, 147 (3) :444.
[16] B Messaoudi, S Joiret, M Keddam, H Takenouti. Electrochim. Acta. 2001, 46: 2487.
[17] Tian Zhaowu. Research method of electrochemistry (Dian hua xue yan jiu fang fa). Beijing: Science publishing company (Ke xue chu ban she), 1984.
 ( a) 1mV/s, 5th cycle
( a) 1mV/s, 5th cycle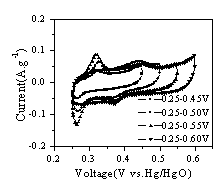 ( b) 1mV/s, 5th cycle
( b) 1mV/s, 5th cycle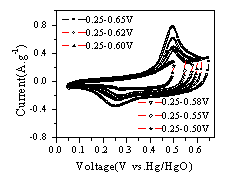 ( c) 1mV/s, stable
( c) 1mV/s, stable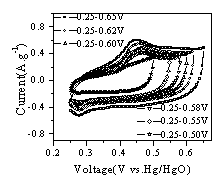 ( d) 2mV/s, stable
( d) 2mV/s, stable