http://www.chemistrymag.org/cji/2005/076041rc.htm |
Jun. 1, 2005 Vol.7 No.6 P.41 Copyright |
Qin Ming, Feng Xizeng,Wang
Likai,Jia Yunfang
(College of Life Science, Nankai University, Tianjin 300071, China)
Abstracts: Recently, as a new tool, microfludic devices have been widely used in
tissue engineering. This review focuses on new developments of microfluidic technology in
tissue engineering, pointing out the advantages and prospects of these concepts for future
application. Firstly, microfludic technology is a new method of cell patterning and
cultivation, including microfluidic patterning, topographical control over cell, and
bioreactors. Secondly, it was shown that microfluidic technology has been applied in many
branches of tissue engineering, such as basal lamina, vascular tissue, liver, bone,
cartilage, neurons and local delivery. Hence, it is necessary to review the development of
microfluidic technology in tissue engineering.
Keyword microfluidics device, tissue engineering, patterning cell, Topographical
control.
微流体技术在组织工程中的应用
秦明,冯喜增,王立凯, 贾芸芳(南开大学生命科学学院 天津300071)
摘要
近年来,微流体技术作为一种新的技术手段在组织工程领域得到了许多应用。本文综述近年来微流体技术在组织工程中的应用情况,首先,微流体技术是一种新的细胞固定和培养技术,包括微流体固定细胞、可控制拓扑结构的细胞和生物反应器等方法;其次,作为一种新的细胞固定和培养技术,微流体技术已在组织工程的许多分领域得到应用,例如基板、血管组织、肝、骨、软骨、神经细胞和定位传递等,并对其研究应用的前景进行展望。关键词 微流体器件, 组织工程, 细胞固定,可控拓扑结构。 2005年5月12日收稿; 天津市科技发展计划应用基础研究重点项目资助课题,教育部留学回国人员科研启动经费资助项目。 1. 引言
组织工程(Tissue Engineering, TE)是综合应用工程学与生命科学的基本原理、基本理论和基本技术相结合,研究并发现可用于组织或器官功能修复与重建的生物替代品的基础应用学科[1]。Hubell J[2] 概括了生物活性材料制备技术及相应的表征方法。随着其他学科的发展,组织工程领域在基于微米/纳米构造的新技术和方法等方面也得到了发展,如以骨头和软骨组织为基础的心脏肌肉和其他复杂结构等的技术和方法[3]。
在二十世纪九十年代,Manz和Widmer[4]首先提出了微流控芯片(mTAS)的概念,它是一种高度集成化和微型化的分析技术方法,目前也被称为芯片实验室(lab on a chip)[5]。与传统分析技术方法相比,其具有快速、节省、方便等特点,已被广泛应用于生物、化学等各个领域。而微流体技术在组织工程领域也将发挥日益重要的作用,因此,本文概述微流体技术在组织工程中的基础与应用的研究进展。 2 微区域可控的细胞固定和生长技术
2.1 细胞的可控性固定技术
应用微流体技术可在基底表面实现不同的细胞图案,这种细胞固定技术在组织工程和基础细胞生物学研究领域十分重要。微流体器件由具有一定孔道结构的PDMS和基底物质构成,通过微流泵或电泳将流体传递至底物上的某一限定区域,进一步将细胞粘连或悬浮在底物的特定区域上[6]。当两条或多条层流液体结合进入一条孔道时,混合流依然互相平行流动,仅在流体内表面发生表面扩散,利用在微孔道中产生和维持不同溶液平行流动的能力,可固定细胞和模拟细胞周围微环境[7]。Takayama S等人[8] 通过将邻近一个细胞的两个流体的内表面固定,用于研究亚细胞处理(如图1所示),而将两种不同的染料或药物应用于相同细胞的不同区域;对于不易附着在固体底物表面的细胞,可用于在可控条件下形成自由悬浮的、精细稳定的三维结构血管图案。
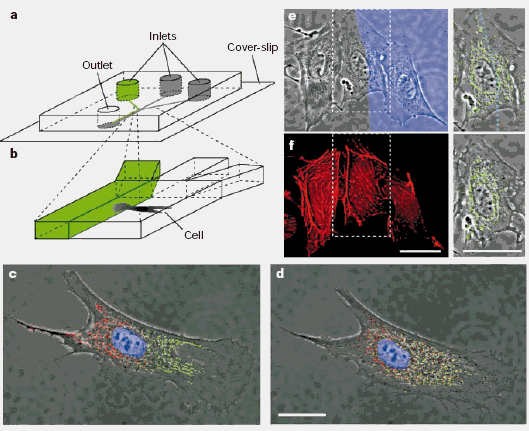
图1 应用多重层流的单一牛血清毛细管内皮细胞不同区域分化图[8]。(a, b)实验装置构成图;(b) 入口孔道与主孔道结合处局部图。(c) 一侧用Mitotracker Green FM,另一侧用Mitotracker Red CM-H2Xros处理后的单细胞荧光图片(整个细胞用DNA连接染料Hoechst 33342处理)(d)与c中相同的细胞处理2.5小时,线粒体红绿两部分内混合。(e)用latrunculin A处理的部分单细胞。蓝色区域表明含有latrunculin A的培养液流动。右边,中间细胞和它的线粒体放大图(绿色)。(f)相同的细胞用latrunculin A 处理10min后立即用Phalloidin–Alexa标记。中间的细胞,仅部分位于含有latrunculin A的流体中,表明限制与此区域的肌动蛋白微丝中断。latrunculin A:红海棉的高毒大环内酯。
Fig.1 Differential manipulation of regions of a single bovine capillary endothelial cell using multiple laminar flows. (a, b) Experimental set-up; (b) shows a close-up of the point at which the inlet channels combine into one main channel. (C) Fluorescence images of a single cell after treatment of its right pole with Mitotracker Green FM and its left pole with Mitotracker Red CM-H2XRos. The entire cell is treated with the DNA-binding dye Hoechst 33342. (d) Image of the same cell as in c but taken 2.5 h later, showing intermixing of the red and green subpopulations of mitochondria. (e) Treatment of a portion of a single cell with latrunculin A. The blue region (Dextran-70,000 Cascade Blue stain) reveals the flow of medium containing latrunculin A. Right, enlarged view of the middle cell and its mitochondria (green). (f) Phalloidin–Alexa 594-labelled image of the same cell immediately after 10 min of treatment with latrunculin A. The cell in the middle, which was only partly in the stream containing latrunculin, shows disruption of actin microfilaments that is limited to this region (scale bars, 25 mm). Further details are available from the authors. Feng X Z等人[9]应用微流体技术先将一抗固定于经化学修饰的活性基底材料表面,进一步将荧光标记的二抗与人直肠癌细胞(CaCO-2)联接,通过抗体间的结合作用将细胞固定于微孔道的液-固表面上,进而可应用于临床肿瘤的诊断分析研究。Chiu D T 等人[10]通过数层表面性质不同的微流体层,可形成由不同种类细胞组成的三维细胞生长的图案,这种三维图案技术可用在内皮细胞临近区域固定肿瘤细胞,并可模仿肿瘤血管组成的空间重排。
2.2细胞的拓扑结构的控制性生长
组织工程研究的核心之一是如何选择合适的方法,构建特定结构的生物材料支架,且使一定数量的细胞在支架中发育生长。同时,人工制造的组织结构应具有良好的可控制的微结构,并在一定的时间内能够维持细胞的生长形态、分化和功能[11]。人工组织结构的一个重要特征是可复制体内空间结构与比例,以便帮助维持细胞体内的原始显形。应用微流体技术,有可能将微结构植入体内,可以应用于免疫分离、细胞内向生长和药物传递等研究[12]。Singhvi R 等人[13]综述了许多可控制细胞和组织拓扑结构的研究成果。Deutsch 等人[14]报道了培养底物表面的三维空间结构可对体外心肌定位产生很大的影响(见图2)。
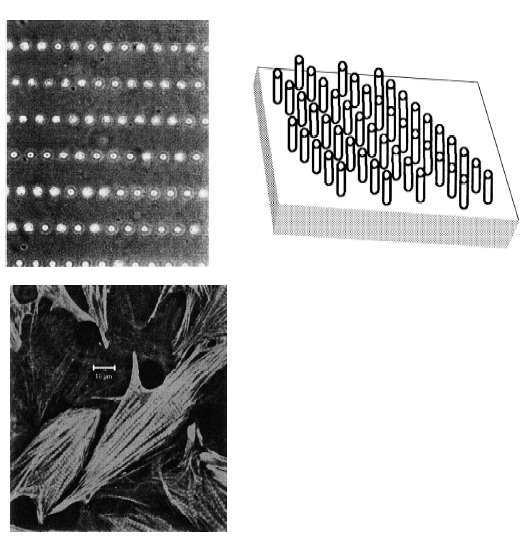
图2 可用来制造微结构的微钉,微结构可影响细胞附属和形态[15]
Fig.2 Micropegs can be used create microarchitectures which direct cell attachment and morphology
Den BraberE 等人[15]报道了微组织的三维结构对细胞粘合有很大的影响。Van
Kooten 等人[16]报道DNA轮廓受微组织结构的影响;其它如细胞在可控制的二维或三维序列中重排对细胞分化、维持和功能持久性有良好的效果;而拓扑结构能影响和引导细胞的移植生长方向[17]。
2.3 生物反应器
培养高密度的细胞是组织工程为达到生理功能的另一个重要任务,为此必须确保通过培养基提供稳定的营养物质和氧气,并及时排出代谢物。第一代应用于细胞培养的生物反应器的设计很简单,仅能向聚集组织泵进营养液;而应用于培养血管和软骨组织的第二代生物反应器可产生脉动流,使组织受到压缩、剪切力和培养基的影响。这种影响大大改进了人工血管、软骨组织和心肌的机械性质[18]。在传统的细胞培养体系中很难实现充分的循环[19],而微流体结构可容易地提供微尺度的可控流体循环,目前已经出现一些应用于细胞培养的二维微流体器件[20]。但多层微流体结构仍不多见[21]。Leclerc
E等人[21a]报道了一种以聚二甲基硅氧烷(PDMS)为基底的多层微流体器件,可用于哺乳动物细胞的灌注法培养,用于高密度培养细胞的有氧的多层器件。Vozzi
等人[21b]应用生物可降解的聚乳酸-乙交酯(poly(DL-lactide-co-glycolide),PGLA)材料制造出一种三维多层的自组装支架用于生物组织工程研究中。Gu
W等人[22]应用多个可控制移动的压电引线精确控制弹性体毛细管网络内部液体的流动方法,应用该方法可在微流体芯片上划分和维持C2C12鼠成肌细胞的增殖与分化(如图3所示)。
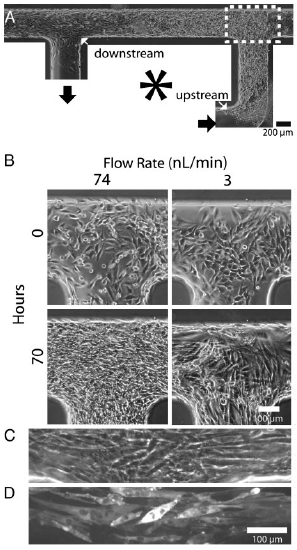
图3
Fig.3 On-chip cell culture. (A) A typical cell culture loop at a flow rate of 15nl/min. (B) C2C12 cells cultured in channels circulated with cell culture media at different flow rates. (C) Phase-contrast images of muscle differentiated and undifferentiated cells aligned in the movement of flow. (D) Fluorescent micrograph of the same differentiated cells stained for the myosin heavy chain. Positive staining and multinucleated cells indicated differentiation.
3 细胞固定和培养技术的应用
基板在各种组织中均扮演着重要角色,在肾小球中基板从足细胞中分离内皮细胞,并且是一个连接血浆细胞的半透膜;在皮肤表面基板是从皮下结缔体素分离细胞的一个障碍物。虽然固定多孔的海绵、泡沫和模具可用于构造胞外三维矩阵的类似物,但仅限用于制造基板。一种微构造方法可用于制造具有复杂拓扑结构特征的基板类似物[23],这种背脊和孔道的试验样品与天然基板中发现的肠套叠很类似,可以通过激光刻蚀聚酰亚胺掩膜芯片而得到;负性复制芯片用PDMS制成,这些复制品用来作为胶原或凝胶的薄膜产品(21mm)的模板,而这些结构独特的基板类似物很可能有助于解释拓扑结构对上皮细胞增殖与分化的影响。
3.2 血管组织
人工组织在体外没有血液维持系统,而限制人工组织尺寸大小的一个主要问题是氧气在很短距离内就已经耗散,并没有被组织利用。移植体内后,人工组织的细胞会在几小时内耗尽有限的氧气,但是传递氧气和营养物质的新生血管则需要数天的生长时间。最近已制造出一种新的微流体网络,其可用于形成高度统一的可模仿大尺度生理性质(例如总流速)的流动模式,其模仿效果与模仿小尺度现象类似,例如毛细管液体速率。近似于目标器官血液流动行为的液体动力学模型可作为光刻掩膜的基础;这些掩膜可以用来模仿血管网络。聚合物薄膜在铸模里浇铸,并被集成用于形成厚的三维支架,支架可用于细胞培养扩增。目前使用以聚乙烯和聚乙醇酸的共聚物为基材的非降解性生物相容性模板或者可降解生物模板,进行细胞培养实验研究,结果表明上皮细胞在微流体孔道里得到成功的吸附与扩增,并可构建较为完整的三维结构,其中包含完整器官所要求的血管体积和细胞密度[24]。Sadhana S等人[25]应用微流体固定技术,以人脐带静脉内皮细胞作为模型系统构建细胞间质体系,并研究了聚乙二醇(PEG)薄层维持三维细胞图案完整性的效率。实验结果表明,与可控硅底物相比,结合PEG的底物改进了细胞图案的完整性,对构建血管组织工程具有一定的参考价值(如图4所示)。
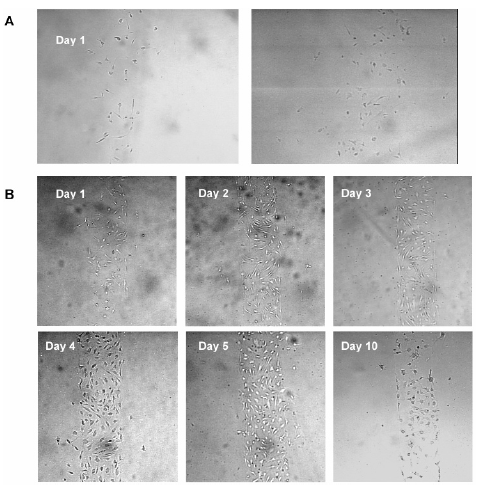
图4 A 硅片:培养1-2天的细胞。 B.与PEG结合的硅片:培养1-5天和10天的细胞图。经过10天培养,由于在孔道内过分聚集导致细胞凋亡
[25]。Fig.4 (A) Control silicon: pictures of cells cultured for 1-2 days. After 3 days, we had to take two frames to add images up to get the compliance multifactor; (B) PEG conjugated silicon: pictures of cells cultured for 1-5 days and day 10. After 10-day culture, cells apoptosized due to the overconfluency in the channel area.
3.3 肝脏
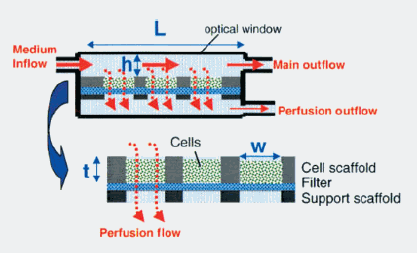
图5 支架和反应器示意图:孔道宽300mm;支架厚235mm;上部反应槽高度805mm(大反应器),725mm(小反应器),流动孔道长400mm[28]。
Fig.5 Schematic of scaffold and reactor housing. Dimensions: channel width (w)=300mm;scaffold thickness(t)=235mm;height of upper reactor chamber (h)=805mm(macroreactor), 725mm(millireactor), length of flow path from first to last channel(L)=400mm.
3.4骨头
3.5软骨组织
在组织工程领域对支持关节软骨组织再生的底物进行了大量研究。在新软骨组织中,特别是基于细胞的工程,维持软骨基因的显型非常重要。在含有大量软骨细胞的单细胞层和生物反应器中,同细胞悬浮培养液中一样,细胞分化通常通过限制细胞散布实现[30]。微图案修饰技术也可用于构造支架,特别适用于设计支持软骨形成的支架。一种微图案修饰的多孔多聚糖支架已被用于促进高密度软骨细胞培养、粘连和生物合成;其支架形态和产生胶原质Ⅱ的能力,适用于这些支架的细胞并可维持软骨细胞显型[31]。
3.6神经细胞
在细胞生物传感器到组织工程的应用发展中,控制神经细胞定位和生长起着重要作用。应用微电极阵列记录体外神经细胞的胞间信号很广泛,这些设备使用玻璃或者硅作为底物,用金、铂或铟锡氧化物制成的电极构造在底物上。使用这种系统,可以记录从生物产电物质的多位点产生的瞬间信号[32]。只有当一个神经细胞直接位于电极上方时,才能产生用于信号记录的细胞和电极间充分电耦合。为了操作神经细胞生长,可以应用光蚀刻技术在设备底物表面产生定向结构(拓扑结构或化学结构)[33]。最近发明了一种微流体制作的多孔神经细胞培养设备,可以应用于神经系统的科学研究[33]。与标准培养方法和操作不同神经微环境的其他传统方法相比,利用微图案技术指导神经附属位点和神经突增长倾向的能力,在培养区与流体分离区域结合,显示出巨大优越性。Leclerca E 等人[34]应用聚酰亚胺修饰的平面玻璃底物表面上吸附固定上PC12细胞,并通过控制微孔道的宽度,从而控制神经突生长方向和神经元的生长结构(如图6所示)。
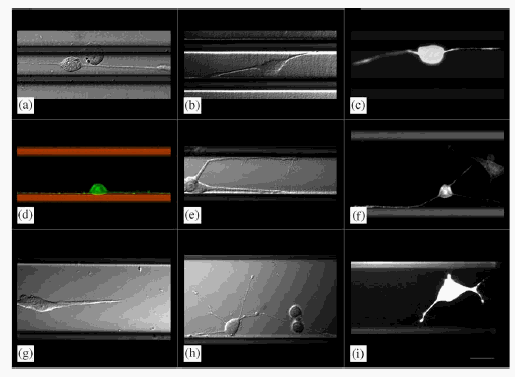
图6 PC12细胞神经突在微孔道中生长
[34]。在含有神经生长因子的培养基中培养3天,细胞被绿色细胞示踪物标记。神经突直接用DIC(a,b,e,g,h)或者荧光显微镜(c,d,f,I)获得。神经突在下列宽度的微孔道中增长的典型照片:20mm(a),30mm(b,c),40mm(d,e),50mm(f,g,I)和60mm(h)。比例尺代表20mm。Fig.6 PC12 cell neurite growth in microchannels. After 3 days of culture in NGF containing medium, cells were labeled with CellTracker Green. Neurites were directly imaged using DIC (a, b, e, g, h) or fluorescence microscopy (c, d, f, i). Representative images of neurite growth in microchannels with the following widths: 20 mm (a), 30 mm (b,c), 40 mm (d, e), 50 mm (f, g, i), and 60 mm (h). The scale bar represents 20 mm.
3.7活性物质的定位传递
微型人造器官可精确传递化学介质进入组织指定区域甚至细胞内部。用于传递的硅微探针和微注射针阵列可用各向同异性法构造
从上述的综述中可以看出,微流体技术在组织工程领域的应用取得很大的进展,特别是在血管、骨头和软骨组织等方面已得到许多产品,如表1[38]。 表1 部分组织工程产品及培养周期
Table 1 Stages of development in selected examples of tissue engineering
组织 |
人工合成组织 |
培养阶段 |
影响试剂 |
血管 [39] |
人类表皮微脉管内皮 用三维胶原质矩阵从胚胎干细胞获得FLK1+细胞 用三维胶原、纤维原矩阵获得的BCL-2人类脐带血管内皮细胞 |
分散细胞(1天);形成管状结构(5天);形成功能性微脉管(7天) 凝聚(0天);细胞排列(3天);多细胞构成管状结构(5天)
细胞有序进管(1天);血管结构和复杂多细胞墙形成(31-60天) |
-
VEGF
- |
骨头 [40] |
在PLA-dx-PEG共聚物矩阵的 rhBMP2 TGF-b 1条件下培养的骨质细胞 |
2mm骨缺陷修复(2-4周)
|
TGF-b 1 rhBMP2 |
软骨 [41] |
纤维蛋白矩阵中培养的自由的和脂质体包装的TGF-b 1 |
间叶细胞移植入矩阵(数天);细胞分化形成成熟软骨细胞(数周) |
TGF-b 1 |
外围神经 [42] |
使用生物活性多肽的纤维蛋白矩阵 |
神经轴突再生 |
- |
中央神经系统组织 [43] |
脑细胞聚集物分散的PLGA微球 |
神经生长因子在组织中释放和积累(几小时在-几天);分化(数天) |
NGF |
胸腺器官 [44] |
在涂有钽层的三维碳矩阵中培养的胸腺基质细胞 |
矩阵上基质层有序排列(14天);与血红素细胞联合培养以产生T细胞(14天) |
TGF-b 1 |
表中:BCL-2,B-细胞淋巴瘤-2蛋白;rhBMP2,重组人类骨成形素蛋白2;FLK1+,细胞表达FLK1(VEGF受体之一);PLGA,聚(丙交酯-co-乙二醇);PLLA,聚L型乳酸;TGF-b 1,转换生长因子-b 1;VEGF,血管内皮生长因子。
4 结论及展望
[1] Langer R, Vacanti J. Science, 1993, 260: 920-926.
[2] Hubell J. Curr Opin Biotechnol. 1999, 10: 123-129.
[3] Marler J, Upton J, Langer R et al. Adv Drug Delivery Rev, 1998, 33: 165-182.
[4] (a) Manz A, Graber N, Widmer H M et al. Sens. Actuators, B, Chem., 1990, 1: 244; (b) Manz A, Fettinger J C, Verpoorte E et al. Trends Anal. Chem., 1991, 10: 144.
[5] Fang Z L. Microfluidic chips for analytical chemistry. Beijing: Science Publication Co., 2003.
[6] (a) Folch A, Ayon A, Hurtado O et al. J Biomech. Eng., 1999, 121:28-34 (b) Folch A, Toner M. Biotechnol Prog, 1998, 14: 388-392.
[7] (a) Takayama S, McDonald J, Ostuni E et al. Proc Natl Acad Sci USA, 1999, 96: 5545-5548 (b) Takayama S, Ostuni E, Qian X, et al. Adv. Mater., 2001, 13: 570-574.
[8] Takayama S, Ostuni E, LeDuc, et al. Nature, 2001, 411: 1016.
[9] Feng X Z, Haswell S J, Watts P. Current topics in medicinal chemistry, 2004, 4 (7): 707-727.
[10] Chiu D T, Jeon N L, Huang S, et al. Proc Natl Acad Sci, 2000, 97: 2408-2413.
[11] Singhvi R, Stephanopoulos G, Wang D. 1994, 43: 764-771.
[12] Desai T. Med Eng Phys, 2000, 22: 595-606.
[13] Deutsch J, Motlagh D, Russell B. J Biomed Mater Res., 2000: 53-57.
[14] Braber E D, Ruijter J, Ginsel L et al. J Biomed Mater Res, 1998, 40 (2): 291-300.
[15] Kooten T V, Whitesides J, Recum A. J Biomed Mater Res.: 1998, 43: 1-14.
[16] Singhvi R, Kumar A, Lopez G et al. Science, 1994, 264: 696-698.
[17] Kapur R, Calvert J, Rudolph A. J Biomech Eng, 1999, 121: 65-72.
[18] (a) Flemming R, Murphy C, Abrams G. Biomaterials, 1999, 20 (6): 573-588 (b) Dalby M, Riehle M, Yarwood S et al. Exp Cell Res, 2003, 284: 274-282.
[19] Grodzinsky A, Levenston M, Jin E et al. Annu Rev Biomed Eng, 2000, 2: 691.
[20] (a) Leclerc E, Sakai Y, Fujii T. MicroTAS, 2002: 826-827 (b) Vozzi G, Flaim C, Ahluwalia A et al. Biomaterials, 2003, 24: 2533-2540.
[21] Andersson H, van den Berg A. Sens Actuators B, 2003, 92 (3): 315-325.
[22] Gu W, Zhu X Y, Futai N et al. PNAS, 2004, 101 (45): 15861–15866.
[23] (a) Leclerc E, Sakai Y, Fujii T. Transducers, 2003: 415-418 (b) Vozzi G, Flaim C, Ahluwalia A, et al. Biomaterials, 2003, 24: 2533-2540.
[24] Pins G, Toner M, Morgan J. FASEB, 2000, 14: 593-602.
[25] Sharma S, Tan W, Tejal A et al. Bioconjugate Chem., 2005, 16 (1):18-22.
[26] Borenstein J, Terai H, King K et al. Biomed Microdev., 2002, 4 (3): 167-175.
[27] LeCluyse E, Bullock P, Parkinson A. Adv Drug Delivery Rev., 1996, 22:133-186.
[28] (a) Tilles A, Berthiaume F, Yarmush M. J Hepatobiliary Pancreat Surg, 2002, 9: 686-696 (b) Bathia S, Balis U, Yarmush M et al. Biotechnol Prog., 1998, 14: 378-387; (c) Powers M, Domansky K, Kaazempur-Mofrad M. Biotech Bioeng, 2002, 78 (3): 257-269.
[29] Holy C, Fialkov J, Davies J et al. J Biomed Mater Res., 2003, 65A (4):447-453.
[30] Petersen E, Fishbein K, McFarland A et al. Magn Reson Med, 2000, 44: 367-372; (b) Potter K, Butler J, Horton W et al. Arthritis Rheum, 2000, 43: 1580-1590 (c) Freed L, Martin I, Vunjak-Novakovic G, Clin Orthop, 1999, 367: 46-58.
[31] Petersen E, Spencer R, McFarland E. Biotech Bioeng, 2002, 78(7): 802-805.
[32] Bove M, Martinoia S, Verreschi G. Biosens Bioelectron, 1998, 13: 601-612 (b) Egert U, Schlosshauser B, Fennrich S et al. Brain Res., 1998, 2: 229-242; (c) Thiebaud P, Beuret C, Koudelka-Hep M et al. Biosens Bioelectron, 1999, 14: 61-65 (d) Sprösser C, Denyer M, Britland S et al. Phys Rev, 1999, E60: 2171-2176.
[33] Taylor A, Rhee S, Tu C et al. Langmuir, 2003, 19: 1551-1556; (b) Kleinfeld D, Kahler K Hockberger P. J Neurosci, 1988, 11:4098-4120; (c) Oliva A, James C, Kingman C. et al. Neurochem Res, 2003, 11: 1639-1648.
[34] Leclerca E, Furukawab K.S, Miyatab F et al. Biomaterials, 2004, 25: 4683-4690.
[35] McAllister D V, Allen M G, Prausnitz M R. Annu Rev Biomed Eng, 2000, 2: 289-313.
[36] Chun K, Hashiguchi G, Toshiyoshi H et al. J Appl Phys, 1999, 38: 279-281.
[37] Chen J, Wise K D. IEEE Trans Biomed Eng, 1997, 44: 760-769.
[38] Saltzman W M, Olbricht W. Nat Reviews, 2002, 1: 177-186.
[39] (a) Nor J. E., Peters M C, Christensen J B et al. Lab. Invest, 2001, 81:453-463;(b)Yamashita J, ITOH H, HIRASHIMA M et al. Nature,2000, 408: 92-96; (c) Schechner J S, Nath A K, Zheng L et al. PNAS,2000, 97: 9191-9196.
[40] (a) Saito N, Okada T , Horiuchi H et al. Nature Biotechnol, 2001, 19: 332-335; (b) Kale S., Biermann S, Edwards C et al. Nature Biotechnol, 2000, 18: 954-958.
[41] Hunziker E B. Osteoarthritis Cartilage, 2001, 9: 22-32.
[42] Schense J C, Bloch J, Aebischer P et al. Nature Biotechnol, 2000, 18: 415-419.
[43] Mahoney M J, Saltzman W M. Nature Biotechnol, 2001, 19: 934-939.
[44] Poznansky M C, Evans R H , Foxall R B et al. Nature Biotechnol, 2000, 18: 729-734.
[45] Andersson H, Van den Berg A. Lab Chip, 2004, 4: 98-103.
[46] Grikscheit T, Ochoa E, Ramsanahie A et al. Ann Surg, 2003, 238, 35-41.