http://www.chemistrymag.org/cji/2005/079060pc.htm |
Sep. 22, 2005 Vol.7 No.9 P.60 Copyright |
Application of magnetic-assisted Fenton reagent for treatment of reactive red dye simulated wastewater
Lu Xiuguo, Zhai Jian, Liu Fang(College of Chemistry and Environmental Science, HeBei University, Baoding 071002 , China)
Abstract The
treatment of reactive red dye simulated wastewater by magnetic-assisted catalytically
oxidation system has been studied under different magnetic-assisted reaction time,
intensity of magnetic field and the optimum dosage of catalytically oxidation system. The
results showed that the removed rate of CODCr reached 62.5% under pH value
being 3, the dosage of FeSO4·7H2O being 500mg, the volume of
H2O2 being 0.4mL, reaction time being 20min.Comparatively, intensity
of magnetic field was 427.8mT and magnetic-assisted reaction time was 20min, the removed
rate of CODCr was 8.3% better than without magnetic field.
Keywords Fenton reagent,
catalytically oxidation, magnetic field, reactive red dye
磁助Fenton试剂处理活性红模拟染料废水的实验研究
(河北大学化学与环境科学学院环境科学系 河北保定 071002)
2005年8月24日收稿
摘要 研究不同磁化时间、磁场强度和催化氧化各种影响因素下对活性红染料模拟废水的去除率。结果表明:在
pH值=3,FeSO4·7H2O=500mg,H2O2 =0.4mL条件下, 反应20min,去除率达62.5%。外加磁场磁场强度为427.8mT的作用下,磁化反应20min,CODCr的去除率提高了8.3%。关键词 Fenton 试剂;催化氧化;磁场;活性红染料 1 引言
光、电、磁是物理学中的三大研究领域。现在以UV/Fenton体系的光Fenton试剂已经有了诸多的报道,并在实际生产中开始应用。以铁碳微电解技术为基础的电Fenton试剂,凭借其适用范围广,成本低廉逐渐引起人们的重视。而磁场用于强化水中污染物的高级氧化反应的研究,如磁助Fenton试剂处理有机废水则尚未见报导。
磁场对自由基有明显反应很早就被发现,磁助Fenton试剂体系以自由基反应为主,因此推测磁场/ Fenton试剂体系联用技术亦可提高污染物的氧化分解速率,而且无需像超声和紫外光一样额外消耗电能(可由永久磁铁产生磁场),便于推广使用。 2 实验部分
2.1仪器与试剂
磁力搅拌器(山东甄城新华仪器厂)、测定CODCr用仪器与试剂(重铬酸钾法)、30%的H2O2(分析纯)、FeSO4·7H2O(分析纯)、KC-70C型永磁磁化器(上海杰灵磁性器材有限公司)、SXG-1B特斯拉仪(上大电子设备有限公司)、UV-265紫外可见分光光度计(日本岛津)
2.2模拟废水水质
取500mg活性红染料溶于1000mL蒸馏水中,配成染料模拟废水。
表1 原废水的水质
Table 1 The quality of raw wastewater
浓度( mg·L-1) |
色度(倍) |
CODCr(mg·L-1) |
pH值 |
500 |
3200 |
380 |
4~5 |
2.3实验方法
将盛有100mL水样的烧杯放置磁力搅拌器上,调节溶液的pH值,加入一定量的FeSO4·7H2O,再加入一定量的H2O2,反应一段时间,调节溶液的pH值,使亚铁离子全部转化成氢氧化铁沉淀,过滤,测定滤液的CODCr。
磁化实验是将磁场加入到上述实验过程中,考察其对·OH产率、产生速率的影响。实验步骤同上,区别在于盛有水样的烧杯被夹置在磁场中。
2.4分析方法
CODCr采用重铬酸钾法测定,依据下式计算CODCr去除率:
![]()
式中:CODCr0,CODCr分别表示处理前后染料废水的化学好氧量。
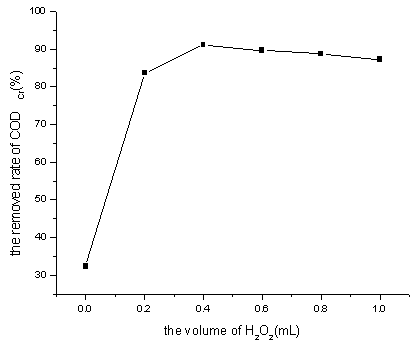
图1 H2O2投加量对CODCr去除率的影响
Fig. 1 Effect of H2O2 dosage on
CODCr removal
3 结果与讨论
3.1 普通Fenton试剂处理废水各种影响因素
3.1.1 H2O2投加量的影响
在pH值3条件下,投加FeSO4·7H2O,使其浓度为500
mg·L-1,反应时间t=90min,测定不同H2O2投加量反应终了时水样的CODCr。
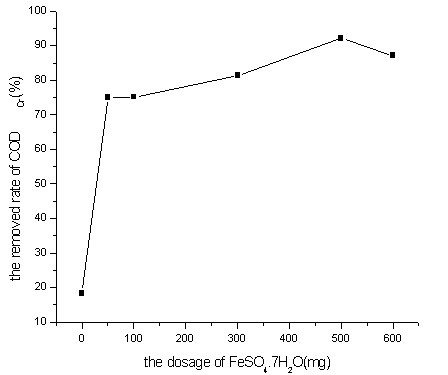
图2 FeSO4·7H2O投加量对CODCr去除率的影响
Fig. 2 Effect of FeSO4·7H2O dosage on CODCr removal
从图1可以看出,H2O2 =0.4mL时CODCr的去除率达到91.2%。H2O2量逐渐增高,CODCr去除率反而有下降的趋势,这是因为在H2O2的浓度较低时,H2O2的浓度增加, 产生的·OH量增加;当H2O2的浓度超过一定浓度时, H2O2在反应一开始就把Fe2+迅速氧化为Fe3+,而使反应在Fe3+的催化下进行,这样既消耗了H2O2又抑制了·OH的产生,并且过量的H2O2其还原性从一定程度上增加了出水中的CODCr值[1]。综合考虑,选择H2O2 =0.4mL较为理想。
3.1.2 FeSO4·7H2O投加量的影响
在pH=3, H2O2 =0.4mL,t=90min时,测定不同FeSO4·7H2O投加量反应终了时水样的CODCr。
当无Fe2+条件下,H2O2难以分解产生羟基自由基;当Fe2+的浓度过低时,羟基自由基的产生量和产生速度都很小,降解过程受到抑制;当Fe2+过量时,它还原H2O2且自身氧化为Fe3+,消耗药剂的同时增加出水色度[1]。从图2可以看出,当FeSO4·7H2O = 500mg时, CODCr的去除率分别达到92.2%。FeSO4·7H2O值逐渐增高,CODCr去除率反而降低了,这是因为过量的亚铁离子消耗了重铬酸钾,使CODCr升高的结果。综合考虑,选择FeSO4·7H2O =500mg较为理想。
3.1.3反应时间的影响
在pH值3条件下,H2O2 =0.4mL,FeSO4·7H2O =500mg,测定不同反应时间水样的CODCr。
从图3可以看出,反应时间t=90min时CODCr的去除率达到92.2%。反应时间t=60min时,CODCr去除率可达到88.2%,但从实际工程和经济角度考虑,选择反应时间t=60min较为理想。
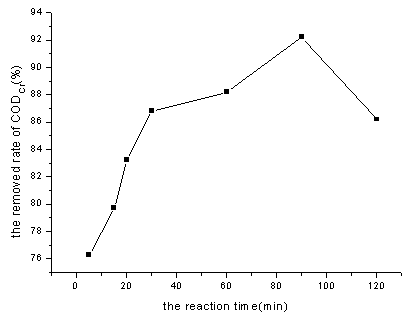
图3 反应时间对CODCr去除率的影响
Fig. 3 Effect of time on CODCr removal
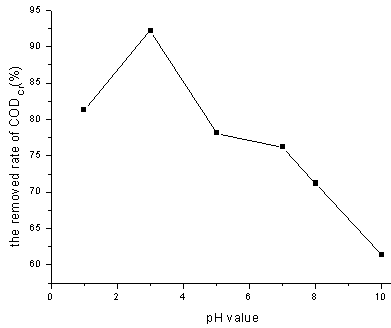
图4 pH值对CODCr去除率的影响
Fig. 4 Effect of pH on CODCr removal
3.1.4水样pH值的影响
当H2O2 =0.4mL,FeSO4·7H2O =500mg,反应时间t=60min时,则不同pH值对水样CODCr去除率的影响见图4。
Fenton试剂是在酸性条件下发生作用的,在中性和碱性的环境中,Fe2+不能催化H2O2产生·OH,而是生成了Fe(OH)2、Fe(OH)3胶体,该胶体可以吸附部分有机物,从而使溶液的CODCr得到部分去除。但从图4看,其去除效果远不如在酸性的条件下。当pH值低于3时,溶液中的H+浓度过高,反应Fe3+ + H2O2 → Fe2+ + HO2·+H+受到抑制,Fe(Ⅲ)不能顺利地被还原为Fe(Ⅱ),从而影响Fenton试剂的氧化能力[1]。从图4可以看出CODCr的去除率在pH=3条件下最高,随着pH值的升高CODCr去除率显著下降。因此,选择pH=3的反应条件最为理想。
3.2磁化实验
3.2.1磁化时间对CODCr去除效率的影响
在pH=3, H2O2 =0.4mL,FeSO4·7H2O =500mg,磁场强度=427.8mT时,测定不同磁化时间反应终了时水样的CODCr。
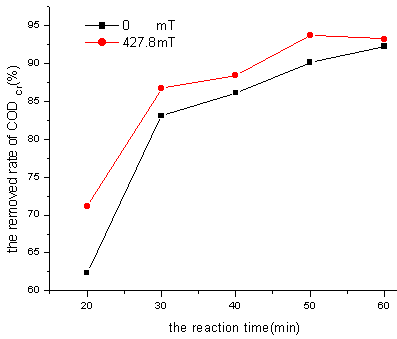
图5 外加磁场条件下CODCr去除率随反应时间变化情况
Fig.5 Effect of magnetic-assistant reaction time on CODCr removal
由图5可以看出,在磁场强度为427.8mT时比不加磁场的在相同的磁化时间内CODCr去除率相应的要高,但随着磁化时间的增加,CODCr的去除率有趋于一致的形式,这说明,外加磁场提高了·OH的产生速率,但是没有提高其产率。
3.2.2磁场强度对CODCr去除效率的影响
在pH=3, H2O2 =0.4mL,FeSO4·7H2O
=500mg时,改变磁场强度,测定不同磁场强度下水样的CODCr。
由图6可以看出,在不同的磁化时间下,CODCr去除率随着磁场强度的增加而增加。但是随着磁化时间的增加,不同磁场条件下的CODCr去除率趋于一致。结果表明,随着磁场强度的增加从Fenton试剂中产生·OH的速率随之增加,但是产率并没有变化。
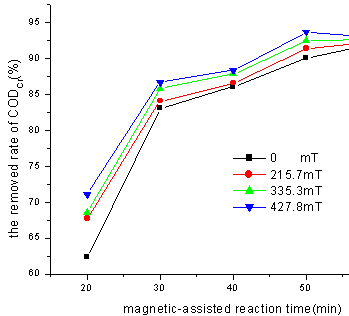
图6 外加磁场强度变化对CODCr去除率的影响
Fig. 6 Effect of intensity of magnetic field on
CODCr removal
3.3磁强化 Fenton试剂氧化反应机理初探
Fe2+与H2O2间反应很快,生成氧化能力很强的·OH自由基。有三价铁共存时,
Fe3+与H2O2反应缓慢地生成Fe2+,接着Fe2+再与H2O2迅速反应,生成·OH,反应中激发出的羟基自由基(·OH)氧化能力很强,·OH的氧化电场是2.8V,仅次于氟的3.0V因而能有效地分解难生物降解的有机物(RH):
RH +·OH → H2O + R·
R·+ H2O2 → ROH + ·OH
·OH可以很容易氧化活性红染料分子,这主要是因为羟基自由基与其反应时,先脱去磺酸基,生成羟基取代物,使芳香环活化,再进行氧化分解,生成低级有机酸类物质,最终炭化生成CO2
+ H2O[2]。磁场可以改变水的诸多性质,且磁场对自由基反应最为明显。该催化氧化反应实质就是产生·OH,可以推测磁场能够提高·OH的产生速率或生成率。
自由基的重结合只能发生在单重态自由基对之间。自由基对的单重态向三重态的转化可以的防止自由基的重结合。在外加磁场作用下,自由基对的自旋矢量的拉莫尔(Larmor)旋进速度会发生变化。两个自旋矢量的旋进速度之差(Dw)可下式表示:
![]()
式中,Dg=|g1-g2|,g1与g2是两个自由基独电子的g值,与体系本性相关,mB是玻尔磁子,h是普朗克常数,Ho是外磁场强度,a1、a2是两个自由基的超精细耦
合常数,I是核自旋量子数。Dw值的大小可决定自由基对两个自旋矢量的
S态(单重态)向To态(三重态)转变的速度。按上面公式,上述转变速度会随Dg的增大Ho的增大而提高[3]。对活性红染料模拟废水而言,微观结构的Dg为定值,因此拉莫尔旋进速度之差Dw的值仅取决于宏观外加磁场场强的大小。按
照上式,Ho越大, Dw就越大,S态与To态之间转化的时间越短,S态向To态转变的速度也就越快,即单重态的总数就越少,发生重结合的可能性就越小,化学反应速度就越快。即磁场强度越大从Fenton试剂中产生·OH的速率也越快。
在该反应在最后调解溶液pH值使之达到碱性,这时就会有Fe(OH)2、Fe(OH)3胶体产生。这些胶体可以吸附部分有机物,进一步去除水溶液的CODCr。以上就是磁助Fenton试剂氧化降解去除有机物过程的机理。
4 结论
4.1 实验处理前后水样指标
表2 实验处理前后水的指标
Table2 Index of sample before and
after treatment
指标 |
CODCr(mg·L-1) |
pH |
原液 |
380 |
4~5 |
4.2 处理前后水样紫外-可见光谱图比较
未处理前,水样在紫外可见区有明显的吸收峰。磁强化氧化处理后,可见光区几乎没有吸收峰,说明发色基团已被完全破坏。
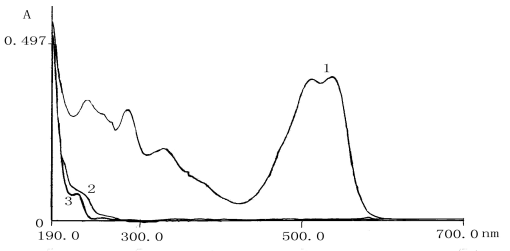 |
|
| 图7 处理前后水样紫外可见谱图 1-处理前,水样紫外可见光谱图;2-未经磁化,氧化处理后水样紫外可见光谱图; 3-经磁化,氧化处理后水样紫外可见光谱图 Fig7 Sample ultraviolet visible spectrum before and after treatment |
4.3 实验结论
(1)在pH值=3,FeSO4·7H2O=500mg,H2O2
=0.4mL,外加磁场磁场强度为427.8mT的作用下,磁化反应20min,CODCr的去除率提高了8.3%。
(2)外加磁场提高了Fenton 试剂体系中·OH的产生速率,但是没有提高其产率。
[1]ChenChH,XieB,RenY. Environmental Science,2000, 5: 93-96.
[2]ZhuWP,YangZhH,Wang.L China Environmental Science,1995,15 (5): 368-372
[3]WangGQ,WuZhY. Magnetochemistry and Magnetomedicine. BeiJing: GongYe BingQi Press,1997,21-23.