http://www.chemistrymag.org/cji/2005/07b073rc.htm |
Nov. 10, 2005 Vol.7 No.11 P.73 Copyright |
Structure and properties of room
temperature ionic liquids
Zhang Qingshan, Zhao Junbo, Guo Bingnan,
Wu Feng
(School of Chemical
Engineering and Environment, Beijing Institute of Technology, Beijing ,100081)
Abstract As a
new novel media for chemical reaction, room temperature ionic liquids are recognized and
accepted, because of many novel properties which are shown on RTILs. The structure of
ionic liquids directly impacts properties. Relation between RTILs' structure and constituent and the properties (melting point,
solubility and viscosity) is simply summarized in this paper, on the basic of the study of
the progress of RTILs in the world. We hope that this will help the research and
application of RTILs.
Keywords RTILs, Structure, Melting point, Solubility,
Viscosity
张青山,
赵君波, 郭炳南,吴锋
(北京理工大学化工与环境学院 北京 100081)
2005年10月18日收稿;国家重点基础研究发展规划“九七三”计划项目
(批号:2002CB211800)资助。摘要
离子液体作为一种新型的反应介质,正在受到越来越多的重视,这都是因为离子液体具有很多其他材料无可比拟的优良性质。离子液体的结构和组成直接影响它的性质,本文在对离子液体的研究现状综合分析的基础上,
对离子液体的结构组成和其基本性质之间的关系进行了探讨,希望有助于以后离子液体的研究和应用。
关键词 离子液体 结构 熔点 溶解性 粘度
离子液体(Ionic Liquids),顾名思义就是液体中只有离子存在。通常盐类化合物在熔融状态时就表现为离子液体状态,例如熔融的氯化钠,但它们在高温下才是离子液体。然而,通过选择合适材料可控制在室温下形成离子液体,这就是目前人们所说的室温离子液体(Room
Temperature Ionic Liquids),又称为室温熔融盐、有机离子液体等,一般简称为RTILs。
20世纪初,科学家就在研究离子液体,但当时没有引起人们的广泛兴趣。最早发现离子液体,是在1914年发现硝酸乙基铵([EtNH3]NO3),它的的熔点只有12
Table1 Melting points of some ionic liquids in this text
RTILs |
熔点(℃) |
参考 |
RTILs |
熔点(℃) |
参考 |
| [BMIm]Cl | 41 |
36 |
[DMIm][AlCl4] | 125 |
40 |
| [DMIm]Cl | 125 |
36 |
[EMIm][AlCl4] | 84 |
40 |
| [EMIm]Cl | 87 |
36 |
[PMIm][AlCl4] | 60 |
40 |
| [C6MIm]Cl | RT |
36 |
[BMIm][AlCl4] | 65 |
40 |
| [C8MIm]Cl | RT |
36 |
[BBIm][AlCl4] | 55 |
40 |
| [PhP(EIm)2]Cl2 | RT |
- |
[HMIm][BF4] | 52.4 |
52 |
| [PhP(EIm)2]Br2 | RT |
- |
[DMIm][BF4] | 103.4 |
52 |
| [l-EHPIm]Br | 5-6 |
- |
[EMIm][BF4] | 5.8 |
52 |
| [l-EHMBIm]Br | 11-12 |
- |
[PMIm][BF4] | -13.9 |
52 |
| [l-EHMPIm]Br | 15-16 |
- |
[BMIm][BF4] | -81 |
52 |
| [EMIm]Br | 76.5 |
58 |
[C5MIm][BF4] | -87.5 |
52 |
| [BM2Im]Br | <100 |
58 |
[C6MIm][BF4] | -82.4 |
52 |
| [BMIm]I | -72 |
36 |
[C7MIm][BF4] | -80.4 |
52 |
| [EMIm][PF6] | 62 |
41 |
[C8MIm][BF4] | -78.5 |
52 |
| [C3MIm][PF6] | 40 |
35 |
[C9MIm][BF4] | -77.2 |
52 |
| [i-C3MIm][PF6] | 102 |
37 |
[C10MIm][BF4] | -4.2 |
52 |
| [BMIm][PF6] | 10 |
36 |
[C11MIm][BF4] | 21.4 |
52 |
| [C6MIm][PF6] | -61 |
39 |
[C12MIm][BF4] | 26.4 |
52 |
| [MAMP][PF6] | 85.1 |
43 |
[C13MIm][BF4] | 49.1 |
52 |
| [MMZ][PF6] | <RT |
44 |
[C14MIm][BF4] | 42.4 |
52 |
| [EMZ][PF6] | <RT |
44 |
[C15MIm][BF4] | 55.5 |
52 |
| [BMZ][PF6] | <RT |
44 |
[C16MIm][BF4] | 49.6 |
52 |
| [CFMZ][PF6] | <RT |
44 |
[C18MIm][BF4] | 66.8 |
52 |
| [HexPyr][PF6] | 38.7 |
45 |
[EPEIm][BF4] | 90 |
53 |
| [CPE][PF6] | 63 |
46 |
[MPe][BF4] | 17.1 |
53 |
| [CME][PF6] | 79 |
46 |
[EPIe][BF4] | 29.8 |
53 |
| [11TS1Br][PF6] | 82-83 |
47 |
[DMIe][BF4] | 24.5 |
53 |
| [21TS1Br][PF6] | 72-73 |
47 |
[2,4-Le][BF4] | 34.1 |
53 |
| [31TS1Br][PF6] | RT |
47 |
[2,3-Le][BF4] | 59.4 |
53 |
| [13TS1Cl][PF6] | RT |
47 |
[3,4-Le][BF4] | 45.9 |
53 |
| [23TS1Cl][PF6] | RT |
47 |
[2,6-Le][BF4] | 104.6 |
53 |
| [11TS2][PF6] | RT |
47 |
[DMCHAe][BF4] | 89.0 |
53 |
| [21TS2][PF6] | RT |
47 |
[DMCHMAe][BF4] | 143.8 |
53 |
| [31TS2][PF6] | RT |
47 |
[MPE][BF4] | -5.9 |
53 |
| [13TS2][PF6] | RT |
47 |
[MBIm][BF4] | 99.9 |
53 |
| [23TS2][PF6] | RT |
47 |
[MIn][BF4] | 131.0 |
53 |
| [OM1][PF6] | 132(decomp) |
48 |
[EPP][BF4] | -27.9 |
53 |
| [OM2][PF6] | 75-77 |
48 |
[MPyr][BF4] | -31.9 |
53 |
| [DPEBIm][PF6] | -55.7 |
49 |
[MAMP][BF4] | 39 |
43 |
| [DPEHIm][PF6] | -68.8 |
49 |
[Ph2PEMPy][BF4] | RT |
42 |
| [DPEOIm][PF6] | -73.2 |
49 |
[11TS1Br][BF4] | RT |
47 |
| [DPPBIm][PF6] | -58.7 |
49 |
[21TS1Br][BF4] | RT |
47 |
| [DPPHIm][PF6] | -67.3 |
49 |
[31TS1Br][BF4] | RT |
47 |
| [DPPOIm][PF6] | -96.1 |
49 |
[13TS1Cl][BF4] | RT |
47 |
| [C6][PF6] | <0 |
50 |
[23TS1Cl][BF4] | RT |
47 |
| [TSIL1][PF6] | -12.8 |
51 |
[11TS2][BF4] | RT |
47 |
| [TSIL2][PF6] | -18.7 |
51 |
[21TS2][BF4] | RT |
47 |
| [TSIL5][PF6] | 46.2 |
51 |
[31TS2][BF4] | RT |
47 |
| [TSIL6][PF6] | 64.5 |
51 |
[13TS2][BF4] | RT |
47 |
| [s-EPIPOm][PF6] | 63 |
- |
[23TS2][BF4] | RT |
47 |
| [s-EMIPOm][PF6] | 79 |
- |
[OM1][BF4] | 129 |
48 |
| [EMIm][NO2] | 55 |
41 |
[OM2][BF4] | 76(decomp) |
48 |
| [EMIm][NO3] | 38 |
40 |
[F-TEDA][BF4] | RT |
55 |
| [(C8H17)3MeN][BF4] | 58.8 |
45 |
[BDMIm][CB11H12] | 114 |
61 |
| [DPEBIm][BF4] | -80.5 |
49 |
[EMIm][CB11H6Cl6] | 129 |
61 |
| [DPEHIm][BF4] | -82.6 |
49 |
[OMIm][CB11H6Cl6] | 67 |
61 |
| [DPEOIm][BF4] | -79.8 |
49 |
[EDMIm][CB11H6Cl6] | 137 |
61 |
| [DPPBIm][BF4] | -64.3 |
49 |
[BDMIm][CB11H6Cl6] | 101 |
61 |
| [DPPHIm][BF4] | -75.5 |
49 |
[EMIm][CB11H6Br6] | 139 |
61 |
| [DPPOIm][BF4] | -64.5 |
49 |
[EMIm][1-CH3-CB11H11] | 59 |
61 |
| [EMIm][TfO] | 9 |
38 |
[EMIm][1-C2H5-CB11H11] | 64 |
61 |
| [C6][TfO] | 73 |
40 |
[EMIm][1-C3H7-CB11H11] | 45 |
61 |
| [EMIm][NfO] | 28 |
38 |
[EMIm][1-C4H9-CB11H11] | 49 |
61 |
| [EMIm][TA] | 14 |
38 |
[C4isoq][BETI] | -62.0 |
62 |
| [EMIm][CF3SO3] | -9 |
38 |
[C6isoq][BETI] | -77.3 |
62 |
| [BBSMIm][CF3SO3] | RT |
56 |
[C8isoq][BETI] | -68.1 |
62 |
| [MBSMIm][CF3SO3] | RT |
57 |
[C10isoq][BETI] | -59.3 |
62 |
| [EBSMIm][CF3SO3] | RT |
- |
[C12isoq][BETI] | -51.0 |
62 |
| [HBSMIm][CF3SO3] | RT |
- |
[C14isoq][BETI] | -49.7 |
62 |
| [EMIm][CF3CO2] | -14 |
- |
[C16isoq][BETI] | -48.6 |
62 |
| [EMIm][CH3CO2] | 45 |
41 |
[C18isoq][BETI] | -47.2 |
62 |
| [TMA][TFSI] | 130 |
68 |
[C4MIm]Sac | RT |
63 |
| [TEA][TFSI] | 105 |
68 |
[C5MIm]Sac | 64 |
63 |
| [TMPA][TFSI] | 19 |
68 |
[C6MIm]Sac | RT |
63 |
| [P11][TFSI] | 105 |
68 |
[C9MIm]Sac | RT |
63 |
| [EMIm][TFSI] | 4 |
38 |
[BDMIm]Sac | 70 |
63 |
| [DMIm][TFSI] | 26 |
67 |
[Me3N(CH2)2OC(O) (CH2)2CH3]Sac |
89 |
63 |
| [C4MIm][TFSI] | -3 |
67 |
[Pl(CH2)2OCH2CH3]Sac | RT |
63 |
| [C6MIm][TFSI] | -6 |
67 |
[n-Pr4N]Sac | 96 |
63 |
| [C6][TFSI] | 45 |
50 |
[MeEt3N]Sac | 26 |
63 |
| [BMPy][TFSI] | <RT | 58 | [C4MIm]Ace | RT | 63 |
| [MAMP][TFSI] | 47.8 |
43 |
[C6MIm]Ace | RT |
63 |
| [EMMP][TFSI] | 29.2 |
59 |
[C9MIm]Ace | RT |
63 |
| [BMMP][TFSI] | 28.7 |
59 |
[Me3N(CH2)2OC(O)(CH2)2CH3]Ace | 49 |
63 |
| [C2][TFSI] | 54 |
46 |
[n-Pr4N]Ace | 73 |
63 |
| [C3][TFSI] | -18 |
46 |
[MeEt3N]Ace | 54.9 |
63 |
| [N6222][TFSI] | 20 |
60 |
[ETMMIm][OTos] | 不确定(〈70) |
54 |
| [N6444][TFSI] | 26 |
60 |
[ETMMIm][AB] | 不确定(〈70) |
54 |
| [TMA][TSAC] | 64 |
68 |
[ETMMIm][OMes] | 不确定(〈70) |
54 |
| [TEA][TSAC] | 20 |
68 |
[ETMpy][AC] | 不确定(〈70) |
54 |
| [TMEA][TSAC] | 15 |
68 |
[ETMpy][AD] | 不确定(〈70) |
54 |
| [TMiPA][TSAC] | 21 |
68 |
[EMIm]2[NiCl4] | 92-93 |
64 |
| [TMPA][TSAC] | 10 |
68 |
[EMIm]2[CoCl4] | 100-102 |
64 |
| [TMAIA][TSAC] | -3.9 |
68 |
[BMIm][Co(CO)4] | 不确定(〈0) |
65 |
| [P11][TSAC] | 24 |
68 |
Co(MePEG-bpy)3·DNA | 不确定(〈0) |
66 |
| [EMI][TSAC] | -1.5 |
68 |
Co(MePEG-bpy)3(ClO4)2 | 不确定(〈0) |
66 |
| [EMIm][CB11H12] | 122 |
61 |
Fe(MePEG-bpy)3(ClO4)2 | 不确定(〈0) |
66 |
| [OMIm][CB11H12] | 70 |
61 |
MePEG-NEt3·DNA | 不确定(〈0) |
66 |
| [EDMIm][CB11H12] | 156 |
61 |
11TS= |
2,4-Le= |
BMPy= |
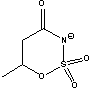
C10Im=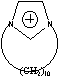 Cnisoq= Cnisoq=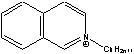 CME= CME=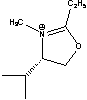 CPE= CPE=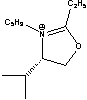 |
DMCHAe= |
EPIe= |
ETMpy= |
MAMP= |
MPe= |
MePEG-NEt3+= |
N6222=(n-C6H13)(C2H5)3N+
N6444=(n-C6H13)(n-C4H9)3N+
OM1= |
OM2=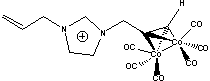 Pl= Pl= |
Ph2PEMPy=
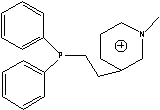 TEA= TEA= 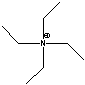 TMA=
TMA= |
| TMiPA= |
TSIL1= |
TSIL2= |
TSIL5= |
TSIL6= |
AB= |
OTos= |
BETI=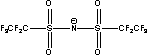 TFSI= TFSI=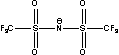 TSAC= TSAC= 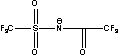 |
Figure 1 Structure of some of cations and anions for RTILs
众所周知,离子液体的典型性质受所选择的阳离子和阴离子的影响很大。为了开发离子液体的这种可调节性,了解影响比如熔点、极性和溶解性等特定性质的因素,是非常有必要的。
相关离子的大小、电荷和电荷分布则是影响离子液体众多性质的根源。Wasserscheid和Keim[4]在他们最近的一篇综述中,总结了阴阳离子本身的结构性质对离子液体的性质比如熔点、蒸气压、热稳定性、密度、粘度、溶剂化力和酸性等等的影响。本文将最近几年国际上一些比较成熟的观点总结了一下,对离子液体自身结构与它的基本性质之间的关系作了一点简单的探讨。 1 熔点评价离子液体特性的一个关键参数就是其熔点。为什么离子液体的熔点可以这么低?多数人认为离子的空间对称性是影响其熔点的主要原因,当离子处于不对称时,离子难以规则的堆积因而不能形成晶体,导致熔点下降[8]。阳离子如烷基取代的咪唑离子,全取代时(五甲基咪唑)有较高的熔点,而异丙基取代的则比正丙基取代的要高。阴离子以TFSI和TSAC为例进行比较,从图1可以看出TFSI为对称结构,而TSAC则为不对称结构,因此当阳离子相同时,后者的熔点就要比前者低很多,比如[TMA][TSAC](64℃)<[TMA][TFSI](130℃),[TEA][TSAC](20℃)<[TEA][TFSI](105℃),[P11][TSAC](24℃)<[PAA][TFSI](105℃)。但这种解释具有很大的局限性,分别以不同烷基取代的咪唑阳离子与Cl-、BF4-、PF6-和[AlCl4]-四种阴离子构成的离子液体为例来看,见表2,当1位N上的取代基链增长时,也就是向着不对称上发展时,链长小于C6-C8构成的离子液体熔点在下降,与上述解释非常吻合。但链长再增长时,熔点反而上升(见图2),则与上述解释矛盾。而当阳离子相同时,离子液体的熔点随着阴离子半径的增大呈现下降趋势,如[EMIm]Cl(87℃)〉[EMIm]Br(76.5℃)〉[EMIm]NO2(55℃)〉[EMIm]NO3(38℃)。 表2 不同组成RTILs的熔点
Table 2 Melting points of RTILs of different constituent
熔点/℃ |
[DMIm] |
[EMIm] |
[PMIm] |
[BMIm] |
[C6MIm] |
Cl- |
125 |
87 |
65 |
41 |
- |
BF4- |
36.9 |
11 |
-9 |
-81 |
-85 |
PF6- |
- |
62 |
106 |
10 |
-61 |
AlCl4- |
125 |
84 |
60 |
65 |
55([BBIm]) |
因此我们认为离子液体的熔点不能单纯地从离子的空间对称性来解释,还应考虑晶格中离子间电荷的相互作用力,也就是说处于晶格中的正负离子所吸收的能量是否能够较易地打破晶格能。在[EMIm]NO2离子液体中,由于阳离子中碳上的氢原子与阴离子中的氧之间形成氢键,即C-H-O,从而较易打破晶格能,其熔点为55℃[9]
。从表1的情况中我们可以总结出:当侧链长度适当时,晶格中的阳离子与阴离子在大小和电荷上存在一定当量关系,
将使离子间形成聚合离子对,其相互作用将超过晶格能,使其熔点较低。
上面说的离子间吸引的主要作用力,就是在把盐熔化成离子液体的过程中所克服的那种作用力,被称作相反电势的粒子间的库仑力(库仑定律)。在低温熔融盐中离子上的电势E正常情况下都是1(+或-),并且离子的半径比较大,也因此推断出它们之间的距离r也一定相对较大。在室温离子液体中离子的小电势和大半径的效果十分类似于分子液体中分子间的库仑作用。单独阳离子电荷的大小不仅通过分割电荷重心降低了库仑作用,而且多原子阴离子中的电荷也被限制在离子的表面,从而导致电荷密度极大的降低。表3中钠盐熔点的比较证明了这种效应,由于热化学半径是从Cl-到AlCl4-的顺序逐渐增大的,因此钠盐的熔点也按这个顺序逐渐降低,从801℃到185℃。类似地,从Na+到[EMIm]+随着半径的增加也导致了相应盐的熔点的进一步降低。但是与Na+不同,[EMIm]+电荷的分布状态并不是球形的[10],例如人们注意到咪唑阳离子中C2上氢的酸性,尽管只有很小的酸性。又像所有的芳香环一样,部分正电荷会出现在咪唑中C4和C5的氢上。
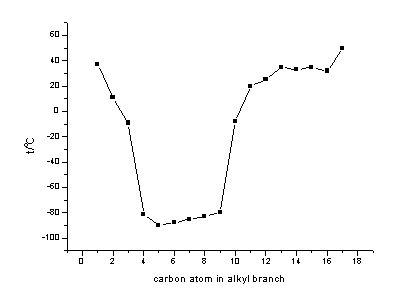
图2 1-烷基-3-甲基咪唑四氟硼酸盐的熔点与烷基侧链中碳数的关系
Figure 2 Melting point
variation with carbon number in alkyl chain for 1-alkyl-3-methlimidazolium
tetrafluoroborate
Table 3 Relative Size of ions and melting points of salts
离子 |
Cl- |
[BF4]- |
[PF6]- |
[AlCl4]- |
[Na]+ |
|
|
|
|
[EMIm]+ |
|
|
|
|
同样地咪唑阳离子的一部分正电荷也分布在环表面,正如在芳香环的表面也带有部分负电荷,这与把一个形式正电荷分配到N原子上的共振结构是相一致的。对[EMIM][PF6]晶体结构的检测发现,阴离子和阳离子之间的紧密联系与咪唑环的两个氮原子和三个芳香氢原子是有关联的[11] 。因此进行处理时,咪唑阳离子的正电荷可以被认作是分布在以咪唑阳离子为核的柱面上。连在环上的烷基基团增大了阴阳离子间的距离,但这些并不是参与电荷分离的主要因素。除了[EMIm]+的较大的体积之外,它的不对称结构也减少了它成为结晶体的可能性,所以很容易形成熔点在室温附近的RTILs。有趣的是,[EMIM][PF6]盐的已知熔点比根据阴阳离子大小来预测得到的熔点要高一些,这可能部分是由于阴阳离子的半径比(r+/r-)有利于结晶体的形成,因此就得到了结构决定的晶体。
也有人从研究固态和液态结构组织转变的角度上进行解释。大多数的离子液体在从结晶态转变到液态时一般都只有10%-15%的体积扩张。由于体积是随着距离的立方变化而变化的,那么熔化后相对较小的体积增长也就要求液态中原子(或离子)之间的距离不能与固态中的有很显著的变化。这个观点在对液体的大量X射线和种子扫描试验的分析中得到了证实,它们不同于NaCl[5]和SiO2[6]。既然在进行物态转变时离子之间的距离变化很小,那么需要的能量必然就很低,这也可以解释为什么很多离子液体的熔点这么低。因此,从对固态和液态结构组织转变的考虑得到离子液体中结构与熔点之间关系的思路似乎也是可行的。
离子液体的组成也对它的熔点有相当的影响。在一个A+B的二元体系中,液相线的最大值在特定化合物的成分中被观测到,例如在定性二元相图图3中描述的化合物AB。AB组成的差异导致了熔点一直降低,直到共熔体组成的最小值为止。对那些可以形成低温离子液体的金属卤化物来说,这样的组成差异是可以被预测到的。例如,在氯化铝体系中,AlCl4-、Al2Cl7-、Al3Cl10-、Al4Cl13-已经被介绍过,尽管根据文献[12]只有50%的组成才会导致化合物[EMIm][AlCl4]的形成。在这个[EMIm][Cl]/ AlCl3二元体系中,大约38%和66%的组成共熔物会导致熔点低于-70℃的液体。在[HPy]/ZnCl2体系中报道了一个更复杂的相图表,体系中描述了20,33,50,60和更高百分比的化合物[13],并且已经证实了在一个ZnCl2的金属移变液晶和阳离子表面活性剂组成的新体系中的组成变化,这个体系表现出了至少两种明显的液晶相和大量的在0%-85%的ZnCl2的组成范围之外的液晶相[14]。类似的共熔现象在所有的[MnXm]x-阴离子盐(例如[PF6]-、[PF5] -、[PF3] -或者[CuCl4]2-、[Cu2Cl6]2-、[CumCl2m+2]2-)中都可以预计到。从共熔现象可以发现这么一个事实,即离子液体组成中的微小变化有可能产生熔点显著不同的液体。
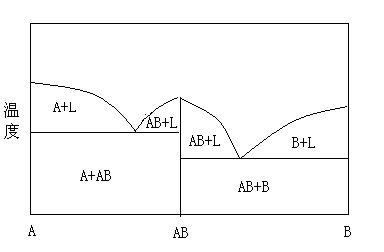
图3 一种单独化合物的二元相图表
Figure 3 Schematic of a binary phase diagram with a single compound
2 溶解性
相对于RTILs的极性,关于其溶解性能的研究更广泛一些。在预计离子液体有可能溶解离子种类的时候,Rogers等[7]发现很多离子染料被隔离进入水相,但是当离子液体为中性的时候,它们却被隔离进了离子液体。这就提出了一个问题:RTILs的溶解性是由什么决定的?控制RTILs阴阳离子的组成可以在一定程度上调节RTILs与其它溶剂之间的互溶性。阳离子[R1R2Im]+上取代烷基的链长将影响RTILs的亲水亲油性。对[CnMIm][BF4]而言,在25℃时,烷基(CnH2n-1)的n>5时,离子液体不溶于水,而当n≤5时,离子液体则与水相混溶[15]。同样六氟磷酸离子液体的疏水性随着阳离子烷基链长的增加而逐渐增大[16],如在50℃时,[BMIm][PF6]在水中溶解度为3.7wt.%,而[EMIm][PF6]则为8.0wt.%[17]。阴离子对离子液体溶解性的影响可由水在含相同阳离子[BMIm]+的离子液体中的溶解性来推测, [BMIm][CF3SO3]、[BMIm][CF3CO2]和[BMIm][C3F7CO2]与水是充分混溶的,而[BMIm][PF6]、[BMIm][(CF3SO2)2N]与水则形成两相混合物[18]。目前所研究的[EMIm][anion]中,阴离子为[PF6]-或[(CF3SO2)2N]-的RTILs一般可与水构成双相体系,但是离子液体和水的互溶性也会随着温度的增加而增大[16]。
很多有机溶剂对不同组成的RTILs表现出不同的溶解特性。有机溶剂在室温离子液体中的溶解性见表4[19]。可以发现当溶剂介电常数ε较大时,有机溶剂和室温离子液体会有较好的溶解性。因此可以通过溶剂的介电常数的大小来预测其和RTILs的互溶性,这对RTILs的溶解性研究有一定的指导作用。Rogers等人[2]还发现,在H2O/[BMIm][PF6]双相体系中引入第三组分(如乙醇)也会影响各相之间的分配比例,为调节RTILs和其它溶剂之间的溶解性能提供了更广阔的空间。由此可以看出,设计和利用RTILs取代挥发性的有机溶剂从水中萃取分离一些有机化合物是完全可能的[7a,20]。离子液体可以很顺利地溶解具有某些官能团的高分子或化合物。在微波加热情况下,纤维素在[BMIm]Cl中的溶解度可以达到25%[21]。Deng等[3]利用[PMIm]Cl 离子液体作为萃取剂,可顺利地分离牛磺酸(2-氨基乙磺酸)和硫酸钠,牛磺酸分离产率接近98%,提供了一种工业生产中牛磺酸分离的新方法。RTILs对金属络合物离子具有非常好的溶解能力,而且不存在溶剂化、溶剂解等副反应的干扰,因此被广泛地应用在金属络合物光谱学研究中[22-24]。在RTILs烷基链上人为地引入硫脲、硫醚及脲等改性官能团,可用于萃取某些过渡金属离子[25]。RTILs还可能是唯一能够溶解氢化物(如NaH和CaH2)、碳化物、氮化物、各种氧化物、硫化物等类盐化合物的溶剂[26]。RTILs的特殊溶解性能已经使其在核工业上取得了很好应用[27,28,29]。 表4 有机溶剂在不同组成的RTILs中的溶解性
Table 4 Solubility of organic solvents in RTILs of different constituents
溶剂 |
ε |
[BMIm][BF4] |
[BMIm][PF6] |
[BMIm][AlCl4](碱性) |
[BMIm][AlCl4](酸性) |
水 |
80.1 |
溶解 |
不溶 |
反应 |
反应 |
丙烯碳酸酯 |
64.0 |
溶解 |
溶解 |
溶解 |
溶解 |
甲醇 |
33.0 |
溶解 |
溶解 |
反应 |
反应 |
乙腈 |
26.6 |
溶解 |
溶解 |
溶解 |
溶解 |
丙酮 |
20.7 |
溶解 |
溶解 |
溶解 |
反应 |
二氯甲烷 |
8.93 |
溶解 |
溶解 |
溶解 |
溶解 |
四氢呋喃 |
7.58 |
溶解 |
溶解 |
溶解 |
反应 |
二甲基苯 |
7.20 |
溶解 |
溶解 |
溶解 |
反应 |
三氯乙烯 |
3.39 |
溶解 |
不溶 |
不溶 |
不溶 |
二硫化碳 |
2.67 |
溶解 |
不溶 |
不溶 |
不溶 |
甲苯 |
2.38 |
溶解 |
不溶 |
溶解 |
反应 |
己烷 |
1.90 |
溶解 |
不溶 |
不溶 |
不溶 |
3 粘度
RTILs的粘度决定于它的氢键和范德华作用力的强度[15]
。阳离子的结构对离子液体粘度的影响比较大,这也主要是由氢键和范德华力来决定的。在阴离子相同(PF6-)的情况下,随着阳离子取代烷基链长的增加,离子液体的粘度也相应地增大,二者基本上成线性正比关系。如[EMIm]+中侧链短小,
活动性强, 由其组成的离子液体粘度相对较低,
而含更长烷基链或氟化烷基链的离子液体粘度较大,
这是因为更强的范德华力作用的结果。对于氯铝酸RTILs,当X(AlCl3)
<0.5时,由于咪唑盐阳离子上的氢原子同Cl-之间的氢键作用而使RTILs的粘度较大;当X(AlCl3)>0.5时,Cl-浓度大幅度降低,氢键作用得到削弱,RTILs的粘度下降[11]。
表5 几种RTILs的粘度对比(20℃)
Table 5 Viscosity comparison in a few RTILs(20℃)
离子液体 |
粘度/cP |
[BMIm][CF3SO3] |
90 |
[BMIm][CF3COO] |
73 |
[BMIm][C3F7COO] |
182 |
[BMIm][C4F9SO3] |
373 |
[BMIm][(CF3SO2)2N] |
52 |
[BMIm][(CF3SO2)2N](25℃) |
69 |
[EMIm][(CF3SO2)2N](25℃) |
28 |
[BMIm][BF4] |
154 |
[EMIm][BF4] |
43 |
[BMIm][N(CN)2] |
21 |
阴离子的大小和几何形状对离子液体的粘度也有很大的影响,如[BMIm][PF6]和[BMIm][Tf2N]的粘度就有很大的差别,这主要是由于[Tf2N]-具有很大对称性,因而造成其粘度很低。表5[34]中给出了几种RTILs在20℃时的粘度。可以发现,从[CF3SO3]-到[C4F9SO3]-、从[CF3CO2]-到[C3F7CO2]-,
阴离子碳数增加,离子液体的粘度明显增加,这是因为含[C4F9SO3]-和[C3F7CO2]-的离子液体中更强的范德华力导致了离子液体的粘度增大。将[BMIm][CF3SO3]和[BMIm][(CF3SO2)2N]的粘度进行比较发现,虽然含[(CF3SO2)2N]-的离子液体有更强的范德华力,但其粘度并不大,这是因为较弱的氢键抵消了由范德华力引起的粘度增加[30]。但是阴离子为[N(CN)2]-的RTILs粘度普遍较低,这都可能与阴离子较小的体积有关[31-33]。温度对RTILs粘度的影响也比较大,随着温度的升高,
离子液体的粘度减小,见图4[35]。另外,表5中的粘度数据还表明,离子液体的粘度通常比有机溶剂的粘度高1~2个数量级。
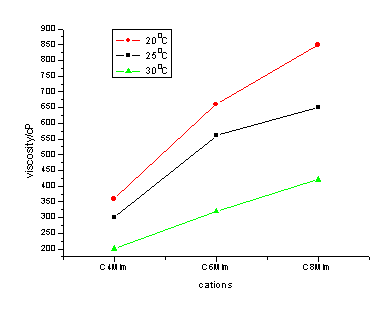
图4 不同温度下离子液体粘度与阳离子之间的关系(阴离子均为[PF6]-)
Figure 4 The relationship between viscosity
and cations for ionic liquids with anion PF6-
4 总结
通过前面对离子液体结构和性质之间的关系的简单总结,我们可以大概地得到一些信息:离子液体和所有的化学物质一样,自身的结构和性质之间是有紧密联系的。相关离子的大小、形状和电荷分布决定了离子间相互作用力的大小。当离子比较大并且电荷密度比较小时,离子间的库仑力就会很低,再加上有利的晶体结构,达到分子液体中分子间作用力的尺度,因此也就得到了低熔点的室温离子液体;可以通过有机溶剂的介电常数的大小来预测它和RTILs的互溶性,从而给设计和利用RTILs取代挥发性的有机溶剂提供一定的指导作用;RTILs的粘度主要受氢键和范德华作用力的影响,另外温度也会有一定影响。但是,我们也看到由于RTILs本身的特性还没有被充分认识,现在有关它们的许多物理性质和化学性质还是停留在较肤浅的认识上,而且有一些很必要的物理常数还没有核准甚至尚未测定,这些都限制了RTILs研究工作的开展。对其自身结构和性质之间的联系的研究,基本上还停留在量化阶段,虽然有一些观点已经比较成熟,但还未能从理论上给出明确的解释。因此,我们需要适时开展相关的研究工作,通过不断的努力,力争在这一相关领域取得一些创新性的实验研究结果。
REFERENCES
[1] Wilkes J S, Zaworotko M J. J.Chem.Soc, Chem.Commun.,1992, 965-967.
[2] Swatlosk R, Visser A E, Reichert W M et al. Chem.Commun., 2001, 2070-2071.
[3] Deng Y Q, Gu Y L, Shi F.CN1403443,2003[74]
[4] Wasserscheid P, Keim W. Angew. Chem. Int. Ed., 2000, 39 (21): 3772-3789.
[5] (a) Biggin S, Enderby J E. J.Phys.C: Solid State Phys.,
1982,15 (11):L305-L309; (b) Revere M, Tosi M P, Rep.Prog.Phys., 1986, 49:1001-1081.
[6] Elliott SR. J.Phys:Condensed Matter, 1992, 4: 7661-7678.
[7] (a) Huddleston J G, Willauer H D, Swatloski R P et al. Chem.Commun., 1998, 1765-1766;
(b) Visser A E, Swatloski R P, Rogers R D. Green Chemistry,
2000, 2: 1-4.
[8] Ellis B, Keim W, Wasserscheid P. Chem.Commun, 1999, (4): 337-338.
[9] Huang J F, Chen P Y, Sun I W
Inorganica Chimica Acta, 2001,320(1-2): 7-11
[10] Hanke C G, Price S L, Lynden-Bell R M, Mol. Physics, 2001, 99: 801-809.
[11] Fuller J, Carkin R T, Delong H C et al. J Chem. Soc., Chem. Commun., 1994,
(3): 299-300.
[12] Fannin A A, Jr Floreani D A, King L A. J Phys. Chem., 1984, 88: 2614-2621.
[13] Easteal A J, Angell C A. J Phys Chem, 1970,74: 3987-3999
[14] (a) Martin J D and Thronton T A. Proc Mat Res Soc, 1999,559: 243-248 (b) Martin
J D, Keary C L, Thornton T A, et al, Angew Chem, 2001,submitted
[15] Bonbote P, Dias A P, Papageorigiou N et al. Inorg Chem, 1996,35,1168-1178
[16]Anthony J L, Maginn E J, Brennecke J F. J Phys Chem B, 2001, 105(44): 10942-10949
[17] Wong D SH, Chen J P, Chang J M et al. Fluid Phase Equilibrium, 2002,
194-197,1089-1095
[18] Han J Y, Huang X, Wang H. Chemical Industry and Engineering(Huaxue Gongye yu Gongcheng),
2005,22 (1):62-66
[19] Koel M, Proc Estonian. Acad Sci Chem, 2000,49(3): 145-155
[20] Fadeev A G, Meagher M M. Chem Commun, 2001,295-296
[21] Swatloski R P, Spear S K, Holbrey J D et al. J Am Chem Soc, 2002, 124, 4974-4975
[22] Yang Q Q, Fang B L, Chem Bull (Huaxue Tongbao),1993,5: 14-18
[23] Appleby D, Hussey C L, Seddon K R et al. Nature, 1986,323: 614-616
[24] Hussey C L. Pure&Appl Chem, 1988, 60 (12): 1763-1772.
[25] Visser A E, Swatloski R P, Reichert W M et al. Chem Commun,2001,13-136.
[26] C·赖卡特,有机化学中的溶剂效应,北京:化学工业出版社,1987,47-51.
[27] Harmon C D, Smith W H, Costa D A. Radiation Physics and Chemistry, 2001,60: 157-159.
[28] Abdul-Sada A K, Atkins M P, Ellis B et al. WO95/21871,1995
[29] Fields M, Hutson G V, Seddon K R, Gordon C M, WO98/06106,1998.
[30] Shi J H, Sun X. Chem Bull (Huaxue Tongbao), 2002,65 (4): 243-250
[31] McEwen A B, Ngo H L, LeCompte K et al. J Electrochem Soc, 1999, 146 (5):
1687-1691.
[32] Kimizuka N, Nakashima T. Langmuir, 2001, 17 (22), 6759-6761
[33] McFarlane D R, Golding J, Forsyth S et al. Chem Commun, 2001, 1430-1431
[34] Gu Y L, Peng J J, Qiao K et al. Progress in Chemistry (Huaxue Jinzhan), 2003,15 (3):
222-241.
[35] Blanchard L A, Hancu D, Beckman E J et al. Nature, 1999, 399, 28-29.
[36] Heddleston J G, Visser A E, Reichert W M et al. Green Chemistry, 2001, 3:
156-164.
[37] Ngo H L, Lecompte K, Hargens L et al. Thermochim Acta, 2000, 357: 97-102.
[38] Bonhote P, Dias A P, Papageogiou N et al. Inorg Chem, 1996, 35 (5): 1168-1178.
[39] Suarez P A Z, Einloft S, Dullius J E L et al. J Chim Phys, 1998, 95 (7):
1626-1639.
[40] Fannin A A, Jr, Floreani D A et al. J Phys Chem, 1984, 88 (12): 2614-2621.
[41] Wikes J S, Zaworotka M J. J Chem Soc., Chem Commun, 1992, (13): 965-967.
[42] Frederic F , Helene O B, Dominique C et al. Chem Commun, 2001, 1360-1361.
[43] Zhang Q SH, Liu A X, Guo B N. Chemical Journal of Chinese Universities (Gaodeng
Huaxue Xuebao), 2005, 26 (2): 340-342.
[44] Davis J H, Jr Forrester K J and Merrigan T ,Tetrahedron Letters,1998,39: 8955-8958.
[45] Munson C L, Boudreau L C, Driver M S, US6,339,182 B1, 2002.
[46] Wasserscheid P, Bosmann A and Bolm C, Chem Commun, 2002, 200-201.
[47] Hakkou H, Eynde J J V, Hamelin J, Synthesis,2004, (11): 1793-1798.
[48] Schottenberger H, Wurst K, Horvath U E I et al. Dalton Trans, 2003, 4275-4581.
[49] Zong-gang Mu, Feng Zhou, Shu-xiang Zhang, Helvetica Chimica Acta, 2004, 87,
2549-2555.
[50] Jodry J J, Mikami K, Tetrahedron Letters, 2004, 45, 4429-4431.
[51] Visser A E, Swatloski R P, Reichert W M, Environ Sci
Technol, 2002, 36 (11): 2523-2529.
[52] Holbrey J D, Seddon K R, J Chem Soc, Dalton Trans, 1999, 2133-2139.
[53] Hirao M, Sugimoto H, and Ohno H, J Elcetrochem Soc, 2000, 147 (11): 4168-4172.
[54] Wasserscheid P, Holscher B D, Hal R V, Chem Commun, 2003, 2038-2039.
[55] Stavber S, Jereb M and Zupan M, Chem Commun, 2002,488-489.
[56] Cole A C, Jensen J L, Ntai L, Tran K L T et al. J Am Chem Soc, 2002,124: 5962-5963.
[57] Gu Yanlong, Shi Feng and Deng Youquan. Journal of Molecular Catalysis A: Chemical,
2004,212: 71-75.
[58] Lancaster N L, Salter P A, Welton T et al. J Org Chem, 2002,67:8855-8861.
[59] Kim K S, Choi S, Demberelnyamba D et al. Chem Commun, 2004,828-829.
[60] Sun J, Forsyth M and MacFarlane D R. J Phys Chem B, 1998, 102, 8858-8864.
[61] Larsen A S, Holbrey J D, Tham F S. J Am Chem Soc,2000, 122 (30): 7264-7272.
[62] Visser A E, Holbrey J D, Rogers R D et al. Chem Commun, 2001, 2484-2485.
[63] Carter E B, Culver S L, Fox P A et al. Chem Commun, 2004, 630-631.
[64] Hitchcock P B, Seddon K R and Welton T. J Chem Soc, Dalton Trans,1993,
2639-2643.
[65] Brown R J C, Welton T, Dyson P J et al. Chem Commun, 2001(18): 1862-1863.
[66] Leone A M, Weatherly S C and Williams M E. J Am Chem Soc, 2001, 123 (2):
218-222.
[67] Tokuda H, Hayamizu K, Ishii K et al. J Phys Chem B, 2005, 109: 6103-6110.
[68] Matsumoto H, Kageyama H, Miyazaki Y. Chem Commun, 2002, 1726-172.
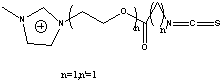 11TS1Br=
11TS1Br= 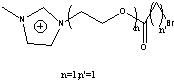
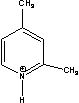 BBSMIm=
BBSMIm= 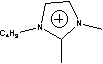
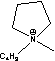 C2=
C2=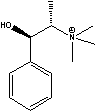 C3=
C3=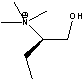 C6=
C6=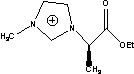
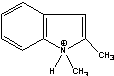 DPEBIm=
DPEBIm= 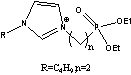
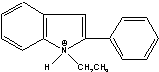 EPP=
EPP= 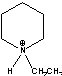 ETMMIm=
ETMMIm= 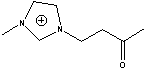
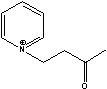 F-TEDA=
F-TEDA=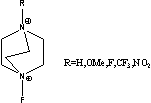 HexPyr=
HexPyr=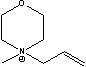 MBIm=
MBIm=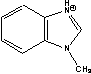 MIn=
MIn= 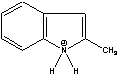
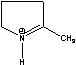 MPE=
MPE= 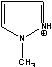 MePEG-bpy(1/2)=
MePEG-bpy(1/2)= 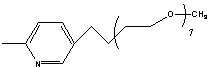
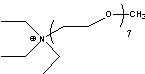 MPyr=
MPyr=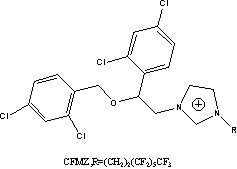
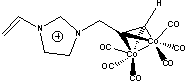
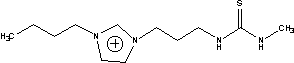


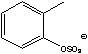 Sac=
Sac=  Ace=
Ace=