http://www.chemistrymag.org/cji/2006/081002pc.htm |
Jan. 10, 2006 Vol.8 No.1 P.2 Copyright |
Zhai Yongqing, Liu Yuanhong, Liu Yu
(College of Chemistry and Environmental Science, Hebei University, Hebei Baoding 071002)
Abstract Gd2O2S:Eu,Mg,Ti,
a novel red phosphor was firstly synthesized in microwave field. The as-synthesized
phosphors were investigated by XRD, SEM and Fluorescence spectrophotometer. The results
show that Gd2O2S:Eu,Mg,Ti phosphor is a hexagonal crystal structure,
which is similar to that of Gd2O2S. The particles of Gd2O2S:Eu,Mg,Ti
phosphor are basically spherical in shape, dispersing well. The mean particle size is 1-2mm. The excitation spectrum is a broad band and the main peak is at
360nm. Moreover, excitation peaks at 400nm, 422nm and 472nm have been found in the
excitation spectrum. The emission spectrum shows that Gd2O2S:Eu,Mg,Ti
has narrow emission peaks. The emission peaks are ascribed to Eu3 + ions
transition from 5 DJ ( J = 0 , 1 , 2 ) to 7 FJ
( J = 0 , 1 , 2 , 3 , 4). The peak at 627nm in the emission spectra is stronger than that
of 617nm, so phosphor shows pure red-emitting. Decay curves of Gd2O2S:Eu,Mg,Ti
phosphors with different Mg,Ti concentration were measured. Furthermore, luminescence
mechanics was discussed.
Keywords Gd2O2S:Eu,Mg,Ti; microwave method;
excitation spectrum; emission spectrum; long afterglow
Gd2O2S:Eu,Mg,Ti红色磷光体的微波法合成及长余辉发光行为
翟永清,刘元红, 刘宇(河北大学化学与环境科学学院,河北 保定,071002)
2005
年12月8日收稿; 河北省教育厅博士基金资助项目(B2004205)、河北大学研究基金资助项目摘要
用微波法首次合成了Gd2O2S:Eu,Mg,Ti 红色磷光化合物,用X射线粉末衍射(XRD)、扫描电镜(SEM)、荧光分光光度计等对合成产物进行了分析和表征。结果表明:Gd2O2S:Eu,Mg,Ti的晶体结构与Gd2O2S的相同,为六角晶系。颗粒的形貌为类球形,分散性较好,尺寸在1-2mm之间。Gd2O2S:Eu,Mg,Ti 的激发光谱呈带状,激发光谱主峰位于360nm,另外在400nm,422nm,472nm等处也有激发峰存在。发射光谱为线状光谱,发射峰归属于Eu3+从5 DJ ( J = 0 , 1 , 2 ) 到 7 FJ ( J = 0 , 1 , 2 , 3 , 4)的能级跃迁,其中627nm处的发射峰明显高于617nm,呈现纯正红色发光。同时研究了Mg,Ti的掺杂对余辉特性的影响,并对发光机理进行了探讨。关键词 Gd2O2S:Eu,Mg,Ti;微波法;激发光谱;发射光谱;长余辉
1 引言
长余辉发光材料,是一类储光功能材料,作为美化和清洁光源在发光陶瓷、交通安全标志、紧急突发事件的照明设施、工艺美术涂料等众多领域得到越来越广泛的应用,引起人们的重视。目前,非放射性长余辉磷光粉中,绿色和蓝色长余辉磷光粉的制备工艺已逐渐趋向成熟,使人们把重点放在了非放射性红色长余辉磷光粉的合成及其性能的研究上。研究较多的红色长余辉发光材料有铕激活的碱土金属硫化物(MS:Eu2+)[1],但是其化学性质不稳定。苏锵研究组[2]报道了碱金属及碱土金属离子掺杂荧光体Y2O3:Eu3+的余辉现象,但仅限于紫外光激发,而且余辉时间短,仅4min。雷炳富等[3] 报道了Sm3+激活的硫氧化钇橙红色长余辉材料。1999年Murazaki Y等[4] 在传统的红色光材料Y2O2S:Eu中加入Mg,Ti获得了红色长余辉发光材料,近年来虽对该体系进行了一些研究 [5-6],但制备方法均为高温固相法。这种合成方法过程复杂、焙烧温度高、反应时间长(一般需要若干个小时),且制备的磷光材料粒子尺寸较大,需进行研磨,在研磨过程中会造成晶粒的破坏,降低产品的发光强度。
微波作为一种能源,正以比人们预料要快得多的速度步入许多化学领域,它不仅可用于有机和无机化合物的合成[7-8],也可用于分子筛和高聚物的合成[9-10],是一种快速高效、省电节能和环境污染少的合成方法。本文首次用微波法合成了一种新型红色长余辉发光材料Gd2O2S:Eu,Mg,Ti,并研究了Ti,Mg的掺杂对余辉特性的影响。
2 实验
2.1 样品的制备
主要原料是:Gd2O3、Eu2O3、S、MgO、Na2CO3、Li2CO3等,以上试剂均为分析纯;TiO2(锐态型,自制)。微波吸收剂采用活性炭(化学纯)。
具体制备方法:按一定比例称取Gd2O3、S、Li2CO3和Na2CO3,加入一定量Eu2O3作为激活剂,及适量的MgO和TiO2作为掺杂剂。在研钵中充分研混,装入小刚玉坩埚,压实,盖严后放入另一大坩埚,夹层填充碳粒,置于格兰仕WD700(L23)微波炉加热一定时间。将所得产物用热的稀盐酸浸泡一定时间后,用蒸馏水洗至中性,过滤,烘干,即得样品。
2.2 分析测试
用Y2000型全自动X射线衍射仪(CuKa )测定样品的物相结构,测试条件为:20° ≤2q ≤80° ,CuKa ,l =1.54178Å,电压30kv,电流20mA,扫描速率为0.06° /s;用KYKY-2800B型SEM扫描电镜观察样品的形貌和粒度;用RF-540荧光分光光度计测定样品的激发和发射光谱。
3 结果与讨论
3.1 物相结构分析
样品的X射线粉末衍射图及衍射数据如图1和表1所示。从中可以看出,所得样品与Gd2O2S的JCPDS标准衍射卡片(卡片号:26-1422)的衍射数据基本一致,经计算分析得出所得样品Gd2O2S:Eu,Mg,Ti 的晶体结构与Gd2O2S相同属于六角晶系,晶胞参数为a0=0.38504nm,c0=0.66671nm,与Gd2O2S卡片中的晶胞参数a0=0.38522nm,c0=0.66672nm非常相似,具有3D3d3(P3m)空间群。在图1中没有Eu,Mg,Ti的化合物的衍射峰出现,说明Eu,Mg,Ti等掺杂离子已均匀进入到Gd2O2S基质晶格中。
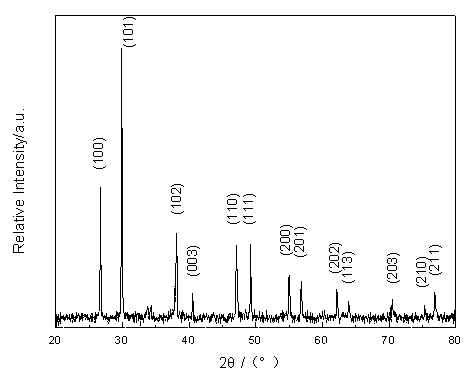
图1 Gd2O2S: Eu0.06, Mg0.02, Ti0.02的XRD图谱
Fig.1 XRD pattern of Gd2O2S: Eu0.06, Mg0.02, Ti0.02
表1 Gd2O2S: Eu0.06, Mg0.02, Ti0.02的XRD数据
Table 1 XRD data of Gd2O2S: Eu0.06, Mg0.02, Ti0.02
实验值 |
标准卡片 (No. 26-1422) |
||||
2 q |
d(Å) |
I/I0 |
d(Å) |
I/I0 |
hkl |
26.752 |
3.3323 |
57.1 |
3.34 |
35 |
100 |
29.974 |
2.9810 |
100 |
2.985 |
100 |
101 |
38.200 |
2.3559 |
36.1 |
2.359 |
30 |
102 |
47.202 |
1.9255 |
32.0 |
1.926 |
40 |
110 |
49.298 |
1.8484 |
28.1 |
1.850 |
25 |
111 |
55.086 |
1.6671 |
26.1 |
1.668 |
25 |
200 |
56.889 |
1.6185 |
24.1 |
1.618 |
18 |
201 |
62.229 |
1.4918 |
19.5 |
1.492 |
14 |
202 |
63.980 |
1.4551 |
15.4 |
1.456 |
8 |
113 |
76.948 |
1.2391 |
18.2 |
1.239 |
18 |
211 |
与合成稀土硫氧化物的传统方法-高温固相法相比,微波辐射法不仅操作简单,无需特殊保护气氛,而且反应速度快,产物纯净无杂相。这是由于微波辐射作用在固相反应混合物的组分中,驱使分子中的偶极子作高速振动,由于受到其周围分子的阻碍和干扰,从而获得能量,以热的形式表现出来,使介质温度迅速上升,最终驱动化学反应快速进行。
3.2 形貌粒度分析
图2为反应20min所得样品的SEM照片。从图中可以看出,样品颗粒的形貌为类球形,分散性较好,尺寸在1-2mm之间。这是因为:在微波法制备样品的过程中产生的大量气体,如SOx、CO2等,有效阻碍了颗粒之间的团聚。从图2也可看到只有极少量大颗粒存在,这可能是由于反应过程中局部温度过高以及反应物研磨不充分引起的。

图2 Gd2O2S: Eu0.06, Mg0.02,
Ti0.02样品的SEM照片
Fig.2 SEM photograph of Gd2O2S:
Eu0.06, Mg0.02, Ti0.02
3.3 Gd2O2S:Eu,Mg,Ti
的发光性质3.3.1 Gd2O2S:Eu,Mg,Ti的激发光谱
Gd2O2S:Eu,Mg,Ti的激发光谱如图3所示。由图3可见,在627nm监测下,Gd2O2S:Eu,Mg,Ti的激发光谱主要是位于200-450nm范围内的宽带。其主峰位于360nm,在400nm,422nm处也有激发峰。这些激发峰来源于Eu3+的电荷转移态的吸收跃迁(Eu3+→O2-, Eu3+→S2-)。
Xiaoxin Wang[11]等报道了Y2O2S:Eu,Mg,Ti体系激发光谱的主峰在310nm,弱峰为263nm。我们用微波法合成的Gd2O2S:Eu,Mg,Ti体系与之相比,激发峰向长波方向发生了明显的移动,而且在472nm处也存在着尖锐的吸收峰,此区域已属于可见光区,因此在太阳光和日光灯的照射下均可出现明亮的红光,且有余辉现象。
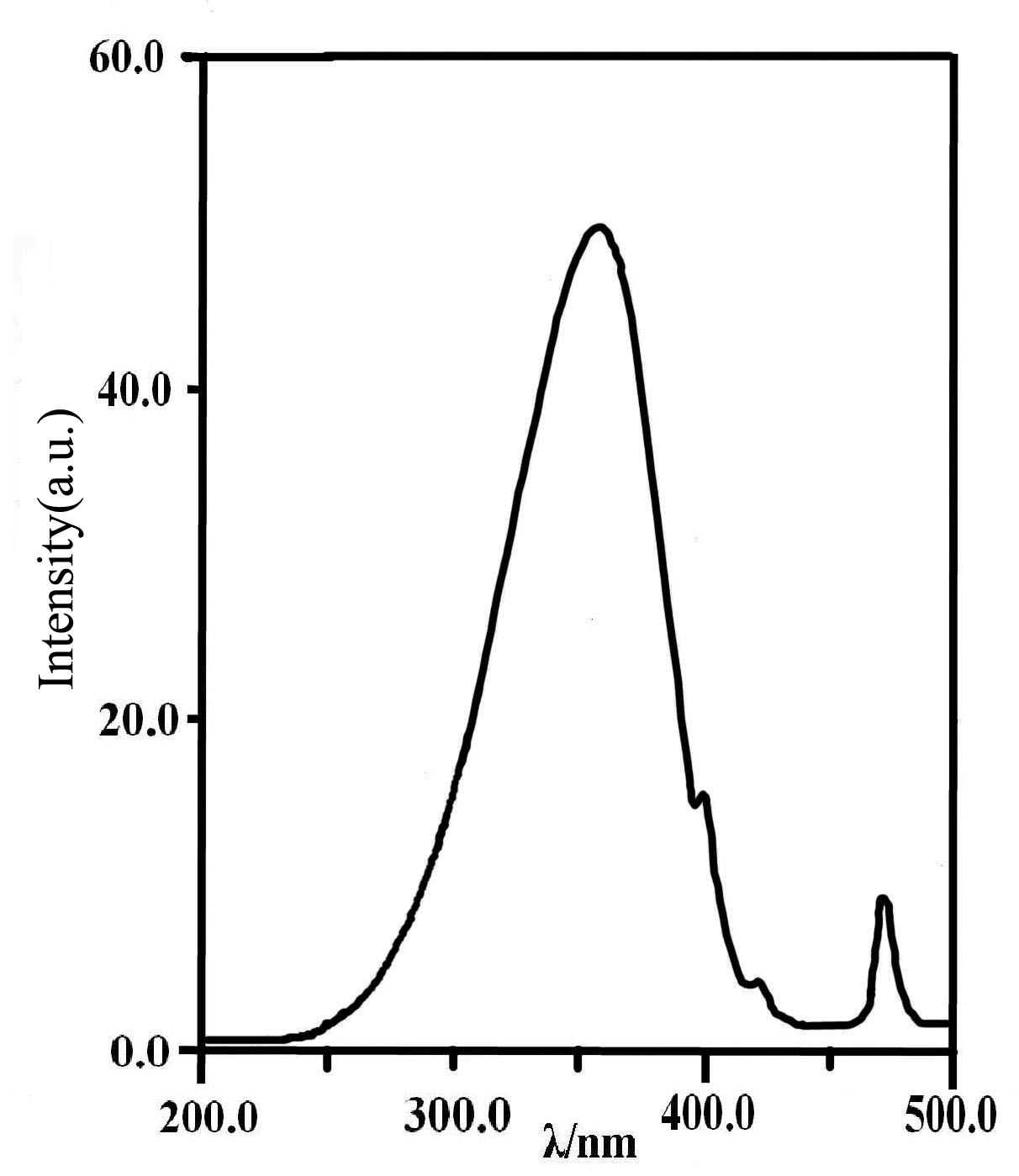
图3 Gd2O2S: Eu0.06, Mg0.02, Ti0.02样品的激发光谱
Fig.3 Excitation spectrum of Gd2O2S: Eu0.06, Mg0.02, Ti0.02
3.3.2 Gd2O2S:Eu,Mg,Ti
的发射光谱图4为360nm激发下Gd2O2S:Eu,Mg,Ti的发射光谱。从中可见,Gd2O2S:Eu,Mg,Ti体系发射光627nm,617nm,597nm,586nm,557nm,541nm,513nm,498nm,468nm的窄带发射峰组成。其中最强的发射峰627nm,617nm,归属于5D0?7F2跃迁;627nm发射峰明显强于617nm,显示出纯正的红色发光。其它发射峰的归属为:597nm(5D0
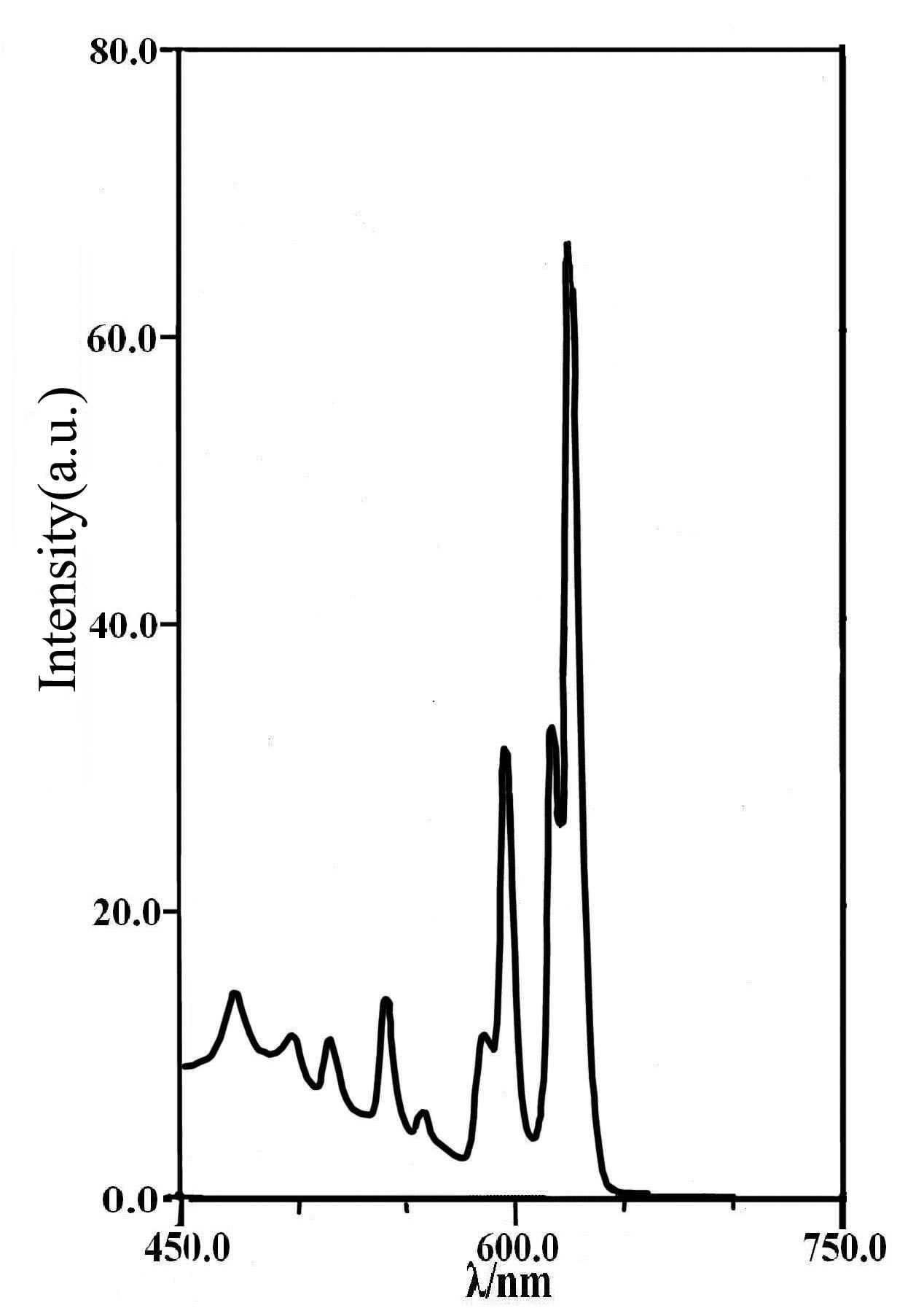
图4 Gd2O2S: Eu0.06, Mg0.02,
Ti0.02样品的发射光谱
Fig.4 Emission spectrum of Gd2O2S: Eu0.06,
Mg0.02, Ti0.02
3.3.3 Eu
浓度对Gd2O2S:Eu,Mg,Ti发光强度的影响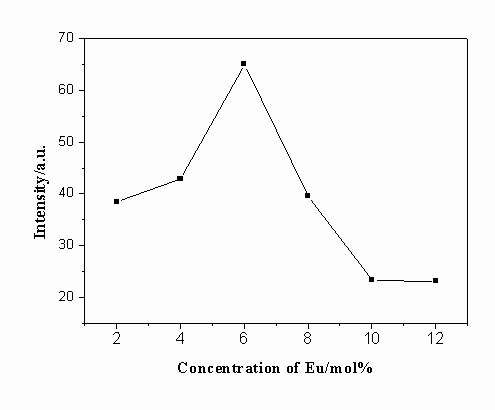
图5 Eu的浓度对发光强度的影响
Fig.5 Effect of Eu
concentration on the luminescence intensity
固定Mg, Ti的掺杂量均为2 mol%,考察Eu浓度的变化对样品在627nm处的发光强度的影响,结果如图5所示。从中可以看出,随着Eu浓度的增加,样品的发光强度逐渐增加,当Eu的浓度为6 mol% 时达到最大。超过6 mol% 时,发光强度快速下降,即出现浓度猝灭现象。这主要是由于激活剂浓度达到一定值以后,激活剂之间的相互作用增强,增大了无辐射跃迁几率,从而使发光效率下降。
3.3.4 Mg,Ti的掺杂对Gd2O2S:Eu,Mg,Ti余辉性质的影响
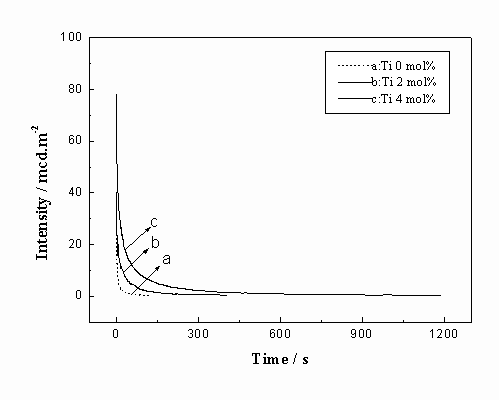
图6 掺杂不同量Ti的余辉曲线
固定
Eu,Mg的量分别为6 mol%、2 mol%,考察了Ti的掺杂对Gd2O2S:Eu,Mg,Ti余辉时间的影响,结果如图6所示。从中可以看出:当无Ti 掺杂时几乎没有余辉现象。随着Ti的掺杂量的增加磷光体的余辉时间逐渐增加。当其掺杂量为4mol%时,余辉时间可达1200s。其原因可认为是异价阳离子取代后,形成杂质能级所造成的。Ti4+取代Gd3+格位后由于价态的不同和离子半径的差异造成了较大的晶格畸变,在晶体禁带中产生相应的施主能级,受紫外光或可见光激发时晶体中出现电子和空穴的离解,电子被Ti4+形成的陷阱能级所捕获,Ti4++e →Ti3+,形成电子心,当电子和空穴重新复合时,即出现长时发光现象[6]。固定Eu,Ti的量分别为6 mol%、2 mol%,进而考察了Mg的掺杂对Gd2O2S:Eu,Mg,Ti余辉时间的影响,结果如图7所示。从中可以看出:不掺Mg只掺Ti时虽有一定的余辉,但时间仅为286s;当掺入Mg的量为2 mol%时,余辉时间延长到376s, 虽有一定的改进,但是效果并不显著。掺杂浓度达到4mol%时余辉时间明显加长,为1196s。可见,适量Mg的掺杂可明显延长余辉时间。其机理从电荷补偿角度来分析有以下两种可能[12]:(1)通过共掺杂半径和Ti4+(半径为68pm)相近的Mg2+(半径为65pm),形成替代离子,在晶体中形成相应的负电中心,以补偿Ti4+取代Gd3+时产生的多余正电荷。(2)生成Mg2+间隙,以补偿晶体中内赋的O2-间隙电荷。从而使施主能级和受主能级更易于生成,造成更长的发光现象。
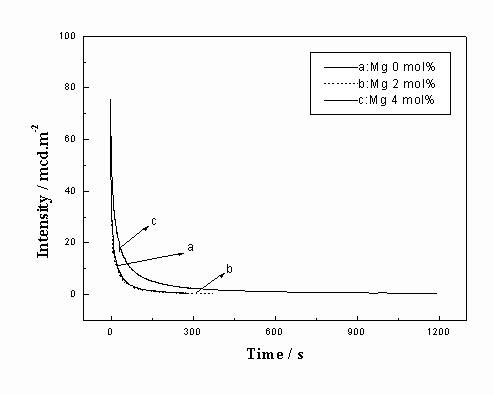
图7 掺杂不同量Mg的余辉曲线
Fig.7 Decay curves of the phosphors with different Mg concentrations
4 结论
综上所述,得出以下几点结论:
(1)首次用微波法合成一种新型红色长余辉发光材料Gd2O2S:Eu,Mg,Ti,该方法具有操作简单,快速高效,省电节能和环境污染少的的优点。样品具有化学性质稳定,红色纯正的特点。
(2)Gd2O2S:Eu,Mg,Ti样品的激发峰与Y2O2S:Eu,Mg,Ti相比,向长波方向发生了明显的移动。Gd2O2S:Eu,Mg,Ti的发光强度受Eu的浓度影响较大,在6%时达到最大。当Eu的浓度过大时会产生浓度猝灭。
(3)Mg,Ti 共掺杂形成陷阱能级,Eu作为发光中心,接受被捕获的电子和空穴重新复合后释放出的能量,产生特征辐射,形成较长时间的余辉。
REFERENCES
[1] Wu J P, Newman D, Viney Ian V F, et al. Journal of Luminescence, 2002, 99 (3): 237―245.
[2] Wang J, Su Q, Wang S B. Journal of Functional Materials (Gongneng
Cailiao), 2002, 33 (5): 558―560.
[3] Lei B F, Liu Y L, Tang G B, et al. Materials Chemistry and Physics, 2004, 87(9):
227-232.
[4] Murazaki Y, Arai K, Ichinomiya. Jpn. Rare Earth (in Jpn), 1999, 35: 41―45.
[5] Yang Z P, Guo Z, Zhu S C, et al. Spectroscopy and Spectral Analysis (Guangpuxue Yu
Guangpufenxin), 2004, 24(12): 1516―1510.
[6] Chang Y F, Zhao C L, Tong M W, et al. Journal of Rare Earth (Zhongguo Xitu Xuebao),
2004, 22(1): 66―70.
[7] Oksana K, Antoni R M. Organic Geochemistry, 2003,34(11): 1517-1523.
[8] Zhang M S. Rare Metal, 2000, 19(4): 279-284.
[9] Park S E, Kim D S, Chang J S, et al. Catalysis Today, 1998, 44 (1-4): 301-308.
[10] Ku H S, Siu F, Siores E, et al. Journal of Materials Processing Technology,
2001,113(1-3): 184-188.
[11] Wang X X, Zhang Z T, Tang Z L et al. Material Chemistry and Physics, 2003, 80: 1-5.
[12] Mikami M, Oshiyama A. First-principles study of intrinsic defects in yttrium
oxysulfide. Phys. Rev. B., 1999,60(3): 1707-1715.