http://www.chemistrymag.org/cji/2006/081007pc.htm |
Jan. 10, 2006 Vol.8 No.1 P.7 Copyright |
(Department of Chemistry and Chemical Engineering, Weinan Teacher's College,Weinan 714000,China) Abstract A new type of polarographic catalytic wave of organic compound, termed as association / parallel catalytic hydrogen wave, has been reported. The Association / parallel catalytic hydrogen wave with such characters as the negative shift of the peak potential and the great increase of the peak current in famotidine - persulfate system was studied. Here persulfate as ligand formed an association complex with protonated famotidine, which caused the peak potential of catalytic hydrogen wave of famoditne to shift negatively. Additionally, the great increase of the peak current was due to the further catalysis of the catalytic hydrogen wave by sulfate radical produced in the reduction of persulfate at electrode. In 0.1mol/L KH2PO4-Na2HPO4 (pH 6.2) -2.0×10-5mol/L K2S2O8 supporting electrolyte , famotidine yielded a association/parallel catalytic hydrogen wave with a peak potential of Ep-1.42V(vs.SCE). The 2nd-order derivative peak currents (ip") of the wave varied linearly with the famotidine concentration over the range 4.0×10-7 to 6.0×10-5 mol/L (r = 0.9991, n = 9) and 5.0×10-8 to 4.0×10-7mol/ L (r = 0.9989,n = 8) with detection limit of 1.5×10-8 mol/L (3s). RSD (n = 13) was 1.32% at the concentration level of 8.0×10-7 mol/L the analytical sensitivity of the association / parallel catalytic wave was 10 times higher than that of the corresponding catalytic wave. The proposed method has been applied to the determination of famotidine in tablets without previous treatment.
Keywords Famotidine, potassium persulfate , catalytic hydrogen wave, association/parallel catalytic hydrogen wave
法莫替丁的K2S2O8 缔合/平行催化氢波法测定研究 王福民 刘秉智
(渭南师范学院化学化工系,陕西 渭南 714000) 陕西省教育厅专项科研基金 (03JK216) 资助项目 摘要 报道了有机化合物极谱催化波的一种新类型----缔合/平行催化氢波。研究法莫替丁(FMT)的K2S2O8的缔合/平行催化氢波的结果表明,质子化FMT与S2O82-形成缔合物,引起峰电位负移;FMT催化氢波被S2O82-还原中间产物SO4-·进一步催化,使峰电流显著增加。在0.1mol/L KH2PO4-Na2HPO4(pH 6.2)-2.0×10-5mol/L K2S2O8的支持电解质中,FMT于EP = -1.42V (vs.SCE)处产生的缔合/平行催化氢波二阶导数峰峰电流与其浓度在4.0×10-7 ~ 6.0×10-5 mol/L(r = 0.999 1, n = 9)和5.0×10-8 ~ 4.0×10-7 mol/L(r = 0.998 9,n = 8)范围内呈良好的线形关系;检出限为1.5×10-8 mol/L(3s)。13次平行测定2.0 ×10-7 mol/L的FMT,相对标准偏差为1.32%。该缔合/平行催化氢波比相应的催化氢波提高分析灵敏度10倍。该方法不需要样品预处理,可直接测定片剂中FMT的含量。
关键词 法莫替丁,K2S2O8,催化氢波,缔合/平行催化氢波 法莫替丁(Famotidine,FMT)为一噻唑母核侧链上具有多个氨基的碱性化合物,在酸性介质中易溶解,在水、甲醇、无水乙醇等介质中极微溶。化学名为3-[[[2-[(二氨基亚甲基)氨基]-4-噻唑基]甲基]硫代]-N-氨磺酰基丙脒。FMT是继西咪替丁和雷尼替丁之后推出的第三代新型H2 的受体阻滞剂,通过阻滞胃壁细胞的H2受体,抑制胃酸分泌而有效治疗胃及十二指肠溃疡[1]。美国药典1995版收载的质控方法是:原料药采用高氯酸滴定,片剂采用高效液相色谱外标法,流动相为甲醇-水-磷酸盐缓冲液(6:31:3),在硅胶柱上进行[2]。我国部标准采用非水滴定法测定原料,紫外分光光度法测定片剂[3]。有关FMT测定,国内外文献报道的主要是HPLC法[4-6]、RH-HPLC[7-8]及紫外分光光度法[9-10]及电化学法[11,12]。Squella等[11,12] 基于催化氢波用相交流极谱法测定了FMT的含量,基于FMT在铂碳电极的氧化用差分脉冲极谱法测定了FMT的含量,回收率达到99.1%。
有机化合物的极谱催化波可分为有机化合物可还原基团的平行催化波[13-15]和氢的平行催化波。氢的平行催化波是在氧化剂存在下原催化氢波被进一步催化而产生的,其实质是有机化合物所携带的质子还原中间体原子态氢被氧化剂氧化而再生质子,其特征是峰电流增加,峰电位不变[16,17]。宋俊峰等[18]发现在H2O2的存在下,大环内酯类抗生素麦迪酶素催化氢波的存在下峰电流增加,峰电位负移,称之为“缔合/平行催化氢波”。作者发现在KH2PO4-Na2HPO4(pH 6.2)缓冲液中,FMT于峰电位-1.38V处产生的催化氢波,在K2S2O8存在下,峰电流增加,峰电位负移至-1.42V处,产生了FMT的缔合/平行催化氢波。其二阶导数峰峰电流ip"值在4.0×10-7 ~ 6.0×10-5 mol/L及5.0×10-8 ~ 4.0×10-7 mol/L范围内呈良好的线性关系。采用此方法可以测定FMT的含量,在药检中有很好的使用价值。 1 实验部分
1.1仪器与试剂
JP-303型示波极谱仪(四川成都仪器厂),三电极系统:滴汞电极为工作电极作线性扫描(303A静汞电极为工作电极作循环伏安研究),饱和甘汞电极为参比电极,铂电极为辅助电极。
1.0×10-3mol/L FMT标准储备液的配制:准确称取0.168 5g FMT(广州贝氏药业有限公司,含量:99.0%),用稀醋酸充分溶解、过滤。用水定溶于500mL容量瓶中。其他标准液用水稀释到所需浓度。FMT样品的测定液按标准液的配制方法。其他试剂均为分析纯,实验用水皆为二次蒸馏水。
1.2 实验方法
准确量取一系列FMT标准工作溶液1.0mL于25mL的容量瓶中,加入2.0×10-4mol/L K2S2O8溶液 2.5mL,0.2mol/L KH2PO4溶液 10.0mL, 0.2mol/L Na2HPO4溶液 2.5mL (pH 6.2,缓冲液总浓度为0.1mol/L),用水稀释至刻度,摇匀,转入适量上述溶液于10mL极谱池中,在JP-303型极谱分析仪上作阴极化扫描,起始电位为-0.90 V,扫描速率为0.25V·s-1。测量FMT于-1.42V (vs. SCE) 处极谱催化波的二阶导数峰峰电流ip″ 值,以FMT的浓度和二阶导数峰峰电流ip″ 值计算线性回归方程。 2 结果与讨论
2.1 实验条件的优化
2.1.1支持电介质与氧化剂的选择
使用JP-303型示波极谱仪做阴极化扫描, 在-0.90 ~ -1.90V电位范围内。考察了FMT在HAc-NaAc、KH2PO4-Na2HPO4、NH4Cl-NH3·H2O、KH2PO4- Na2B4O7、KH2PO4-NaOH、Britton-Robinson、KCl、NaClO4、NaOH、HCl、H2SO4等多种支持电介质的极谱行为.结果表明:在HAc-NaAC、Na2HPO4-KH2PO4及NH4Cl-NH3·H2O缓冲液中,FMT均产生催化氢波,分别加入相同浓度的K2S2O8,H2O2及KIO3氧化剂后,该催化氢波被进一步催化,峰电流都增大,峰电位负移。但K2S2O8对FMT的催化氢波的催化作用最明显,产生的缔合/平行催化氢波的峰电流增加最大,峰形对称且稳定(图1,d线)。因此,本文选取KH2PO4-Na2HPO4缓冲液作为支持电介质, K2S2O8作为氧化剂。
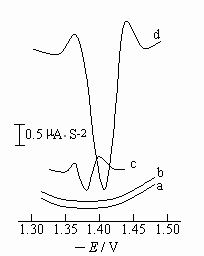
图1 FMT的二阶导数极谱图
a 0.10mol/L NaH2PO4-K2HPO4 (pH6.2) b a + 2.0×10-5mol/L K2S2O8
c a + 2.0×10-7mol/L FMT d b + 2.0×10-7mol/L FMT
2.1.2 缓冲液pH值及浓度的影响
考察了KH2PO4-Na2HPO4缓冲液pH值变化对FMT缔合/平行催化氢波峰电流ip"值及峰电位Ep的影响。结果表明:当pH在4.5 ~ 6.2范围内, ip"值随缓冲液pH值增高而逐渐增大,Ep逐渐负移;pH值在6.2-8.0范围内变化时, ip"值逐渐变小。本文选取pH值为6.2的KH2PO4-Na2HPO4作为缓冲液。
维持KH2PO4-Na2HPO4缓冲液pH 6.2恒定,当缓冲液总浓度在0.5×10-3 ~ 0.15mol/L范围内变化时,Ep负移;当总浓度从0.3×10-3 mol/L增加至1. 0×10-2mol/L时, ip"值突跃性增大。当浓度在1.0×10-2 ~ 0.10mol/L范围内, ip"值缓慢增大,接近一平台;当总浓度在0.10 ~ 0.15mol/L范围内, ip"值缓慢减小。当浓度为0.10mol/L左右时,峰电位Ep -1.42V(vs.SCE),ip"值最大,峰形对称且稳定。故本文选取KH2PO4-Na2HPO4缓冲液(pH 6.2)的总浓度为0.10mol/L。
2.1.3 K2S2O8浓度的影响
在pH6.2的KH2PO4-Na2HPO4为缓冲液中,随着K2S2O8浓度从2.0×10-7mol/L增加到3.0×10-5mol/L,FMT平行催化氢波峰电流ip"值突跃性增大,当K2S2O8浓度从3.0×10-5mol/L增加到2.0×10-4mol/L,ip"值缓慢减小(图3)。因此,本文选取氧化剂K2S2O8的浓度为2.0×10-5mol/L。
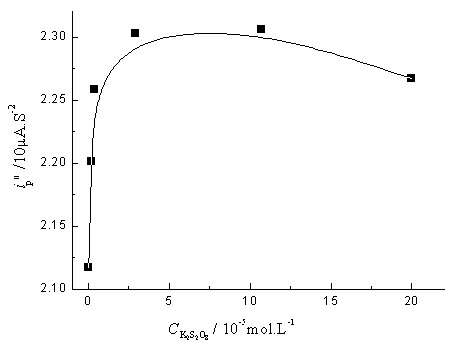
Fig.2 Effect of K2S2O8 concentration on peak current of 2.0×10-7mol/L FMT in 0.10mol/L KH2PO4-Na2HPO4 (pH6.2) buffer 综上所述,本文选用0.10mol/L KH2PO4-Na2HPO4缓冲液(pH 6.2)的作为最佳支持电解质,2.0×10-5mol/L K2S2O8溶液作为氧化剂。采用二阶导数极谱技术,起始电位为-0.90V,作阴极化扫描,测定FMT平行催化氢波的二阶导数峰峰电流ip″值。
2.2 稳定性及重现性
使用JP-303型示波极谱仪作阴极化扫描,实验结果表明,2.0 ×10-7mol/L溶液配制好12h内,FTM平行催化氢波的二阶导数峰峰电流ip"和峰电位Ep基本不变,稳定性良好。13次平行测量2.0×10-7mol/L FTM平ip″值的相对标准偏差RSD为1.32%。
2.3 校准曲线及检出限
在本实验所选定的最佳底液中,FTM平行催化氢波二阶导数峰峰电流ip″(nA·S-2)值于其浓度在6.0×10-7 ~ 6.0×10-5mol/L和5.0×10-8 ~ 4.0×10-7mol/L范围内呈良好的线性关系,其线性回归方程分别为ip" = -11.04 + 1.34 ×107CFTM(r = 0.999 1, n = 9)和 ip" = 9.99 + 1.68 ×105CFTM (r = 0.998 9, n = 8),检出限为1.5×10-8mol/L (3s)。
2.4 共存物质的影响
试验了一些可能产生干扰FTM的赋型剂、片剂中的填料对2.0×10-7 mol /L FMT平行催化氢波的影响。结果表明,在允许相对误差±5%范围内。淀粉,凝胶,乳糖,羧甲基淀粉钠,羟丙基纤维素,滑石及硬脂酸镁等对FTM的测定没有明显的干扰。这样在上述填料的存在下,能够有选择性地测定FTM的含量,而不需要样品预处理。
2.5 样品测定及回收率实验
在2盒FMT片(广东彼迪药业有限公司,标示量20mg),任取20片,碾碎,干燥,精确称取0.168 5g FMT,用稀醋酸溶于烧杯中,再转入100 mL容量瓶中,定容,过滤,取滤液50.0 mL于250 mL容量瓶中,加入蒸馏水至刻度,配得样品储备溶液。准确移取一定体积的上述样品储备液若干份,按实验方法测量样品液中FMT的二阶导数峰峰电流ip″值。由校准曲线求得25 mL样品液中FMT的浓度,并换算出每片药剂中FMT的含量;在25 mL样品液中作FMT的回收率试验,所得结果见表1。 表1 片剂中FMT含量的测定及回收率实验
Tab.1 Determination results of FMT content in tablets and experiment of recovery
测定值 |
平均值 |
RSD |
表示量 |
加入量 |
测得量 (mg) |
回收率 Recovery( %) |
19.5 |
19.9 |
1.53% |
20 |
1.69 |
1.68 |
99.41 |
3 讨论
3.1 FMT的催化氢波
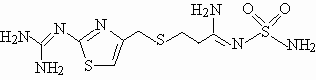
FTM结构式为:
Squella等[12]研究表明,FMT在滴汞电极上不能还原,产生的是催化氢波。本实验过程中,观测到在滴汞电极上有大量气泡放出;采用恒电位电解法于峰电位Ep-1.45V处,电解FMT溶液1h,峰电流没有明显的下降;由FMT的循环伏安图(图3,
c),可知,在含1.0×10-5mol/L FMT的KH2PO4-Na2HPO4 (pH 6.2)缓冲溶液中,正扫时FMT在阴极支上产生一还原峰,其峰电位Ep=
-1.38V(vs SCE),而反扫时在阳极支上无相应的氧化峰出现,电极反应过程不可逆。说明FMT产生的是催化氢波。
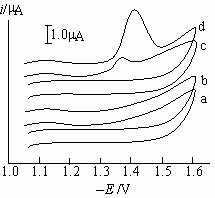
Fig.3 Cyclic voltammetric diagram of FMT
a 0.10mol/L KH2PO4-Na2HPO4 (pH6.2); b a + 2×10-5mol/L K2S2O8;
c a + 1.0×10-5mol/L FMT; d b +1.0×10-5mol/L FMT;
Potential scan rate v = 250 mV/s
根据催化氢波的理论[19],FMT首先接受介质中给予的H+生成具有电活性的FMTH+,接着FMTH+于电极表面进行单电子交换生成不稳定的中间体自由基FMTH*,该自由基随后进行双电子聚合反应放出H2产生了FMT的催化氢波,其过程包括:
FMT + H3+O Û FMTH+ + H2O
FMTH+ + e– ® FMTH*
2 FMTH* ® 2FMT + H2
3.2 FMT的缔合/平行催化氢波
K2S2O8存在下的循环伏安法实验(图3, d)表明,正扫时FMT在阴极支上产生一还原峰,峰电位与未加K2S2O8相比,负移至Ep=-1.42V(vs SCE),峰电流值增大了几乎10倍,而反扫时在阳极支上未出现还原峰,这是典型的缔合/平行催化氢波特征[18]。
当氧化剂K2S2O8存在时,S2O82-可氧化中间体的FTMH+,且自身被还原。S2O82-的还原为两步单电子的连续过程[20]:
S2O82- + e-® SO42- + SO4-·
E ≤0.6V
SO4-· + e-® SO42- E
≤3.4V
S2O82-还原中间体硫酸根自由基SO4-具有很强的氧化能力,它也能氧化中间体FTMH+再生电活性的FTMH+。S2O82-氧化中间体FTMH+的反应可表示如下:
FMTH* + S2O82-® FMTH++
SO42- + SO4-·
FMTH* + SO4-· ®
FMTH++ SO42-
质子化FTMH+单电子还原成中间体FTMH*,S2O82-又氧化FTMH*再生FTMH+,如此形成的氧化还原循环,产生了FTM的缔合/平行催化氢波[16]。
[1] Li Xinang, Lu Jinsheng, Huang Hua. Chinese Journal of Pharmaceuticals, 1992, 23: 540-542.
[2] The United States pharmacopeial convention. U.S.P Pharmacopeia's Nation Formulary. XXIII Washington:D.C.January. The board of trustee's official. Revision, 1995: 651.
[3] Pharmacopoeia Committee of PRC. Pharmacopoeia of the People's Republic of China. Part II, 2000Ed,Beijing: Chemical Industry, 2000: 425.
[4] Liu Haitao, Li Li, GuoXiaohong. Pharmaceutical Journal of Chinese People's Liberation Army, 2004, 20: 376-378.
[5] Dowling T C, Frye R F. J Chromatogr B, 1999, 732: 239-244.
[6] Cakir-B, Tosun-Au. Pharm-Sci, 1997, 3/10: 493-495.
[7] Lin Xiaoming, Liu Yanqing. China Pharmacist, 2004, 7: 31-32.
[8] Zhu Min, Song Yi, Zhao Yuxiang. Chinese Journal of Pharmaceuticals, 2002, 33: 348-349.
[9] Chen Weiyang, Hu Yuzhu, Ma Yuefeng, Liu Zhongtao. Chinese Pharmaceutical Journal, 2004, 39: 143-144.
[10] Pan Fuyou. Chinese Journal of Analytical Chemistry, 2001, 29: 243.
[11] J A Squella,C Rivera,I Lemus et al. Mikrochim. Acta. 990, 1: 343-348.
[12] J A Squella,G S Valencia,I Lemus,et al.J-Assoc. Anal Chem.,1989,72: 549-551.
[13] Kang Xiaofeng, Song JunFeng. Science in China (Chemistry), 1999, 42(5): 463-470.
[14] Song JunFeng, Dong Yanhua, Guo Wei, etal. Chinese Journal of Analytical Chemistry, 2001, 29: 745-749.
[15] Kang Xiaofeng, Guo Wei,Zhao Chuan. Science in China (Chemistry), 2000, 43: 275-282.
[16] Guo Wei, Liu Limin, Lin Hong, etal. Science in China (Chemistry), 2002, 45: 158-165.
[17] Liu Limin, Guo Wei, Song JunFeng. Chinese Journal of Analytical Chemistry, 2001, 30: 46-49.
[18] Song J F, Li N, Xu M T. Acta chim sinca, 2004, 62: 78-82.
[19] Mairanovskii S G. J Electroanal Chem, 1963, 6: 77-118.
[20] Memming R J. Electrochem soc, 1969, 116: 785-790.