http://www.chemistrymag.org/cji/2006/082009nc.htm |
Feb. 2, 2006 Vol.8 No.2 P.9 Copyright |
Study on simultaneous determination of sugar and nicotine with high performance liquid chromatography
Zhou Yuanqing1,3, Wu Zhaolu2,3,
Hu Zongda3, Shi Yundong1, Shen Taibo1
(1. Department of Chemistry, Yuxi Teacher’s College,
Yuxi 653100; 2. Kunming Division of Xishuangbanna Tropical Botanical Garden, Chinese
Academy of Science, Kunming 650223 ;3. Institute of Ecology and Geobotany, Yunnan
University, Kunming 650091 )
Abstract The simultaneous determination
of sugar and nicotine with high performance liquid chromatography (HPLC) in tobacco was
studied. The sugar and nicotine was extracted from the tobacco samples by ultrasonic
oscillation for 30 min with 45 ml of 5% acetic acid
solution. Then, the extract was purified by solid extraction with a
Waters Sep-Pak-C18 cartridge. The sugars and nicotine were
separated on a Waters Sugar-Pak-1 (6.5×300 mm) cations ion exchange column with 0.05 g.L-1
EDTA calcium disodium salt solution as mobile phase. The sugar was detected with a
refractive index detector and the nicotine was detected with an UV detector. The detection
limit reachs m g/ml level for sugar and ng/ml level for nicotine. The recoveries of sugars
and nicotine were between 97- 102 %. The relative standard derivations of sugars and
nicotine were 1.3-2.2%. This method was applied to the determination of Sugars and
nicotine in tobacco with good result.
Keywords high performance liquid chromatography, tobacco, sugar, nicotine
高效液相色谱法同时测定烟草中的糖和烟碱
1,3* ,吴兆录2,3,胡宗达3,史云东1,申太波1(1.玉溪师范学院化学与环境科学系,云南 玉溪 653100;2.中国科学院 西双版纳热带植物园,云南 昆明650223;3.云南大学 生态学与地植物学研究所,云南 昆明 650091)
摘要
研究了用高效液相色谱法同时测定烟草样品中的糖和烟碱的方法。烟草样品中的糖和烟碱用5%的醋酸超声振荡浸取,浸取液用Waters Sep-Pak-C18固相萃取小柱预分离,然后用0.05 g.L-1的EDTA钙钠水溶液为流动相, Waters Sugar-Pak-1钙型阳离子交换柱分离,用示差检测器检测糖,用紫外检测器检测烟碱,方法可一次进样同时测定烟草样品中的蔗糖,麦芽糖,果糖,葡萄糖和烟碱。方法最低检测限在微克级,相对标准偏差在1.3-2.2 %,标准回收率在97~ 102%之间。方法用于几种烟草样品分析,结果令人满意。关键词 高效液相色谱法,烟草,糖,烟碱
糖和烟碱是烟草中最重要的化学成分,它们在烟草中的含量及相互比例对烟草质量有重要影响,因此烟草中的糖和烟碱的测定对评价烟草质量有重要的意义[1,2],糖和烟碱的测定方法有容量法,光度法和色谱法等 [3-6]。但是用高效液相色谱法一次进样同时测定烟草中的糖和烟碱还未见报道过。我们研究了用5%的醋酸为浸提剂超声浸取烟草中的糖和烟碱,用Waters Sugar-Pak-1钙型阳离子交换柱分离,分别用示差检测器检测糖,紫外检测器检测烟碱,首次建立了一次进样同时测定烟草中的糖和烟碱的方法。
1 实验部分
1.1主要仪器和试剂
美国PERKIN-ELMER 公司高效液相色谱仪,包括LC-250泵,LC-30示差折光检测器,LC-480紫外二极管矩阵检测器,LC-Oven-101柱温箱;大连化物所KYKY-SPS-II色谱工作站。
水为石英亚沸蒸馏水并用Milli-Q50(美国Millipore公司)超纯水仪处理; EDTA钙钠(高效液相色谱专用,Waters公司提供);蔗糖、麦芽糖、葡萄糖、果糖、烟碱标样(Fluka公司生产,含量³ 99%)。
1.2色谱条件
色谱柱:Waters Sugar-Pak-1钙型阳离子交换柱
(6.5´ 300 mm),Waters
Sep-Pak-C18固相微萃取小柱;流动相为:
0.05 g.L-1 EDTA钙钠水溶液,流速为0.5 ml.min-1;柱温85℃;进样量20 m l,样品先通过紫外二级管矩阵检测器,再通过示差检测器。A,B通道同时采集,糖用示差检测器(A通道)记录的色谱图定量,烟碱用紫外检测器(B通道)记录的色谱图定量,紫外检测器的检测波长为273
nm。在该条件下示差检测器记录的色谱图见图1,紫外检测器记录的色谱图见图2。
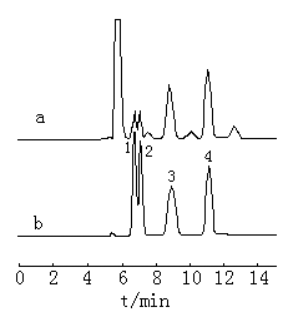
图1 示差检测器记录的标样色谱图和烟草样品色谱图
(a烟草样品,b标样)
1 蔗糖,2 麦芽糖,3 葡萄糖,4果糖
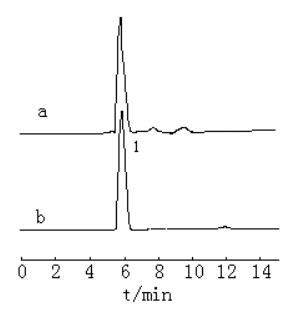
图2
紫外检测器记录的标样色谱图和烟草样品色谱图 (a烟草样品,b标样)
1 烟碱
1.3样品处理
准确称取烟草样品0.5克于50 mL的锥型瓶中,加入5%的醋酸45 mL,用超声波振荡浸取30 min,过滤,滤液定容到50
mL,取5 mL通过活化好的Waters
Sep-Park C18固相萃取小柱,弃去最初的2 ml,收集后面的3 ml用4.5 mm的针头过滤器过滤,进样20 ml分析。
2 结果与讨论
2.1糖和烟碱的提取
根据文献[4,6],烟草中的糖和烟碱可用5%的醋酸提取,用5%的醋酸可使烟草样品中糖和烟碱完全溶出,又可避免因酸性过强而造成烟草中的蔗糖和麦芽糖等二糖或多聚糖水解。我们实验了用超声浸取和振荡浸取提取烟草中的糖和烟碱,实验表明超声浸取效果优于振荡浸取,0.5
g 的烟样用5%的醋酸45 mL浸提,用超声浸取浸取时间在20 min以上样品中的糖和烟碱可完全溶出,而用振荡浸取浸取时间在60
min左右糖和烟碱才能完全溶出;因此本实验选择用45
mL 5%的醋酸超声浸取30 min提取烟草中的糖和烟碱。烟草样品醋酸浸取液中除了有糖和烟碱外,还含有其它成分,如多酚、有机酸,醛类,酮类等,这些物质易附着在柱材料上不被流动相洗脱而降低柱效,多酚有强的紫外吸收,会干扰烟碱的测定,所以在进样之前要预分离这些成分。我们采用Sep-Pak
C18固相萃取小柱预分离,烟草样品醋酸浸取液通过C18固相萃取小柱后,几乎全部的多酚、醛、酮和绝大部分的有机酸能保留在小柱上,而糖和烟碱不保留;用Waters
SPE 真空提取装置,每次可同时处理20个样,小柱活化和样品富集的流速均为10 ml.min-1,小柱用 5 ml乙醇活化,再用10
ml 水洗去乙醇,样品以10 ml.min-1的流速通过小柱,弃去最初的 2 ml,收集后面的3
ml用4.5 mm滤膜过滤,取20
ml进样分析,,这样可分离除去绝大部份的干扰物。
2.2 糖和烟碱的检测
由于糖无紫外吸收,而且在样品中的含量较高,故本实验选用示差折光检测器检测糖;烟碱在样品中的含量相对于糖较低;本实验用5%的醋酸提取,由于提取液和流动相的不一致会在示差检测器上出很大的溶剂峰,烟碱出峰和溶剂峰重叠,因此根据示差检测器记录的色谱图不能测定烟碱;但是烟碱有强烈的紫外吸收,在紫外检测器上出很强的信号,且溶剂中的醋酸紫外吸收很弱,在紫外检测器上溶剂峰很小(见图3),对烟碱的干扰可忽略,因此本实验选用紫外检测器检测烟碱,在本实验的色谱条件下烟碱和去甲基烟碱不能分离,因此测定结果为烟碱和去甲基烟碱的总和;在273
nm波长处烟碱和去甲基烟碱有相近的吸收,且在该波长下溶剂峰小,因此实验选择紫外检测器的检测波长为273
nm。
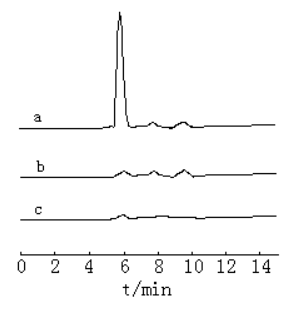
图3 烟草样品提取液和溶剂空白在273
nm处的色谱图
a 烟草样品提取液,b 烟草样品提取液用硅钨酸沉淀除去烟碱,c
5%的醋酸
2.3 流动相的选择
根据色谱柱说明书,Waters Sugar-Pak1钙型阳离子交换柱一般以水作流动相,水中加入少量EDTA钙钠可减少柱材料上的钙离子流失,延长柱的寿命;流动相也可加入少于5%的甲醇,乙晴或四氢呋喃等亲水性有机溶剂。但对于本实验的分离组分,加有机溶剂对分离没有改善作用。因此实验选用0.05
g/L EDTA钙钠水溶液作流动相。
2.4柱温的选择
在室温(18-25℃)下几种成分不能很好的分离,峰型也比较差,而且色谱柱反压大,容易损伤色谱柱(离子交换柱的材料最大压力不能超过1.38´ 104 KPa,在3.45´ 104 KPa - 4.83 ´ 104 KPa之间最好)。柱温保持在70-90℃之间可使几种组分得到较好的分离,故实验控制柱温为85℃。在室温下反压为8.62´ 104
KPa,在85℃时反压仅为4.0´ 104 KPa。
2.5回归方程、相关系数及检测限
用峰面积外标定量法可得各组份的工作曲线;回归方程为见表1。根据信燥比S/N=3,测得个组分最低检测浓度,结果见表1。
组分 |
回归方程 |
线性范围 |
相关系数 |
最低检测浓度 |
RSD% |
蔗糖 |
A=159+1.96 ´105 C(mg/ml) |
10-10000 |
r=0.9998 |
1.5 |
1.2 |
麦芽糖 |
A=101+1.97 ´105 C(mg/ml) |
10-10000 |
r=0.9999 |
1.5 |
1.3 |
葡萄糖 |
A=180+1.77 ´105 C(mg/ml) |
15-10000 |
r=0.9997 |
2.0 |
0.85 |
果糖 |
A=167+1.97 ´105 C(mg/ml) |
20-10000 |
r=0.9999 |
2.0 |
1.5 |
烟碱 |
A=-175+1.663 ´108 C(mg/ml) |
0.05-180 |
r=0.9998 |
0.008 |
1.8 |
2.6样品分析结果
测定了几种烟草样品中的糖和烟碱,结果见表-2。用烟草行业标准(自动分析仪法)对样品中的总糖和总烟碱进行了对照分析,结果见表-2。从表-2分析结果可看出,本方法和行业标准方法分析结果基本相符,但精密度稍差。
表
2 样品分析结果组分 |
样品 (%) |
RSD%(n=5) |
回收率% (n=5) |
|||||
大理 (C3F) |
大理 (X2F) |
玉溪 (C3F) |
玉溪 (X2F) |
卷烟 -1 |
卷烟 -2 |
|||
蔗糖 |
3.23 |
2.52 |
2.82 |
1.76 |
2.16 |
2.12 |
1.6 |
102 |
麦芽糖 |
2.93 |
1.62 |
2.43 |
1.62 |
1.58 |
1.82 |
1.5 |
98 |
葡萄糖 |
13.5 |
8.23 |
11.8 |
7.26 |
9.69 |
10.6 |
1.3 |
99 |
果糖 |
11.6 |
9.12 |
13.2 |
8.31 |
9.71 |
9.36 |
2.2 |
101 |
烟碱 |
2.46 |
1.82 |
2.85 |
2.12 |
2.11 |
1.98 |
1.4 |
97 |
总糖(自动分析仪测定值) |
32.8 |
22.6 |
31.4 |
19.5 |
24.7 |
24.6 |
0.64 |
101 |
烟碱 (自动分析仪测定值) |
2.52 |
1.88 |
2.91 |
2.15 |
2.16 |
2.01 |
0.78 |
99 |
3 结论
本方法用超声浸提,固相萃取预分离,高效液相色谱法同时测定烟草样品中的糖和烟碱,方法便于样品批量处理,简便快速,用烟草行业标准(自动分析仪法)对样品中的总糖和总烟碱进行了对照分析,结果基本相符,说明该方法结果可靠,该方法的建立为烟草中糖和烟碱的同时测定提供了方法。
REFERENCES
[1] Li Hanchao,Wang Shuxian. Tobacco,Smoking Chemistry and Analysis.
Zhengzhou: Henan Science and Technology Press,1991.
[2] Jin Wenbo, Dai Ya. Tobacco Chemistry. Beijing: Qinghua University Press, 1991.
[3] Zhang Huailing, Ge Cuiying. Tobacco Analysis and Inspection. Zhengzhou: Henan Science
and Technology Press, 1994, 252-253.
[4] Z S Troje, Z Frobe, DPerovic. J. Chromatogr. A.
1997, 757 (1):101-107.
[5] Official Methods of Analysis of the Assoc. of official Agriculture Chemist (A.O.A.C.).
Arlington. 14th Ed. 1984, pp 62-63
[6] W R Harvey, C E Badgett, F E Resnik. Tobasso Sci. 1987, 31(1): 19-26