http://www.chemistrymag.org/cji/2006/082010nc.htm |
Feb. 2, 2006 Vol.8 No.2 P.10 Copyright |
N1-3-(4′-Methoxy-phenyl)-5-methyl-isoxazole-1- Acetic Acid Hydrazide
Yan Qinb Liu Fangming* , a ,
b Wang Houyongb Ablajan Keyumeb Shao Lingb
Abstract A series of new
pyrazole and 2-pyrazolin-5-one derivatives were synthesized from the important
intermediate of 3-(4′-methoxy-phenyl)-5-methyl-isoxazole-4-acetic
acid hydrazide. Their structures were identified by IR, 1HNMR,MS and elemental
analysis.Their spectral properties were also discussed.
Keywords isoxazole, pyrazole, Aryl hydrazone
N
(a杭州师范学院化学系, 杭州师范学院有机硅化学及材料技术教育部重点实验室,杭州 310012; b新疆大学化学与化工学院 乌鲁木齐 830046 ) 2006年1月16日收稿;国家自然科学基金(Nos. 29702007, 20162004)资助项目
摘要 本文以关键中间体3-(4′-甲氧基-苯基)-5-甲基-异噁唑-4-甲酰肼(1)分别与2-芳腙-2,3-二氧代丁酸乙酯(2)和2,3,4-戊三酮-3-芳腙(3)在冰醋酸中反应,合成了10个未见文献报道的一系列新型的N1-(3-(4′-甲氧基-苯基)-5-甲基-异噁唑-1-羰甲基)-4-芳基偶氮-2-吡唑啉-5-酮(4a-4e)和N1-(3-(4′-甲氧基-苯基)-5-甲基-异噁唑-1-羰甲基)-4-芳基偶氮吡唑(5a-5e).
化合物结构经IR、1H NMR、MS及元素分析得到确证。
关键词 异噁唑 吡唑 芳腙
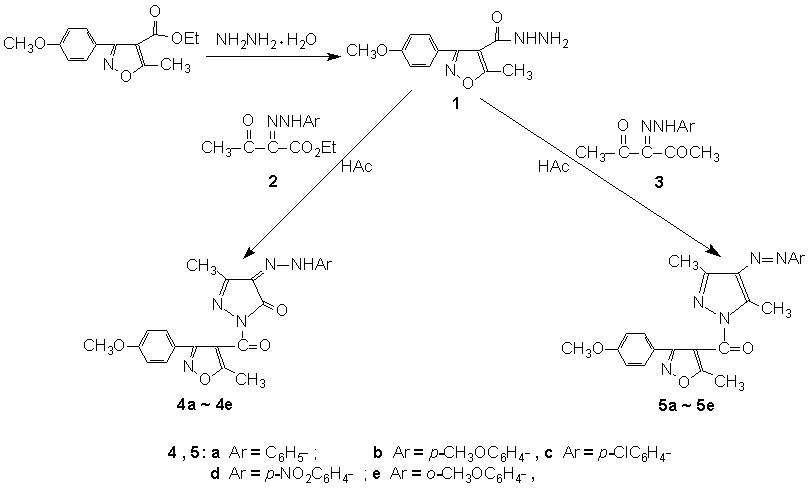
Scheme 1
1. 实验部分
熔点测定使用FP52型显微熔点仪,温度计未校正;IR谱测定采用Biorad FT-40型红外光谱仪(KBr压片).1H NMR谱用Varlan Inova-400型仪器测定(TMS为内标,DMSO- d6做溶剂); MS测定用 HP-5988A型质谱仪(EI源,70 eV), 元素分析用 Perkin-Elmer 2400CHN型元素分析仪.绝对乙醇经过干燥、重蒸处理. 苯胺新蒸处理. 其他试剂及溶剂均系商品用前未经处理.α-氯代对甲氧基苯甲醛肟参照文献[6]制备,取代异噁唑-4-甲酸乙酯参照文献[7]法合成,白色晶体. 产率67 %, m.p. 67-68 ℃(文献值:57-60 ℃)。2-芳腙-2,3-二氧代丁酸乙酯 (2) 和2,3,4-戊三酮-3-芳腙 (3) 的合成,参照文献[8,9]制备。
1.2 3-(4′-甲氧基-苯基-5′-甲基-异噁唑)-4-酰肼(1)[10]的合成
将0.03 mol 3-(4′-甲氧基-苯基)-5-甲基-异噁唑-4-甲酸乙酯与0.13 mol 85%的水合肼,在15 mL无水乙醇中,加热回流4 h,冷却至室温,析出大量固体.减压过滤,室温干燥,再用乙醇重结晶,减压过滤,室温干燥,得白色片状晶体.m.p.166~168 ℃,产率60 %.
1.3 N1-(3-(4′-甲氧基-苯基)-5-甲基-异噁唑-1-羰甲基)-3-甲基-4-芳偶氮-2-吡唑啉-5-酮 (4a-4e)和N1-(3-(4′-甲氧基-苯基)-5-甲基-异噁唑-1-羰甲基)-3.5-二甲基-4-芳偶氮吡唑(5a-5e)的合成
取1 mmol芳腙衍生物2或3, 分别与1.1 mmol酰肼 (1) 在5 mL冰醋酸中回流6~8h, 在反应过程中即有有色固体出现, 反应结束后, 冷却, 放置过夜, 抽滤, 所得粗产物用DMF-H2O或95%乙醇重结晶, 得目标化合物4和5。
4a: 深黄色晶体,产率75%, m.p. 157-159 ℃; 1H NMR (DMSO, 400 MHz)δ: 12.92 (s, 1H, N-H), 7.94-6.98 (m,9H,Ar-H), 3.75 (s, 3H, OCH3), 2.49 (s, 3H, CH3), 2.27 (s, 3H, CH3); IR (KBr)υ: 3151(N-H), 1731(C=O), 1614 (Ar-H), 1596 (C=N, C=C) cm-1; MS (70 eV) m/z (%): 417 (2.27), 296 (0.19), 216 (4.80), 174 (23.22), 92 (10.97), 43(100); Anal. calcd for C22H19N5O4 : C 63.30, H 4.59, N 16.18; found C 63.28, H 4.56, N 16.22 .
4b: 无色晶体,产率68 %, m.p. 238-240 ℃; 1H NMR (DMSO, 400 MHz) δ: 12.88 (s, 1H, N-H), 7.98~6.95 (m, 8H, Ar-H),3.80(s, 3H, OCH3), 3.75 (s, 3H, OCH3), 2.51 (s, 3H, CH3), 2.20 (s, 3H, CH3); IR (KBr)υ: 3158 (N-H), 1725 (C=O), 1620 (Ar-H), 1579 (C=N, C=C) cm-1; MS (70 eV) m/z (%): 447 (2.11), 326 (0.37), 216 (5.30), 174 (25.36), 92 (14.39), 43 (100); Anal. calcd for C23H21N5O5 : C 61.74, H 4.73, N 15.65 ; found C 61.80, H 4.72, N 15.67 .
4c: 淡黄色晶体,产率 59 %, m.p. 209-211 ℃; 1H NMR (DMSO, 400 MHz) δ: 12.93 (s, 1H, N-H), 7.83-6.99 (m, 8H, Ar-H), 3.76 (s, 3H, OCH3), 2.49 (s, 3H, CH3), 2.29 (s, 3H, CH3); IR (KBr)υ: 3169 (N-H), 1743(C=O), 1618(Ar-H), 1583(C=N, C=C)cm-1; MS (70 eV) m/z (%): 451(1.72), 231(0.77), 216 (15.39), 174 (100), 92 (4.34), 43 (32.30); Anal. calcd for C22H18ClN5O4 : C 58.48, H 4.02, N 15.50 ; found C 58.51, H 3.99, N 15.48 .
4d: 黄色粉末,产率70 %, m.p. 196-199 ℃; 1H NMR (DMSO, 400 MHz) δ: 12.95 (s, 1H, N-H), 8.12-7.13 (m, 8H, Ar-H), 3.75 (s, 3H, OCH3), 2.49 (s, 3H, CH3), 2.27 (s, 3H, CH3); IR (KBr)υ: 3140 (N-H), 1750 (C=O), 1605 (Ar-H), 1595 (C=N, C=C), 1363 (NO2) cm-1; MS (70 eV) m/z (%): 462 (0.78), 341 (0.95), 216 (18.65), 174 (11.60), 92 (19.46), 43 (43.23); Anal. calcd for C22H18N6O6 : C 58.48, H 3.92, N 18.17 ; found C 58.51, H 3.94, N 18.20 .
4e: 黄色粉末,产率 65 %, m.p. 168-172 ℃; 1H NMR (DMSO, 400 MHz) δ: 12.94 (s, 1H, N-H), 7.89-6.88 (m, 8H, Ar-H), 3.77 (s, 3H, OCH3), 3.74 (s, 3H, OCH3), 2.49(s, 3H, CH3), 2.30 (s, 3H, CH3); IR (KBr)υ: 3176 (N-H), 1725 (C=O), 1618 (Ar-H), 1577 (C=N, C=C) cm-1; MS (70 eV) m/z (%): 447 (0.53), 216 (14.35), 174 (59.86), 92 (13.23), 43 (100); Anal. calcd for C23H21N5O5 : C 61.74, H 4.73, N 15.65 ; found C 61.75, H 4.73, N 15.68 .
5a: 黄色晶体,产率72 %, m.p. 149-150 ℃; 1H NMR (DMSO, 400 MHz) δ: 7.72-6.98 (m, 9H, Ar-H), 3.75 (s, 3H, OCH3), 2.70 (s, 6H, CH3), 2.15(s, 3H, CH3); IR (KBr)υ: 1733(C=O), 1613 (Ar-H), 1550 (C=N, C=C)cm-1; MS (70 eV) m/z (%): 415 (1.72), 216 (15.14), 174 (100), 92 (3.63), 43 (26.14); Anal. calcd for C23H21N5O3 : C 66.49, H 5.09, N 16.86 ; found C 66.50 ,H 5.07, N 16.88 .
5b: 白色粉末,产率 68 %, m.p. 239-242 ℃; 1H NMR (DMSO, 400 MHz) δ: 7.79-6.98 (m, 9H, Ar-H), 3.73 (s, 3H, OCH3), 3.70 (s, 3H, OCH3), 2.71 (s, 6H, CH3), 2.20 (s, 3H, CH3); IR (KBr)υ: 1730 (C=O), 1608(Ar-H), 1547 (C=N, C=C) cm-1; MS (70 eV) m/z (%): 445 (1.23), 216 (20.56), 174 (100), 92 (72.39), 43 (32.55); Anal. calcd for C24H23N5O4 : C 64.71, H 5.20, N 15.72 ; found C 64.74, H 5.16, N 15.70 .
5c: 黄色晶体,产率 60 %, m.p. 235-238 ℃; 1H NMR (DMSO, 400 MHz) δ: 7.59-6.92 (m, 8H, Ar-H), 3.77 (s, 3H, OCH3), 2.72 (s, 6H, CH3), 2.24 (s, 3H, CH3); IR(KBr)υ: 1725(C=O), 1603 (Ar-H), 1542 (C=N,C=C) cm-1; MS (70 eV)m/z (%): 451(0.76), 449 (2.31), 216 (16.62), 174 (100), 92 (25.76), 43 (45.32); Anal. calcd for C23H20ClN5O3 : C 61.40,H 4.48,N 15.57 ; found C 61.38, H 4.59, N 15.57.
5d: 深黄色晶体,产率 73 %, m.p. 205-207 ℃; 1H NMR (DMSO, 400 MHz) δ: 8.11-7.03 (m, 8H, Ar-H), 3.77 (s, 3H, OCH3), 2.76 (s, 6H, CH3), 2.13 (s, 3H, CH3); IR (KBr)υ: 1723(C=O), 1598 (Ar-H), 1535 (C=N, C=C) cm-1; MS(70 eV) m/z (%): 460(0.98), 216(18.94), 174(100), 92 (4.57), 43 (32.74); Anal. calcd for C23H20N6O5 : C 60.03, H 4.38, N 18.25 ; found C 60.05, H 4.38, N 18.23.
5e: 黄色晶体, 产率 65 %, m.p. 126-128 ℃; 1H NMR (DMSO, 400 MHz)δ: 7.52-6.88 (m, 8H, Ar-H), 3.75 (s, 3H, OCH3), 3.70 (s, 3H, OCH3), 2.68 (s, 6H, CH3), 2.17 (s, 3H, CH3); IR (KBr)υ: 1730 (C=O), 1609 (Ar-H), 1545(C=N, C=C) cm-1; MS (70 eV) m/z (%): 445 (1.12), 216 (17.32), 174(100), 92(5.53), 43(18.23); Anal. calcd for C24H23N5O4 : C 64.71, H 5.20, N 15.72 ; found C 64.70, H 5.20, N 15.71 .
2 结果与讨论
N1-酰基吡唑类化合物的合成主要通过酰肼与β-二酮在质子酸催化下脱水环化来完成的,一般较为常用的酸性体系有HOAc和浓HCl/乙醇溶液。研究表明,该反应是分步进行的,首先生成异恶唑的酰腙化合物,然后再环化脱水生成吡唑衍生物。质子酸在反应中至关重要,若无质子酸参与反应,则只能生成开环的酰腙。这是由于酰肼中的两个亲核氮原子的亲核活性不同,其中酰肼基中的-NH2具有一般的氨基活性,在没有质子酸的存在下,仍可与羰基缩合,而-NH-中的氮原子由于受羰基影响,其活性下降,要使它与羰基发生反应,必须有质子先将羰基活化。我们采用酰肼与β-二酮类化合物直接在HOAc中反应, HOAc既作溶剂也作催化剂, 操作较为方便。
2.2 IR光谱
芳氧基乙酰芳胺中 C=O的伸缩振动频率一般在1680 cm-1附近,而在化合物的IR光谱中,C=O的吸收峰在1730 cm-1附近。其主要原因是:与羧基相邻的氮原子上的孤对电子,直接参与吡唑环的共轭体系,因此大大减弱了其与羰基的p-π共轭效应,故使得羰基的双键性增强,振动频率向高波数转移。在化合物5的红外图谱中, 1615 cm-1附近的弱吸收峰为芳环的C-H吸收峰, υc=o位于1650 cm-1左右, υN=N则位于1590 cm-1附近, 化合物4的红外吸收峰与化合物5的大致相同, 只是在3140~3180 cm-1范围内出现了较强的N-H吸收峰。
2.3 1H NMR谱
在1H NMR中,在化合物4中,3位CH3质子的吸收峰位于2.50附近,较化合物5中3位CH3质子吸收峰向高场移动约0.2,化合物4中的N-H质子由于形成的分子内氢键, 而位于12.90 ppm左右,3位CH3和5位CH3质子吸收峰均出现在2.70左右。文献[5]中指出,当N1上直接连有芳环时,由于5位CH3质子受到此芳环的去屏蔽效应影响而较3位CH3质子向低场移约0.3,这主要是由于吡唑啉酮为非芳环,而吡唑环为芳香环。当N1上直接连有芳酰基时,由于羰基的存在,5位CH3质子无法受到芳环的去屏蔽作用,因而与3位CH3质子吸收峰重叠。
2.5 MS谱
在对化合物4和5的电子轰击质谱中发现,它们的分子离子峰都非常弱,裂解途径相似,而且比较简单,均出现了较强的[M-121]、[M-121-Ar], 主要是N1上的酰基首先断裂产生[M-ArCO]碎片,然后再进一步裂解分别产生[M-ArCO-Ar]以及[M-ArCO-Ar-28]。基峰碎片大部分为[M-ArCO-Ar]。 REFERENCES
[1] LIU B, GAO H Q, ZHOU T J. Organic chemistry (Youji Huaxue), 1994, 14: 206.
[2] ZHOU Y H, MIAO W R, CHEN L B et al. Chemical journal of Chinese universities(Gaodeng Xuexiao Huaxue Xuebao); 2003, 24: 1225.
[3] LIU F M, LU W J, ZHANG Z F et al. Chemistry Online(Huaxue Tongbao(Wangluoban) );1999, 13: 99054
[4] David J Burkhart, Paiwe Zhou et al. Tetrahedron, 2001, 57: 8039.
[5] S P Singh, D Kumar, M Threadgill. Indian J. Chem., 1992, 31B(2): 233.
[6] HUANG R Q, SUN J Y, MA J A et al. Chinese Journal of Applied Chemistry(Yingyong Huaxue), 1998, 15 (1): 9.
[7] F P Doyle, J C Hanson, A A W Long et al. J. Am. Chem. Soc., 1963, 85: 5845.
[8] H G Garg, S S Joshi. J. Indian Chem. Soc., 1960, 37: 626.
[9] H G Garg, P P Singh. J. Chem. Soc., 1969: 1141.
[10] LIU F M, YU J X, LIU Y T et al. Acta Chimia Sinica(Huaxue Xuebao), 1998, 56: 618.