http://www.chemistrymag.org/cji/2006/082011pc.htm |
Feb.12, 2006 Vol.8 No.2 P.11 Copyright |
Zhang
Qijiana,Zhou Yingchuna, He
Dehuab,Zhu Qimingb
(a Department of Material and Chemical Engineering, Liaoning Institute of
Technology, Jinzhou Liaoning, 121001;b Depatment of Chemistry,Tsinghua University, Beijing, 100084)
Abstract A simulation of
homogeneous partial oxidation of methane to methanol by CHEMKIN-III Gas-Phase Mechanism
Interpreter was carried out. The content of different species as functions of time and the
effect of pressure, temperature and CH4/O2 ratio were specially
discussed. HCHO was found the initial product, but it is easy to be oxidized to CO and its
selectivity decreased very quickly when the conversion of CH4 or O2
was increasing. When O2 was completely consumed, the conversion of CH4
and the selectivity of products reached a stable state. CO was predominate product while
the amount of required production of methanol was, unexpectedly, very small. In order to
improve methanol selectivity, it is necessary to control the oxidation of the intermediate
CH3O·. In additional, high pressure and CH4/O2
ratio were favorable to the production of methanol, which was consistent with the
experimental results.
Keyword Methane、Methanol、Homogeneous oxidation、Simulation、CHEMKIN-III
甲烷气相均相选择氧化制甲醇
-CHEMKIN-III模拟计算 张启俭a * ,周迎春a,贺德华b,朱起明b(a辽宁工学院 材料与化工学院,辽宁,锦州,121001;b清华大学 化学系,北京,100084)
摘要
本文利用CHEMKIN-III Gas-Phase Mechanism Interpreter对甲烷气相部分氧化进行了模拟计算,重点考察了各主要物种随反应时间的变化以及反应压力、烷氧比和反应温度对甲烷部分氧化的影响。在O2完全反应的情况下,产物分布达稳态,但产物中CO为主要产物,目标产物甲醇的量很少。为了提高甲醇的产量,必需控制中间物种CH3OO·的反应,使其发生还原生成甲醇,而不是氧化生成HCHO进而生成CO。另外,高压、高烷氧比有利于部分氧化产物甲醇的选择性,这一结论与实验结果相同。关键词 甲烷、甲醇、气相氧化、模拟计算、CHEMKIN-III
甲烷选择氧化制甲醇是天然气转化利用的最佳途径,但由于产物甲醇比反应物甲烷更加不稳定,更加容易在催化剂上被活化,所以甲烷催化氧化制甲醇的研究一直没有大的突破,相反,甲烷的气相均相选择氧化制甲醇的研究不时有较高收率的报道[1,2,3],所以有观点认为“没有催化剂才是该反应最佳的催化剂”。
甲烷气相均相氧化制甲醇反应遵循自由基链反应机理,针对该反应人们进行了大量的研究工作,但不同的研究者往往提出不同的机理模型以使模拟计算的结果与自己的实验结果相符合,或是对机理模型中的相关反应进行修正,希望达到机理模型与自己的实验事实相自洽[4,5]。由于产物分布对反应条件,特别是对反应器壁表面氧化物的存在很敏感,不同研究者的实验结果之间往往存在着比较大的差异,在目前所提出的上百个基元步骤中,对主要的反应途径的认定还有所不同,尚需要进一步的探讨。
为了更清楚地了解甲烷气相均相选择氧化反应的情况,探明可操作条件(温度、压力、烷氧比等)对反应的影响,以指导均相氧化的研究,并为催化氧化的发展提供参考,本文利用CHEMKIN-III Gas-Phase Mechanism Interpreter对甲烷气相氧化反应进行了模拟计算。
1. 计算方法
(1)反应的引发:
CH4 + M ® × CH3 + H× + M
其中M代表惰性分子(如不参加反应的CH4,N2)或反应器壁。
CH4 + O2 ® × CH3 + HO2×
(2)反应的进行
× CH3 + O2 ® CH3OO×
CH3 + O2 ® HCHO + OH×
·CH3 + O2 ® CH3O× + O×
CH3OO× ® × CH3 + O2
CH3OO× ® CH3O× + O×
CH3OO× ® HCHO + OH×
CH3OO× + CH4 ® CH3OOH + × CH3
CH3OOH ® CH3O× + OH×
CH3O× + CH4 ® CH3OH + × CH3
CH3O× + O2 ® HCHO + HO2×
CH3O× + M ® HCHO + H× + M
CH3OH + O2 ® × CH2OH + HO2×
× CH2OH + O2 ® HCHO + HO2×
× CH2OH + M ® HCHO + H× + M
HCHO + O2 ® HCO× + HO2×
HCHO + HO2× ® H2O2 + HCO×
HCHO + × OH ® HCO× + H2O
HCO× + O2 ® CO + HO2×
HCO + × OH ® CO× + H2O
HCO× + M ® CO + H× + M
CO + O2 ® CO2 + O×
CH4 + HO2× ® × CH3 + H2O2
H2O2 + M ® 2× OH + M
CH4 + × OH ® × CH3 + H2O
CH4 + × OH ® × CH3 + H2O
CH4 + H× ® × CH3 + H2
CH4 + O ® × CH3 + × OH
CH3OO× + H2O2 ® CH3OOH + HO2×
CH3OO× + HO2× ® CH3OOH + O2
CH3OO× + H2 ® CH3OOH + H×
CH3OO× + CH3O× ® CH3OOH + HCHO
CH3OO× + CH3OH ® CH3OOH + × CH2OH
CH3OO× + × CH2OH ® CH3OOH + HCHO
CH3OO× + HCHO ® CH3OOH + CHO×
HO2× + CH3OH ® H2O2 + × CH2OH
HO2× + × CH2OH ® H2O2 + HCHO
HO2× + HO2× ® H2O2 + O2
HCHO + O ® HCO× + × OH
2CH3OO× ® 2CH3O× + O2
CH3OO× + × CH3 ® 2CH3O×
CH3OO× + H× ® CH3O× + × OH
CH3OOH + H× ® CH3O× + H2O
CH3O× + H2 ® CH3OH + H×
CH3O× + HO2× ® CH3OH +O2
CH3O× + H2O2 ® CH3OH +HO2×
CH3O× + HCHO ® CH3OH + HCO×
CH3O× + CH3O× ® CH3OH + HCHO
CH3O× + CH3OH ® CH3OH + × CH2OH
CH3O× + H× ® HCHO+H2
CH3O× + × OH ® HCHO+H2O
CH3OH + × OH ® × CH2OH + H2O
CH3OH + H× ® × CH2OH + H2
CH3OH + × CH3 ® × CH2OH + CH4
× CH2OH + × CH3 ® HCHO + CH4
HCHO + H× ® HCO× + H2
HCHO + × CH3 ® HCO× + CH4
HCHO + × CH2OH ® HCO× + CH3OH
HCO× + H× ® CO + H2
HCO× + × CH3 ® CO + CH4
HCO× + × OH ® CO + H2O
HCO× + O ® CO + × OH
CO + CH3O× ® CO2 + CH3×
CO + × OH ® CO2 + H×
CO + HO2× ® CO2 + × OH
CO + CH3OO× ® CO2 + CH3O×
CO + O + M ® CO2 + M
HCO× + O ® CO2 + H×
HCO× + HO2× ® CO2 + H× + OH×
·CH3 +× CH3 ® C2H6
HO2× + M ® O2 + H× + M
HO2× + O ® O2 + × OH
HO2× + H× ® 2× OH
HO2× + H2 ® H2O2 + H×
H2O + H× ® H2 + × OH
H2O + O ® 2× OH
H2 + × OH ® H2O + H×
H2 + O ® × OH + H×
O2 + H× ® × OH + O
CH3OH + × CH3 ® CH3O× + CH4
* 除特别指出,本文速率常数表达式 k=Aexp(-E/RT )中,指前因子A的单位对于单分子和双分子反应分别为s-1和cm3·mol-1·s-1;E的单位为kJ·mol-1。
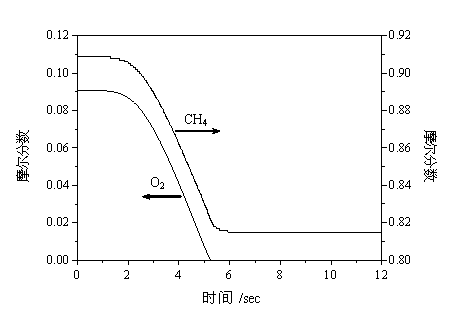
图1 O2和CH4浓度随反应时间的变化情况
Fig.1 Concentrations of O2and CH4 as functions of time
P=6.0MPa, T=770K(497℃), CH4/O2=10/1
2. 结果与讨论
取反应温度为770K,反应压力为6.0MPa,利用CHEMKIN-III进行模拟计算计算不同压力、不同烷氧比等条件下体系中各物种随时间的变化。在起始烷氧比CH4/O2=10的条件下,O2和CH4在整个体系中的摩尔分数(即浓度)随反应时间变化的情况如图1所示。反应明显存在一引导期,在开始大约2秒的时间内,O2和CH4的浓度都没有明显的变化。在2秒以后,二者开始迅速降低,特别是在3秒以后直到O2完全耗尽,O2和CH4浓度降低的幅度与时间成陡峭的线形关系,说明反应在剧烈进行,到大约5.3秒的时候,O2完全消耗,CH4的浓度也稳定下来。引导期的存在,说明体系中自由基的浓度需要积累到一定的程度,才能引发剧烈的链锁反应。在流动体系中(通常的实验条件下),当尾气中反映出O2完全反应的时候,在反应器内部总会存在一定的空间区域,其中的自由基的浓度维持在比较高的水平,当新反应气体进入该区域的时候,不必经过引导期,反应即可迅速进行。
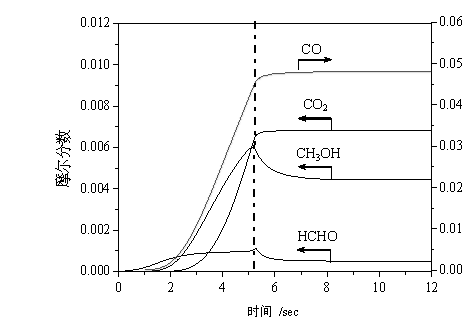
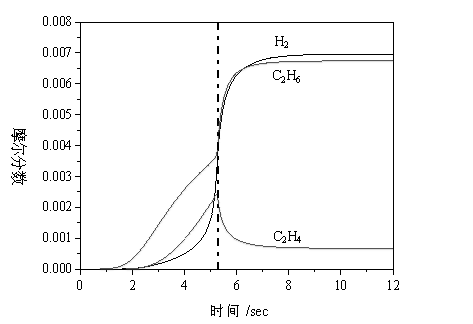
图2 各产物浓度随反应时间的变化情况
Fig.2 Concentrations of products as functions of time
P=6.0MPa, T=770K(497℃), CH4/O2=10/1
各产物的浓度随时间的变化如图2所示,HCHO在反应的初期即开始生成,随着反应的进行,CO、CH3OH、C2H6、CO2、C2H4、H2等产物相继出现,它们在体系中的浓度也随着O2的消耗逐渐增大。在O2将要完全转化的时候,甲醇的浓度达到一最大值,之后就开始下降并慢慢趋于平稳。C2H4的浓度与甲醇的类似,但C2H6的情况则有所不同,在O2完全反应前,其浓度随反应的进行慢慢增加,当O2完全消失的时候,C2H6的浓度突然大幅增加,然后在很短的时间内趋于平稳。这是·CH3与O2的反应(R1)与·CH3与·CH3之间的耦合反应(R2)相竞争的结果,在O2分子消失的时候,?CH3必然会相互结合而生成C2H6,使得C2H6的生成速度大大增加。
·CH3+O2 →·CH3OO· (R1)
·CH3+·CH3 → C2H6
(R2)
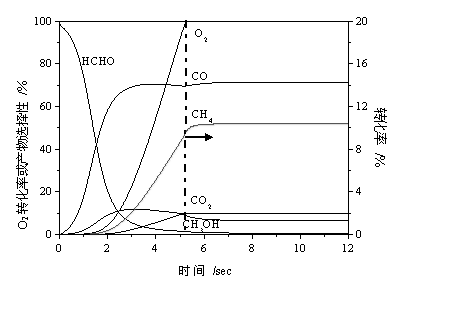
图3 体系中各物种转化率或选择性随反应时间变化情况
Fig.3 Conversion or
selectivity of molecules as functions of time
P=6.0MPa, T=770K(497℃), CH4/O2=10/1
由产物选择性的变化看(图3),甲醛是反应的初始产物,说明HCHO可以直接经由?CH3生成,但此时反应物转化率极低,HCHO生成的量特别少。随着反应进行,HCHO的选择性又急剧下降,同时CO选择性迅速提高并逐渐占据主导地位,说明CO是由HCHO氧化生成。
在O2转化率上升到10%左右的时候,HCHO的选择性已经降低到非常低的水平(10%左右)。当O2完全消耗的时候,HCHO的选择性降低至可以忽略,所以在实际实验中基本上不能检测到HCHO。但是在有些报导中(如Chun和Anthony等[6,7]),HCHO存在于产物,为了将模拟计算的结果与实验结果相符合,Chun等人在其机理模型中,将相关基元反应的指前因子上又乘了一个“增强因子”。本文认为,产物中HCHO的出现很可能是反应体系内部某些金属氧化物的存在导致反应后期甲醇的分解生成,而不是气相反应的结果。因为在我们的实验中,基本消除了金属的影响,在反应产物中也并没有检测到HCHO[1]。
在模拟计算的结果中,在反应的初始引发阶段,并没有目标产物甲醇生成,甲醇是随着反应的进行逐渐出现的,并在O2完全消耗的瞬间达到最大值,考虑到CO的浓度在此时小幅降低,说明甲醇和HCHO是由同一中间物经平行反应而分别生成的,该中间物一般认为是CH3O?,所以在甲烷部分氧化反应中,CH3O?的生成与反应是需要重点考虑的问题,我们认为要提高目标产物甲醇的选择性,就一定要控制CH3O?向着还原的方向进行,同时避免或限制其氧化反应。所以在反应中加入还原性气体,能够提高甲醇的选择性,Chellappa AS 等人也指出过这一点[2]。
2.2 反应压力的影响
反应压力对甲烷的氧化反应有着非常大的影响,图4A列出了不同压力下,模拟计算的O2转化率和甲醇选择性随反应时间的变化趋势,压力降低,O2完全反应所需的时间就会增加,即反应速度降低了。由于实验中一般采取固定的停留时间,
O2完全反应所需的反应温度要相应提高。而在O2完全消耗以后,甲醇的选择性也随着压力的降低而降低,说明低压明显不利于甲醇的生成,这与一般的实验结果是相吻合的。
再看CO和CO2的变化情况(图4B),CO的选择性随压力的降低而有所升高,这一点与实验结果相一致,但CO2的选择性则比较特别,随压力的降低反而有所降低,这与实验结果有比较大的差别,说明尚有一些影响因素需要进一步的研究,对于机理模型也需要作进一步的改进。
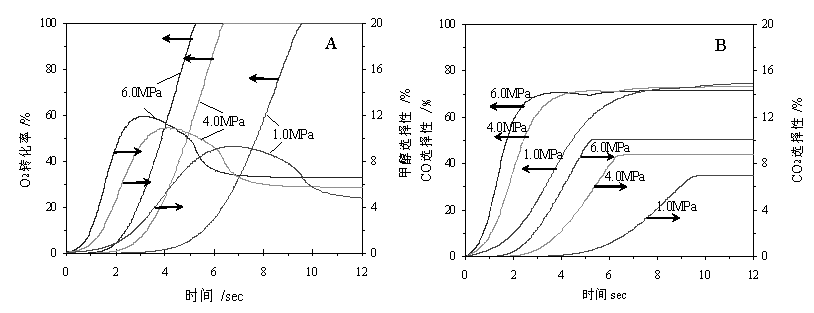
图4 反应压力对O2转化率和甲醇及CO、CO2选择性的影响
Fig.4 Effect of pressure on
conversion of O2 and selectivity of CH3OH, CO and CO2
T=770K(497℃), CH4/O2=10/1
2.3 烷氧比的影响
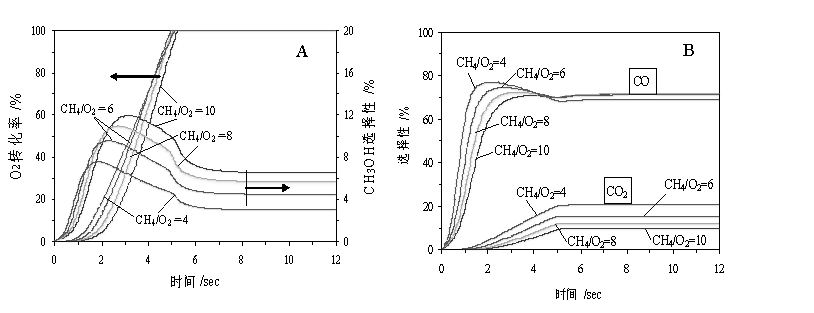
图5 烷氧比对O2转化率和甲醇、COx选择性的影响
Fig.5 Effect of CH4/O2 ratio on conversion of O2 and selectivity of CH3OH and COx
P=6.0MPa, T=770K(497℃)
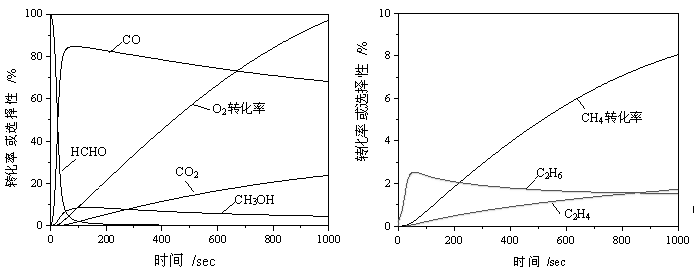
图6 低温下反应物转化率与产物选择性随反应时间变化情况
Fig.6 Conversion of reactants and selectivity of products as functions of time at lower Temperature
P=6.0MPa, T=670K(397℃), CH4/O2=10/1
2.4 反应温度的影响
反应温度对自由基反应的影响很大,对于甲烷氧化反应,由于CH4分子的特殊稳定性,需要比较高的温度才能使反应得以进行。在770K,5.0MPa压力下,CH4/O2=10的时候,O2完全反应所需的时间不到6秒,但在670K温度下,其它条件不变,即使将反应时间延长到1000秒,O2依然没有完全反应(图6)。说明在670K,反应进行的非常缓慢,反应的引导期太长,不利于自由基链锁反应的进行。从产物的分布看,HCHO依然是反应的初始产物,但随着反应的进行,其选择性迅速降低,同时CO的选择性大大升高,这也说明CO是从HCHO进一步氧化而来。随反应时间的延长,O2的转化率逐渐升高,CO和CH3OH的选择性都在逐渐降低,而CO2的选择性却在慢慢升高,这说明在O2没有完全反应之前,反应时间的延长,有利于热力学稳定产物的生成,因为时间越长,反应就会越趋向于平衡状态。同时注意到产物中C2产物的生成被抑制在很低的水平,而这主要是因为温度的降低使体系中
CH3浓度大大降低的缘故。
当反应温度为870K,其它条件不变的时候,O2完全反应在不到半秒种的时间内就告完成,由于反应发生得太快,CO的选择性不再象770K和670K时那样先达到一最高值而后略微降低,而是一直在升高,虽然在O2完全反应的时候发生了一些变化,但依然保持增高的趋势,并最终趋于相对的稳定值(图7)。其它产物的变化趋势则与770K的情况差不多,不过C2H6和C2H4的选择性与770K时的相比有较大幅度的提高,这是因为高温有利于?CH3自由基的稳定,C2H6的生成量必然会提高。
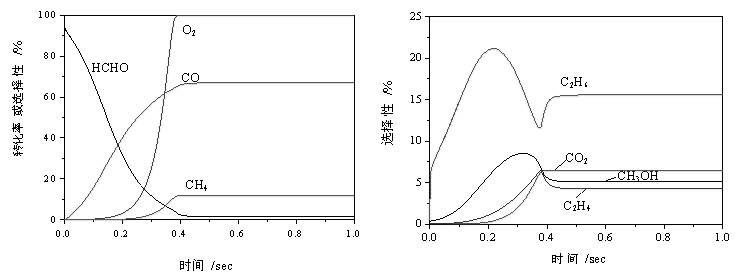
图7
高温下反应物转化率与产物选择性随反应时间变化情况
Fig.7 Conversions and
selectivity as functions of time at higher temperature
P=6.0MPa, T=870K(597℃),
CH4/O2=10/1
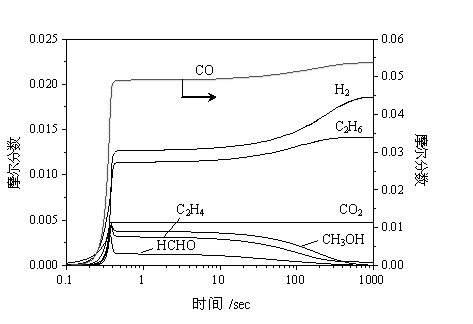
图8 产物摩尔分数随反应时间变化情况
Fig.8 Concentrations of
molecules as functions of time
P=6.0MPa, T=870K(597℃),
CH4/O2=10/1
由于870K的温度过高,有可能使反应更加趋向于平衡状态。将反应时间延长到1000秒进行分析(图8),可以发现在O2完全反应以后,在一定的时间内产物的分布是稳定的,但当反应时间超过10秒以后,各产物在体系中的摩尔分数开始发生变化,HCHO,CH3OH和C2H4等物种逐渐减少,而CO、H2和C2H6等却逐渐增加,不过CO2的摩尔分数没有发生什么变化。这可能是因为在此温度下,当反应时间很长的时候,HCHO和CH3OH不稳定,有可能发生分解反应而生成更加稳定的CO和H2,而H2又会与C2H4发生加成反应,同样导致C2H4的减少,C2H6的增加。这一点与通常的实验结果是一致的,甲烷选择氧化制甲醇反应温度太低则活性差,而太高则选择性差。另外由于此时体系中已经没有O2存在,也就不会有强氧化性物种能将CO氧化成CO2,所以CO2的浓度不会发生变化。
3. 结论
HCHO在反应引发阶段即有生成,但随反应的进行,由于其很容易被氧化生成CO,在产物中的浓度就一直维持在很低的水平。CH3OH与HCHO经由平行反应分别生成,CH3OH在产物中的浓度逐渐升高,但当O2完全消耗以后,其选择性则有所降低。总的来讲CH3OH的选择性很低。压力的提高,会降低O2完全反应所需要的时间,在流动反应器中,可以降低O2完全反应的温度,同时提高压力也会提高目标产物CH3OH的选择性。
降低烷氧比,即提高原料气中O2的浓度,会降低甲醇的选择性,提高CO2的选择性。
致谢
感谢日本地球环境产业技术研究所催化研究室姚水良博士在CHEMKIN模拟计算方面给予的帮助。 REFERENCES[1] Qijian Zhang, Dehua He, Jinlu Li et al. Appl. Catal. A: General, 2002, 224(1-2): 201-207.
[2] Chellappa AS, Fuangfoo S, Viswanath DS. Ind. Eng. Chem. Res. 1997, 36: 1401-1409.
[3] Hunter N.R., Gesser H.D., Morton L.A., Yarlagadda P.S. Appl. Catal. 1990, 57: 45-54.
[4] B F Gray, J.F. Griffiths, G.A. Foulds, et al. Ind. Eng. Chem. Res., 1994, 33(5): 1126-1135.
[5] J C Mackie. Catal. Rev. –Sci. Eng. 1991, 33(1-2): 169-240.
[6] Chun J W, Anthony R.G. Ind. Eng. Chem. Res. 1993, 32: 788-795.
[7] Chun J W, Anthony R.G. Ind. Eng. Chem. Res. 1993, 32: 796-799.