http://www.chemistrymag.org/cji/2006/084024rc.htm |
Apr. 2, 2006 Vol.8 No.4 P.24 Copyright |
(Anhui Key Laboratory of Functional Molecular Solids, College of Chemistry and Materials Science, Anhui Normal University, Wuhu 241000)
Abstract Since the discovery and large scale preparation of [60]fullerene, the chemistry of fullerenes has become one of the most developing fields in organic chemistry. Polymeric fullerenes formed by polymerization of the fullerene spheroid possessed unique physical properties, which pioneer one of the new directions for the design of new pattern promising materials based on fullerenes. The progress on the synthesis, magnetic properties and applications of polymeric fullerenes in current years were reviewed.
Keywords Fullerenes, Polymerization, Magnetic property 聚合富勒烯研究进展 李楠庭 魏先文
(安徽省功能性分子固体重点实验室 安徽师范大学化学与材料科学学院 芜湖 241000) 摘要 自从C60被发现尤其是发展出宏量制备方法以来,富勒烯化学已成为有机化学学科发展最快的领域之一。富勒烯通过聚合反应形成具有独特物理性能的富勒烯聚合体,为设计合成新型富勒烯基功能材料开辟了新方向。本文综述了聚合富勒烯的合成方法、磁性能及应用进展。
关键词 富勒烯 聚合反应 磁性
很久以来,人们一直认为碳元素只有两种同素异形体,即柔软的石墨和坚硬的金刚石,但1985年美国科学家Curl、Smalley以及英国科学家Kroto意外地发现了碳元素的第三种同素异形体----以C60和C70为代表的富勒烯。自从1990年Kraschmer和Huffman等采用石墨棒电弧蒸发的方法制备和分离出克量级的C60之后,C60的各种研究以空前的速度向前发展。迄今为止,C60的研究领域已涉及到有机化学、无机化学、生命科学、材料科学、高分子科学、催化化学、电化学、超导体等众多学科和应用研究领域,并越来越显示出其巨大的潜力和重要的研究价值。在众多的富勒烯衍生物中,富勒烯聚合物已成为一个新的研究热点,目前有两类聚合富勒烯:一类是O、S、Si和C桥联接的二聚或多聚富勒烯[1];另一类是在富勒烯碳笼之间直接靠单键连接或[2+2]环加成反应形成的聚合富勒烯。后一类型的聚合富勒烯具有一些不寻常的特性,尤其是磁性,使它将来可以用于光电子计算机存储和记录信息的元器件材料,本文综述了这类聚合富勒烯的合成方法、性能及应用进展。
1 聚合富勒烯的合成
富勒烯碳笼之间直接单键连接或[2+2]加成连接形成聚合富勒烯,其制备方法主要有还原法、高温高压法、光诱导法、高速振动碾磨法等。
1.1 固相还原聚合
C60是缺电子烯烃,容易获得电子形成负离子,具有超导电性、磁性等特性。1991年Haddon等将化学计量的C60和金属钾的混合物封闭在石英毛细管里加热到260℃,80天后意外地制得了粉末状的聚合产物(K1C60)n
[2]。后来Pekker 等[3]在固相条件下,利用C60阴离子可逆[2+2]环加成反应合成了斜方晶系聚合物(A1C60)n,其中C60阴离子是线型聚合物(图1),已被XRD数据证实。研究发现,这样的富勒烯桥联排列结构能够表现出尺寸上的多样性和令人感兴趣的类似于金属性的电学和室温铁磁性的特性。正因为如此,(A1C60)n
(A=K, Rb 和Cs)类型的化合物成为了研究的热点。例如,导电聚合物(K1C60)n可培养成十分之几毫米长的单晶,其聚合度超过了100,000[4]。现在也可以通过共蒸发方法制备(K1C60)n单晶:即把化学计量的C60和K封装在石英管里,在温度梯度变化的炉子里加热,C60和K分别被加热到600℃和150℃,经过几个小时地加热,在炉中大约300℃的区域,有K1C60的微晶薄膜覆到了管壁上。在微晶基质中镶嵌的(K1C60)n
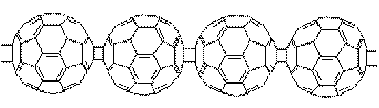
图1 (C60)n聚阴离子示意图
Fig. 1 Schematic depiction of the C60 polyanions
1.2
高温高压聚合高温高压是用于C60聚合反应最先进的技术。粉末状C60可在高温高压下转变为两种相对不稳定的物相[5]。第一种是在5GPa的压力下将C60加热到300℃-400℃产生的晶格参数为13.6Å的面心立方fcc型C60聚合物;另一种则是在同压下将C60加热到500℃-800℃后形成的晶格参数为a=9.22Å,c=24.6Å的斜方六面体(R)型C60聚合物。两种聚合物在有机溶剂中的溶解度很低,说明在高温高压过程中C60分子间的距离足够小以致于可以形成化学键。另外,红外、拉曼和核磁共振研究表明,在聚合过程中C60二十面体对称性急剧降低。差示扫描量热法和红外光谱测试法已被用于研究C60的两种压力聚合物相的解聚过程,在P=1atm下, 斜方六面体(R)和面心立方(fcc)C60聚合物可转变为粉末状的C60。有趣的是压力诱导的C70聚合只形成单一的[2+2]加成产物二聚体C140[6]。
C60在晶体中靠范德华力聚集,经过高压和高温处理,C60分子间通过共价键结合转变为聚合相 [7,8]。C60分子间键的数量和聚合物的结构依赖于聚合条件,改变聚合条件可以合成具有各种各样物理特性的一维(正交晶系)、二维(斜方六面体和四面体) 的聚合物。目前,高温高压制备的C60聚合物中已有四个聚合物相,即二聚体(D)、正交晶系(O)、四面体(T)和斜方六面体(R)。D相由C60二聚体组成,O相是一个一维(1D)线型聚合物,而T相和R相各自代表着不同的四面体和斜方六面体二维(2D)C60聚合物(图2)。简单地说,产率最高(70%)的D相是在P=1.5GPa,T=423K的条件下反应1000s形成的;O相是在P=1.2GPa,T=570K的条件下反应20000s生成的;T相是在P=2.2GPa,T=873K的条件下反应2000s生成的;R相是在P=6.0GPa,T=873K的条件下反应2000s形成的,此外,在P=6.0Gpa,T=1025K~1050K的条件下生成的一部分R相样品被称作磁性碳。研究证实,目前单独使用红外和拉曼光谱可以很好地定量识别这些聚合相[9]。
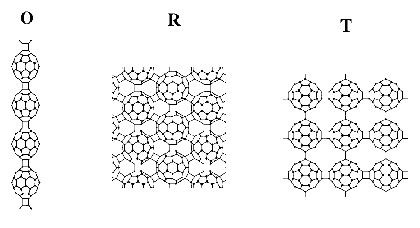
图2 一维和二维C60聚合物的结构示意图
Fig.2 Schematic structures of 1D and 2D C60 polymers
1.3 固态预组装聚合
C60具有三维排列的反应活性双键,这就造成了很难控制多加成反应产物的结构。固态预组装提供了一个有效的解决方法,即通过C60和其它分子共结晶,将C60封装在独立的单元,C60分子有序排列,使C60分子间只能在特定的方向进行聚合。如在超分子共结晶体C60(ET)2(ET=二(乙烯二硫基)四硫富瓦烯)中,高温高压能更有效地诱导C60二聚成C120[10]。C60与杯芳烃共结晶可以使C60形成严格的直线排列(图3)。杯芳烃阻止了C60交叉联接,高温高压下获得了线型C60聚合物[11]。预组装的C60有利于分子间进行[2+2]环加成反应[12]。
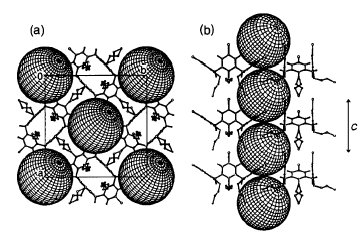
图3 C60和杯芳烃的晶体堆积示意图:(a)俯视
(b)侧视
Fig.3 Two views of the crystal packing of C60
and calixarene molecules (a) looking down the columns and (b)side-on.
1.4 光诱导聚合
C60在固相中易发生高效的光聚合反应,即[2+2]光加成反应。光诱导富勒烯二聚反应(或聚合反应)目前被限制在固体样品[13,14]和悬浮液[15]体系中。通过超分子自组装,并列反应双键,可以加速光反应产物的形成。C60衍生物通过互补的氢键结合,将单个C60衍生物分子按照一定的顺序组装(图4),
再进行光聚合则形成二聚体[16]。超分子体系中分子间具有很高的结合常数,可以被用于共聚物和同聚物的形成,并得到更多样的结构。
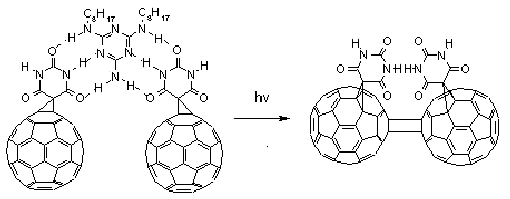
图4 存在互补氢键的C60衍生物发生光诱导聚合示意图
Fig.4 Schematic depiction of the
photodimerization of C60 derivatives in the presence of complementary
hydrogen-bonding
1.5 限域加热聚合
在微反应器中进行聚合反应,利用限域效应可控制形成的聚合物的结构。C60O在单壁碳纳米管中被加热后形成了线状聚合物[17](图5), 与直接加热C60O形成的枝状三维结构的聚合物不同。利用一维限域效应不失为合成线形聚合物的好方法。
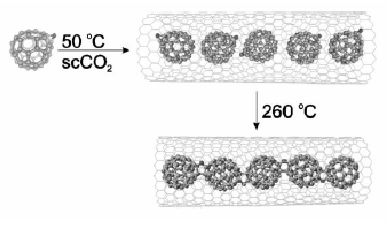
图5 C60O在单壁碳纳米管中发生化学发应的示意图
Fig.5 Schematic depiction of the
polymerization of C60O inside single-walled carbon nanotubes
1.6 液相还原聚合
C60与Cp*2Cr分别在邻二氯苯和苯中反应,可形成配合物Cp*2Cr·C60·(C6H4Cl2)2和Cp*2Cr·C60·(C6H6)2。单晶结构测定表明Cp*2Cr·C60·(C6H4Cl2)2晶体中存在二聚物(C60)2–[18](图6)。近红外光谱表明, C60在液相中被Cp*2Cr还原为C60·-
[19],快步骤形成了Cp*2Cr+和C60·-离子;第二步是慢步骤,形成了共价联接的Cp*2Cr+- C60·-,紧接着发生自由基的再结合,最终形成了Cp*2Cr-C60类型的配合物。同样,在CTV·(Cs)2·(C70)2·(DMF)7·(C6H6)0.75[20]、Cr(C6H6)2·C70·C6H5Me[21]和TDAE·C70·C6H5Me[22]单晶中也发现了单键连接的(C70)2–二聚物(图7)。
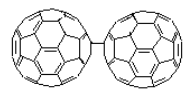
图6 Cp*2Cr·C60·(C6H4Cl2)2晶体中(C60)2–二聚物的分子结构示意图
Fig.6 (C60)2–
molecule structure in Cp*2Cr·C60·(C6H4Cl2)2
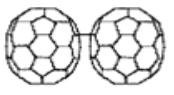
图7 CTV·(Cs)2· (C70)2·(DMF)7·(C6H6)0.75中(C70)2–二聚物的分子结构示意图
Fig.7 (C70)2- structure in CTV·(Cs)2·
(C70)2·(DMF)7·(C6H6)0.75
有趣的是
Jansen 领导的小组通过在液氨中使用金属钡还原C70第一次合成了线型聚合的(C702-)n离子[23],它存在于钡盐[Ba(NH3)9]C70·7NH3中,被单晶X射线分析证实(图8)。通过两个处于相反位置五元环上的碳原子的成键作用,C70笼线型联接,形成了在[001]平面内(C702-)n的轻微锯齿形排列,且桥联碳原子是sp3杂化。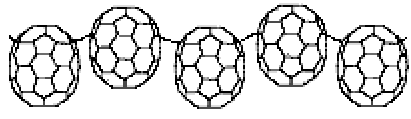
图8 (C702-)n离子的结构示意图
Fig.8 Schematic depiction of the structure of (C702-)n
1.7 高速振动碾磨法聚合
王官武[26]等利用高速振动碾磨法(HSVM),在固相条件下将C60与KCN反应,合成了C60二聚物C120。该反应有两种可能机理,一是亲核机理,另一是如图9所示的自由基机理。自由基机理可能更为合理,因为少量的还原性金属可以有效地引发链增长过程。
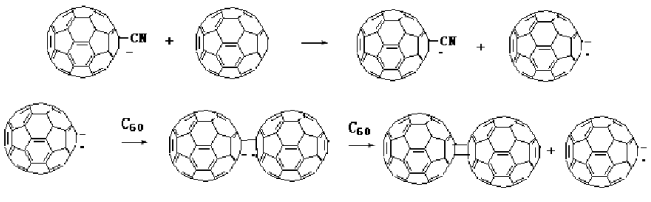
图9 自由基机理示意图
在钾盐(K2CO3,CH3CO2K)或还原性金属(Li, Na, K, Mg, Al, Zn)或有机碱存在的条件下,通过HSVM法也可以制备出C120[27],同法还可制备C70二聚形成C140的五种同分异构体[28]、C60和C70交叉二聚物C130[29]、C60三聚物C180的各种同分异构体[30]。C180的成键特征和同分异构体的结构可用隧道扫描电镜(STM)表征[31]。
2.磁性能富勒烯分子间键合的数量和聚合物的结构不同,导致聚合富勒烯存在有序或无序状态,具有金属和/或半导体的特性等。
C60是抗磁性的,而基于C60的一些材料是铁磁性的。已报道的富勒烯基分子铁磁体主要有两类:第一类是富勒烯电荷转移盐,如TDAE- C60(TDAE =四(二甲基氨基)乙烯),Tc=16K[32];[3-氨基苯基甲撑C60][Cp2Co],Tc=19K[33]. 和TTFxC60Bry[34]。第二类铁磁体是C60二维层状聚合物。最近的实验和理论研究表明由于纯石墨中电子的不稳定性,可以引起石墨产生室温超导和铁磁性质。这一结果引起了人们研究纯碳固体的广泛兴趣。2001年Makarova等人在探寻C60聚合物的超导现象时意外地发现了C60二维层状聚合物菱面晶体具有铁磁性交换相互作用,Tc高达500K[35, 36],这是迄今为止Tc最高的纯有机铁磁体,是分子基铁磁体研究领域的一个重大突破,具有重要的学术意义。另外,光氧化C60后TC可达800K[37]。Eu9C70 Tc=38K [38]。氢化富勒烯C60H24中发现有铁磁性[39],其TC值大于300K。有趣的是,将C60H24储藏一年后,最初的铁磁性转变为抗磁性,这一结果说明C60H24的铁磁性不可能来自磁性杂质。
富勒烯基磁体有几个主要的特征:(1) 在富勒烯单元之间的 p 电子自旋耦合可以产生铁磁性,而掺杂剂不对自旋有序作出贡献;(2) 制备过程和磁性特征之间存在很强的相互关系。不太大的饱和磁化强度和磁性对于温度非正常的依赖关系,很可能是由于样品的纳米晶体本性决定的;(3) 获得铁磁性物相的关键是邻近富勒烯分子相互取向[38,40]。C60阴离子的相互取向决定了分子间磁交换关系。
富勒烯基铁磁体的铁磁信号是由富勒烯引起的,原因有:(1) 随机分布的杂质铁离子不能产生铁磁性,因为原子之间的距离太大,传导电子的密度太低;(2) 即使所有的铁原子形成了宏观簇群,测得的C60磁化强度在某些情况下超过了估算杂质贡献得到的值;(3) 样品的磁性受压力和温度等聚合条件控制;(4) 杂质不能解释在C60光聚合过程中铁磁信号的加强[37, 41];(5) 对于在杂质浓度小于1 ppm的宏观区域的磁畴结构研究表明,富勒烯的铁磁性是其固有属性。
聚合富勒烯铁磁性的机理可能是由于C60离子的局部磁矩和流动电子之间的耦合[42]或sp3碳原子分开的两个sp2碳自由基之间的铁磁相互作用[43]或在结构缺陷和sp3碳之间存在相互作用[44]。富勒烯聚合过程中产生的包含sp2和sp3杂化碳原子的结构,支持C60的铁磁性。在高压诱导富勒烯聚合的过程中,磁性出现在富勒烯笼将要破碎的情况下,破碎的富勒烯分子间成键或笼的缺损造成了不成对自旋。分子氧光激发后分解,与富勒烯相互作用产生局部自旋。在无氧的条件下,光氧化不能改变富勒烯的磁性。对于聚合富勒烯铁磁性行为的真正起因目前尚不能确定,有待于进一步研究。
3 展望
目前对于聚合富勒烯的研究还很少,合成方法只有高温高压反应较为成熟,其它的方法也只是刚刚起步,还在研究和探索阶段;产物以聚合C60居多,其它的富勒烯聚合还少见报道;人们对聚合富勒烯的性质了解也只停留在表面现象阶段。C60是20世纪一个振奋人心的发现,它为化学学科开辟了一个崭新的研究领域,而聚合富勒烯则是一张刚写了几笔的白纸,一定有巨大的发展空间和潜在的应用价值。我们认为聚合富勒烯的研究热点和发展方向主要体现在以下几个方面:(1)
探索温和条件下宏量制备聚合富勒烯的新方法;(2)
探索合成富勒烯衍生物聚合物,
研究加合基团对聚合富勒烯衍生物性能的影响,设计合成新颖的富勒烯聚合物铁磁体;
(3)
系统、深入地研究聚合富勒烯结构和性能,发现规律,探究本质。相信随着对聚合富勒烯研究的进一步深入,其本质和用途也会越来越多地被人们认识、理解和利用。
[1] Yin J J, Li Y G, Li B. et al. Chem. Commun., 2005: 3041-3043 and references therein.
[2] Haddon R C, Hebard A F, Rosseinsky M J. et al. Nature, 1991, 350: 320-322.
[3] Pekker S, Forró L, Mihály L. et al. Solid State Commun., 1994, 90: 349-352.
[4] Pekker S, Jánossy A, Mihaly L. et al. Science, 1994, 265: 1077-1078.
[5] Iwasa Y, Arima T, Fleming R M. et al. Science, 1994, 264: 1570-1572.
[6] Lebedkin S, Hull W E, Soldatov A. et al. J. Phys. Chem.B 2000, 104: 4101-4110.
[7] Palacio F. Nature, 2001, 413: 690-691.
[8] Korobov M V, Senyavin V M, Bogachev A G. et al. Chem. Phys. Lett., 2003, 381: 410-415.
[9] Senyavin V M, Davydov V A, Kashevarova L S. et al. Chem. Phys. Lett., 1999, 313: 421-425.
[10] Iwasa Y, Tanoue K, Mitani T. et al. Chem. Commun., 1998, 13: 1411-1412.
[11] Barbour L J, Atwood J L. Chem. Commun., 1998, 17: 1901-1902.
[12] Knol J, Hummelen J C. J. Am. Chem. Soc., 2000, 122: 3226-3227.
[13] Rao A M, Zhou P, Wang K A. et al. Science, 1993, 259: 955-957.
[14] Zhou P, Dong Z H, Rao A M. et al. Chem. Phys. Lett., 1993, 211: 337-340.
[15] Sun Y P, Ma B, Bunker C E. et al. J. Am. Chem. Soc., 1995, 117: 12705-12711.
[16] McClenaghan N D, Absalon C, Bassani D M. J. Am. Chem. Soc., 2003, 125: 13004-13005.
[17] Britz D A, Khlobystov A N, Porfyrakis K. et al. Chem. Commun., 2005: 37-39.
[18] Konarev D V, Khasanov S S, Otsuka A. et al. J. Am. Chem. Soc., 2002, 124: 8520-8521.
[19] Konarev D V, Drichko N V, Graja A. J. Chem. Phys., 1998, 95: 2143-2156.
[20] Konarev D V, Khasanov S S, Vorontsov I I. et al. Chem. Commun., 2002: 2548-2549.
[21] Yoshida Y, Otsuka A, Konarev D V. et al. Synth. Met., 2003, 133-134: 703-705.
[22] Oshima K, Kambe T, Fujiwara M. et al. Synth. Met., 2003, 133-134: 609-701.
[23] Brumm H, Peters E, Jansen M. Angew. Chem. Int. Ed., 2001, 40: 2069-2071.
[26] Wang G W, Komatsu K, Murata Y. et al. Nature, 1997, 387: 583-586.
[27] Komatsu K, Wang G W, Murata Y. et al. J. Org. Chem., 1998, 63: 9358-9366.
[28] Forman G S, Tagmatarchis N, Shinohara H. J. Am. Chem. Soc., 2002, 124: 178-179.
[29] Komatsu K, Fujiwara K, Murata Y. Chem. Commun., 2000, (17): 1583-1584.
[30] Komatsu K, Fujiwara K, Murata Y. Chem. Lett., 2000: 1016-1017.
[31] Kunitake M, Uemura S, Ito O. et al. Angew. Chem. Int. Ed., 2002, 41: 969-972.
[32] Allemand P M, Khemani K C, Koch A. et al. Science, 1991, 253: 301-303.
[33] Mrzel A, Omerzu A, Umek P. et al. Chem. Phys. Lett. 1998, 298:329-334.
[34] Li Y L, Zhang D Q, Bai F L. et al. Solid State Commun. 1993, 86: 475-477.
[35] Makarova T L, Sundqvist B, H?hne R. et al. Nature, 2001, 413: 716-718.
[36] H?hne R, Esquinazi P. Adv. Mater. 2002, 14:753-756.
[37] Murakami Y, Suematsu H. Pure Appl. Chem., 1996, 68: 1463-1467.
[38] Takenobu T, Chi D H, Margadonna S. et al. J. Am. Chem. Soc., 2003, 125: 1897-1904.
[39] Antonov V E, Bashkin I O, Khasanov S S. et al. J. Alloys Compd., 2002, 330: 365-368.
[40] Narymbetov B, Omerzu A, Kabanov V V. et al. Nature, 2000, 407: 883-885.
[41] Makarova T L, Han K –H, Esquinazi P. et al. Carbon, 2003, 41: 1575-1584.
[42] Jarlborg T. Phys. Rev. Lett., 2000, 85: 186-189.
[43] Coey J M D, Venkatesan M, Fitzgerald C B. et al. Nature, 2002, 420: 156-159.
[44] Andriotis A N, Menon M, Sheetz R M. et al. Phys. Rev. Lett., 2003, 90: 026801-1-026801-4.