| http://www.chemistrymag.org/cji/2006/08c073nc.htm | Dec.1,
2006 Vol.8 No.12 P.73 Copyright |
Yang Yan, Chai Yuedong, Li Ming, Lin Hong, Tai Xi
(Department of Chemistry and Environment Science, Yuxi Teacher's College, Yuxi Yunnan 653100, China)
Abstract A microcolumn high performance
liquid chromatography (HPLC) method for the determination of flavonoids (Rutin,
Quercitrin-3-O-giucoside, Quercitrin-3-O-galactose, Quercitrin) in Apocynum Venetum L. was
studied. The flavonoids were extracted from the sample with 90% of methanol by
heating circumfluence for 45 min. Then the extract was purified by solid phase extraction
with Sep-Pak-C18 cartridge. The flavonoid was separated on a ZORBAX Stable
Bound (2.1×50 mm, 1.8 m m), with methanol and 0.05 mol/L potassium dihydrogen
phosphate buffer solution as mobile phase at a flow-rate of 0.3 mL/min, and monitored with
the photodiode array detector at 360 nm. The four flavonoids were separated completely
within 2 min. The recoveries of the flavonoids are 98%-102%, and relative standard deviations are 1.1%-1.4%. Results are satisfactory.
Keywords microcolumn high performance liquid chromatography; solid phase
extraction; flavonoid; Apocynum Venetum L
高效液相色谱法测定罗布麻中几种黄酮类物质的研究
杨艳,柴跃东,李明,林洪,台希
(玉溪师范学院化学与环境科学系,云南玉溪 653100)
摘要 建立罗布麻中主要黄酮成分 (芦丁,槲皮素-3-O-葡萄糖苷,槲皮素-3-O-半乳糖苷,槲皮素)的高效液相色谱快速分析方法。罗布麻中的黄酮用90%的甲醇加热回流提取,提取液用Waters Sep-Pak-C18 固相萃取小柱预分离,以安捷仑ZORBAX Stable Bound (2.1
×50 mm, 1.8 m m) 色谱柱为固定相,0.05 mol/L磷酸二氢钾缓冲溶液和甲醇为流动相,用二极管矩阵检测器检测。四种黄酮在2.0 min 内分离,方法标准回收率为98%~102%, 相对标准偏差为1.1%~1.4%,结果满意。关键词 微柱高效液相色谱;固相萃取;罗布麻;黄酮
1 引 言
罗布麻为夹竹桃科植物红麻(罗布麻),白麻(紫纹罗布麻)和大叶白麻(大花罗布麻)的叶。近年来临床用于利尿、消肿、降压并具有不同程度的抗辐射、免疫、降血脂、抗衰老和镇静作用。文献报道黄酮类物质是其主要有效成分,罗布麻中的黄酮主要有芦丁,槲皮素,槲皮素3-O-葡萄糖苷,槲皮素-3-O-半乳糖苷等
[1-3]。目前黄酮的测定方法主要有光度法、电化学法和色谱法等,其中高效液相色谱法是最有效的方法
[4-9]。由于微柱高效液相色谱具有流动相消耗小,分析时间短,可不分流直接和质谱连用等特点,近几年来得到了迅速发展
[10,11]。我们研究了用安捷仑 ZORBAX Stable Bound (2.1
2 试验部分
2.1主要仪器与试剂
美国安捷仑公司1100高效液相色谱仪,包括HP 1100四元泵,HP1100紫外二极管矩阵检测器,HP
1100自动进样器,Chem Station 色谱工作站。
甲醇:高效液相色谱专用(Fisher公司生产);水为石英亚沸蒸馏水并用Milli-Q50
(美国Millipore公司) 超纯水仪处理,电阻> 18
2.2色谱条件
色谱柱:ZORBAX Stable Bound (2.1×50 mm, 1.8 m m),固相萃取柱:Waters Sep-Pak-C18固相萃取小柱 (1cc,30 mg,30mm);流动相为0.05 mol.L-1磷酸二氢钾缓冲溶液-甲醇 (40:60,V/V),流速为0.3 mL/min;检测波长为360 nm,进样体积5.0 mL。上述色谱条件下样品和标样在360 nm波长处色谱图见图1。
2.3样品处理
样品粉碎后过80目筛,准确称取约0.2 g,加入40 mL 90%甲醇水溶液加热回流45 min,冷却,过滤并定容到50 mL,取5 mL滤液,以10 mL/min流速通过预活化好的Waters Sep-Pak-C18固相萃取小柱,弃去最初的3 mL,收集后面的2 mL用0.45 mm针头过滤器过滤,进样5.0 ml分析。
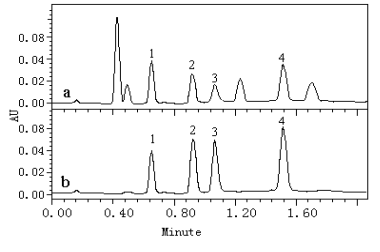
图1黄酮标样(b)和罗布麻样品(a)色谱图
Fig.1 The Chromatogram of flavonoid standard (a) and Apocynum Venetum L sample (b)
1)芦丁(Rutin), 2) 槲皮素-3-O-葡萄糖苷(Quercitrin-3-O -giucoside),3) 槲皮素-3-O-半乳糖苷(Quercitrin-3-O-galactose), 4) 槲皮素(Quercitrin),
3 结果与讨论
3.1 分离条件的选择
用甲醇-水作流动相,黄酮成分不能获得很好的分离,而且峰有拖尾;改用甲醇-磷酸二氢钾缓冲液作流动相可使分离效果和峰型得到较大改善,试验了用不同比例的甲醇和磷酸二氢钾缓冲液溶液分离黄酮;当磷酸二氢钾缓冲溶液和甲醇的比例为
40:60 (V/V)时可让样品中的主要黄酮达到完全分离且分析时间较短,因此试验选用该流动相。
3.2
主要黄酮的光谱特征及检测波长的选择
由紫外二极管矩阵检测器200-400 nm波长扫描可得各黄酮色谱峰的光谱图,样品中各黄酮均由其保留时间及紫外光谱图与标样对照确定;由于各黄酮在360
nm处均有较大吸收,因此实验择检测波长为360 nm。
3.3 样品前处理
黄酮类物质在极性有机溶剂中具有较大的溶解度,在热甲醇溶液中溶解性较好,故实验选用90%甲醇为提取剂。对于0.2
g左右的样品,用40 mL浓度在70%以上的甲醇溶液加热回流提取0.5 h以上可提取完全,实验选用90%甲醇40
mL加热回流提取45 min。
罗布麻中除含有黄酮类物质外,还含有脂类,蜡质,色素等弱极性物质;该类物质会影响黄酮类物质的检测,并且在本实验的流动相条件下不能完全洗脱下,在C18柱上残留积累,使色谱系统的反压增大,并降低柱效,故样品分析前需作脱脂处理。一般文献报道用正己烷,石油醚等非极性有机溶剂进行脱脂,但是用有机溶剂脱脂时间长操作麻烦,还会在一定程度上造成黄酮类物质损失,影响分析结果。因此我们研究了先用90%甲醇回流提取样品中的黄酮类成分,提取液用C18固相萃取小柱脱脂的方法。用Waters
SPE 真空提取装置,每次可同时处理20个样,小柱活化和样品预分离的流速均为10
mL/min,小柱用3 mL甲醇活化,然后用10 mL水洗净小柱上的甲醇,取90%甲醇的样品提取液通过小柱,这样弱极性脂类、蜡质、色素物质保留在小柱上,而黄酮类物质在该流动相条件下在小柱上不保留,这样可简便快速的达到样品预分离的目的,用固相萃取脱过脂的样品可直接进样进行色谱分析。
3.4 回归方程、相关系数及检测限
分别配制浓度为100
Table 1 Regression Equation, Coefficient and Detect limit
组分(Components) |
回归方程(Regression equation) |
线性范围(Linearity range) (mg/L) |
相关系数 (Coefficient) |
检测限
|
芦丁 (Rutin) |
A=184×105C+282 |
0.2-300 |
r=0.9991 |
0.018 |
槲皮素 (Quercitrin) |
A=3.52×105C-645 |
0.12-220 |
r=0.9993 |
0.01 |
槲皮素3-O-葡萄糖苷 (Quercitrin-3-O-giucoside) |
A=2.47×105C+528 |
0.16-250 |
r=0.9992 |
0.015 |
槲皮素-3-O-半乳糖苷 (Quercitrin-3-O-galactose) |
A=2.56×105C-674 |
0.16-250 |
r=0.9991 |
0.015 |
3.5 回收率实验及精密度
准确称取相同样品两份,其中一份加入已知量黄酮标样,另一份不加,在相同条件下测定5次,通过加入标准的测出量除以标准加入量计算回收率,并根据5次平行测定的结果计算相对标准偏差,结果见表2。 表2 方法精密度及回收率
Table 2 Method Precision and Recovery
组分 (Components) |
加入量 (Amount Add) (mg) |
测出量(Amount Found) (mg) |
回收率 (Recovery)% |
RSD%(n=5) |
芦丁 (Rutin) |
1.00 |
0.98 |
98 |
1.2 |
槲皮素 (Quercitrin) |
1.00 |
10.02 |
102 |
1.4 |
槲皮素3-O-葡萄糖苷 (Quercitrin-3-O-giucoside) |
1.00 |
1.01 |
101 |
1.1 |
槲皮素-3-O-半乳糖苷 (Quercitrin-3-O-galactose) |
1.00 |
0.98 |
98 |
1.2 |
3.6 样品分析结果
罗布麻样品采集于云南省中药批发市场,采集后请中国科学院昆明植物研究所中药研究室鉴定,样品按1.3样品前处理的方法进行前处理,然后按选定色谱条件进样分析,结果见表3。 表3 样品分析及结果
Table 3 Determination results of samples
组 分(Components) |
样 品 (samples) (mg/g) |
|||
罗布麻(云南) |
罗布麻(新疆) |
罗布麻(广西) |
罗布麻(四川) |
|
芦丁 (Rutin) |
14.5 |
16.7 |
21.2 |
20.5 |
槲皮素 (Quercitrin) |
8.26 |
9.47 |
11.5 |
12.6 |
槲皮素3-O-葡萄糖苷 (Quercitrin-3-O-giucoside) |
5.25 |
4.76 |
5.33 |
4.18 |
槲皮素-3-O-半乳糖苷 (Quercitrin-3-O-galactose) |
3.27 |
2.86 |
2.75 |
3.62 |
4 结论
本方法在ZORBAX Stable Bound (2.1×50 mm, 1.8 mm) 微柱上,用0.05 mol.L-1磷酸二氢钾缓冲溶液-甲醇
(40:60,V/V)为流动相,可在2.0 min
内完全分离罗布麻中的主要黄酮类成分,和常规色谱柱相比,大大缩短了分析时间;而且流动相流速只需
0.3 mL/min,比常规色谱柱(流动相流速0.5- 2.0 mL/min)流动相消耗减少。本方法还采用90%甲醇回流提取罗布麻中的黄酮类物质,用固相萃取预分离脱脂,克服了用有机溶剂脱脂时间长、操作麻烦,会造成黄酮类物质损失的缺点,而且固相萃取可实现操作自动化,使样品前处理操作更为简便快速。该方法的建立在一定程度上为罗布麻中的黄酮类物质快速测定提供了方法。
REFERENCES
[1] 魏鉴明. 罗布麻在医药方面的研究现状和展望.药学通报,1986,2l(12):741
[2] Tagawa C, Kagawa T, Nakazawa Y, Onizuka S, Nishibe S, Kawasaki H. Studies on
antihypertensive effect of Luobuma (Apocynum venetum L.) leaf extract. Journal of the
Pharmaceutical Society of Japan. 2004, 124(11):851-6.
[3] 陈妙华,刘凤山. 罗布麻叶镇静化学成分的研究. 中国中药杂志. 1991.
16(10):609-611
[4] 张文珠,刘霞,温博等. 反相高效液相色谱法测定肾复康胶囊中的野黄芩苷和芦丁.色谱,2004,22(2):138-140
[5] Liu RX, Wang Q, Guo HZ, Li L, Bi KS, Guo DA. Simultaneous determination of 10 major
flavonoids in Dalbergia odorifera by high performance liquid chromatography. Journal of
pharmaceutical and biomedical analysis. 2005, 39(3-4): 469-76
[6] 魏永生,郑敏燕,王永宁等. 青海油菜蜂花粉黄酮类化合物含量的研究. 西北植物学报. 2004,24(2):301-305
[7] 陈缵光,王玫馨,蔡沛祥等. 无刺根中蛇葡萄素和杨梅素的含量测定. 中药材. 1997,20(1):23-25
[8] Chen H, Zuo Y, Deng Y. Separation and determination of flavonoids and other phenolic
compounds in cranberry juice by high-performance liquid chromatography. Journal of
Chromatography A. 2001 Apr 13;913(1-2):387-95.
[9] 薛梅,黄国强,陈宏伟. 木瓜中总黄酮的提取及含量测定. 淮海医药,2004,22(2):156-156
[10] 傅若农. 高效液相色谱进展(二)-微柱液相色谱近年的发展. 国外分析仪器技术与应用. 2000, (4):1-10
[11] Yang GY, Hu QF, Huang ZJ, Yin JY Study on the determination of lead, cadmium,
mercury, nickel and zinc by a rapid column high-performance liquid chromatography. Journal
of the brazilian chemical society. 2005, 16(6A): 1154-1159.