http://www.chemistrymag.org/cji/2007/091004nc.htm |
Jan. 2,
2007 Vol.9 No.1 P.4 Copyright |
Chen Qin,Yin Haibo, Li Renqiang
(Department of Biotechnology, Jinan University, Guangzhou 510632, China)
Abstract The interactions between Hg(II)
and bovine serum albumin (BSA) at physiological condition (pH 7.43) were studied by using
fluorescence quenching spectra. Results showed that there were 2.0 strong and about 7 weak
binding sites to Hg(II) in BSA, their interactions included weak, strong and stronger
combination. Fluorescence quenching spectra also explained that the binding of BSA with
Hg(II) showed a negative cooperativity. The advantage of fluorescence quenching spectra
analysis in the probing to interaction between BSA and Hg(II) and its application were
discussed.
Keywords Hg(II); Bovine serum albumin; Interaction; Fluorescence quenching;
cooperativity
(暨南大学生物工程学系,广州 510632)
2006年11月30日收稿
摘要
本研究以高灵敏度的荧光猝灭法研究了生理条件(pH值7.43)下Hg2+与牛血清白蛋白(BSA)的相互作用。荧光光谱表明,BSA与Hg2+的结合有强、中、弱之分,有2个强结合部位和约7个弱结合部位,且Hg2+与BSA的结合呈现负协同效应。实验结果说明了对于BSA与Hg2+结合反应的研究,荧光猝灭法具有快速简便等特点,能进行较好的定性分析,还可能在定量分析上具有很好的应用前景。关键词 汞(Hg2+) 牛血清白蛋白 相互作用 荧光猝灭 协同效应
血清白蛋白是人和动物血清中含量最丰富的一种蛋白质,能与许多物质结合,在体内起着贮存、输运、承载代谢物的作用。金属离子同样能与血清白蛋白结合,是研究的热点之一,报道甚多[1,2]。研究多采用平衡透析、光谱分析等方法[3]。对于Hg2+与白蛋白的结合,宋仲容等[4]通过平衡透析实验得到一组逐级结合常数,但对结合位点及数目,协同效应即白蛋白与Hg2+依次结合的难易程度的变化等未有深入研究。梁宏等通过紫外吸收光谱法研究[5]认为Hg2+在牛血清白蛋白中最可能结合的位置在7对相邻的二硫桥处。利用荧光猝灭法研究Hg2+与白蛋白的反应目前未见报道。由于荧光光谱的高度灵敏性,能反映与金属离子结合后白蛋白分子的微小结构变化,所以,用荧光光谱研究白蛋白与金属离子的结合具有其独特的优点。基于这些,本研究以荧光猝灭法研究了生理条件(pH值7.43)下Hg2+与牛血清白蛋白(BSA)的相互作用。在分析这些荧光猝灭光谱时,不仅发现了Hg2+与BSA结合后光谱的一些规律,且光谱还显示了BSA与Hg2+结合的相关信息,特别是它们结合所产生的协同效应的情况等,这都有助于对Hg2+与血清白蛋白结合反应特性的了解。同时,荧光猝灭光谱的变化与白蛋白结合Hg2+之间存在有一定的数量关系。荧光猝灭法为研究白蛋白与无机物等的结合提供了快速有效的手段。
1 实验1.1 试剂与仪器
主要试剂牛血清白蛋白(BSA)购自宝泰克生物科技有限公司;2-羟基-5-磺酸苯基重氮氨基偶氮苯(HSDAA)来自上海长科试剂研究所;HgCl2、 NaCl、三羟甲基氨基甲烷(Tris)、HCl等在实验中用到的药品均为分析纯。透析袋购自华美生物工程公司,用前经常规处理。实验用水均为二次蒸馏水。所用仪器主要有上海棱光S54分光光度计,F-4500荧光分光光度计(Hitachi)和DELTA320型精密pH计等。
1.2 实验方法
1.2.1 Hg2+与BSA的相互作用
用pH 7.43,0.05 mol·L-1 Tris-盐酸缓冲溶液(含0.1 mol·L-1NaCl)配制1×10-4 mol·L-1BSA溶液以及不同浓度的Hg2+溶液。移取4 mL BSA溶液于透析袋内,放置于16 mL Hg2+溶液中,Hg2+溶液浓度在10-5 mol·L-1-10-3 mol·L-1范围内变化,约取20个值。每个点最少平行做2次。在20±2℃下避光透析24h,达平衡后,用下述HSDAA法检测透析袋外液自由Hg2+的浓度,从而定出与BSA结合的Hg2+的量。
1.2.2 HSDAA法检测Hg2+浓度[6]
于25 mL容量瓶中,分别加入数mL样液和浓度为10ug/mL的Hg2+标准溶液0.2、0.4、0.6、0.8、1.0、1.2、1.5 mL,pH为10.3的Na2B4O7-NaOH缓冲溶液5 mL,5﹪ OP-10水溶液3.0 mL,浓度为0.4 g·L-1的HSDAA乙醇溶液2.5 mL,用蒸馏水稀释至刻度,摇匀。放置30 min后,以试剂空白为参比,用1 cm比色皿,于519 nm处测定吸光度。作出标线,并计算出样液Hg2+的含量。
1.2.3 荧光检测
透析平衡结束后,收集透析袋内与Hg2+结合的BSA液,与空白对照BSA溶液一起,用上述Tris-盐酸缓冲溶液(含0.1 mol·L-1NaCl)稀释20倍,取4 mL稀释液置于荧光分光光度计样品槽内以296 nm为激发波长,灵敏度为 700V,激发及发射光狭缝(宽带)均为5.00 nm进行荧光快速扫描,记录结合不同浓度Hg2+的BSA荧光强度的变化。实验重复3次,取平均值。
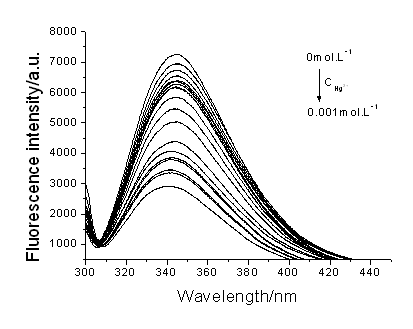 图1 不同浓度的Hg2+对BSA的荧光猝灭 |
表1 BSA-Hg2+在296
nm的 荧光峰强度( F0=7258)
|
HSDAA法检测Hg2+浓度,在Hg2+含量为0-12 ug/25mL范围内,标线呈极好的线性关系(数据不列)。工作曲线方程为:Abs=0.0317·Conc.﹣ 0.0073, 相关系数R2为0.9992。说明采用HSDAA法检测痕量Hg2+相当精确。
图1为BSA在不同Hg2+浓度透析平衡后结合不同浓度Hg2+的BSA的荧光猝灭图,激发波长为296nm,荧光扫描的最大发射光峰值在342nm。由图可见,随着结合Hg2+浓度的增加,BSA荧光强度也相应的下降,下降的幅度呈现其特有的规律性。为了便于分析,各重要的数据总结于表1。表1中F为样液最大荧光峰值,F0代表空白对照BSA的最大峰值,n1代表与BSA结合的Hg2+的摩尔浓度,n2则代表BSA的摩尔浓度。若以n1/n2的比值为横坐标,F0/F为纵坐标作图,则得图2。
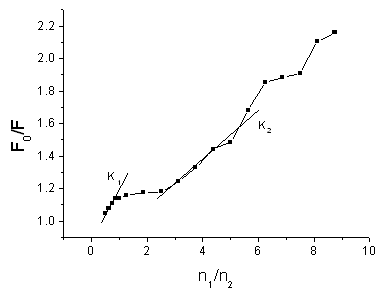
图2 n1(Hg2+)/n2(BSA)对F0-F 图
从图
2的曲线趋势可以看出,起初BSA荧光猝灭的线性非常好,当Hg2+摩尔浓度接近1倍BSA摩尔浓度时,曲线渐趋平缓,BSA荧光强度变化不大,一直到Hg2+摩尔浓度渐渐超过2倍BSA摩尔浓度。这说明BSA与Hg2+之间一开始发生了强烈的结合反应,但随着BSA与Hg2+结合后(n1/n2 = 1时),BSA与Hg2+之间相互作用强度有所下降。当n1/n2 大于2后,BSA荧光猝灭的幅度又有所上升,并呈一定的线性规律,但显然BSA与Hg2+之间相互作用强度不及第一段,因为其斜率变小(图2中K2与K1比)。在两者浓度比到达6倍左右时,曲线又变平缓,一直到n1/n2大于7,BSA荧光强度没有明显的改变。最后一段随着BSA与Hg2+大量结合,BSA荧光猝灭变化的规律性变差,这可能由于与大量Hg2+结合,使BSA分子活性渐渐丧失所致。可把n1/n2=6时的前部分分成二截来看,即n1/n2=2时为一个类型的结合,n1/n2为6时为另一类型的结合。说明BSA分子中结合Hg2+有二个强的位点,其中一个为强,另一个为较强,还有约6到7个较弱的结合位点。这说明BSA象一个海绵一样不断的吸附Hg2+,但与Hg2+的结合有强、中、弱之分,显然这与BSA分子的功能基团或极性的分布有关。另一明显的现象就是Hg2+与BSA的结合会产生一定的负协同性,即前面结合的Hg2+会降低BSA对后来Hg2+的结合力,这可能由于结合后的Hg2+使BSA发生了变构效应所致。由此可以推测:BSA结合Hg2+有约2个强结合位点和约7个中、弱结合位点,而且在结合位点饱和之前均会有规律性的出现负协同效应。为了验证此负协同效应,对具有多个结合部位的分子中各结合部位之间的协同性可用Hill方程[7]进行计算,因为本实验通过HSDAA法已测出了各相关数据。Hill方程为 logY/(1-Y) = h log[Hg2+] – logK,其中Y为饱和度,表示BSA被Hg2+饱和的程度,即Y= n/nt,n是平均结合数,由实验得到,nt是白蛋白结合Hg2+的总数,由作图得出,为9.7。K为平均结合常数,由本实验的数据直接计算得出。h为Hill系数,表示Hill图曲线各部分的斜率。若h = 1,无协同性;h > 1,有正协同性;h < 1,有负协同性。据各相关数据作出的Hill图见图3。
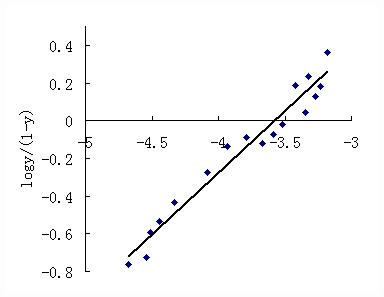
图3 BSA结合Hg2+的Hill图 从图3可知,Hg2+-BSA体系中,hmax =0.70,表明Hg2+与BSA的结合产生了负协同效应。这与上述荧光分析结果是一致的。
本实验结果表明,对于BSA与Hg2+结合反应的研究,荧光猝灭法具有快速简便等特点,能进行较好的定性分析,是揭示BSA与Hg2+结合反应特性的很好的方法。同时,荧光猝灭法还可能在定量分析上具有很好的应用前景,如图2中第一阶段良好的线性关系,由计算得出荧光猝灭度与BSA吸附Hg2+的量的相关系数达到0.9021(数据不列),显然荧光猝灭法对于计算BSA结合Hg2+或其它金属离子的的量具有应用潜力,这为以蛋白质作为探针去定量微量金属离子提供了实验基础,这也是今后我们要开展的工作。
REFERENCES
[1] Li S T, Zha D M, Zhang H Z et al. Journal of Guangxi Normal University (Guangxi Shifan
Daxue Xuebao), 1998 ,16(3):43-47.
[2] Tu C Q, Sun H L, Zeng J Q et al. Guangxi Science (Guangxi Kexue), 1999,6(4): 278-280.
[3] Qin S J, Shen J S, Li Y T et al. Journal of Hebei Normal University (Hebei Shifan
Daxue Xuebao), 2003, 27 (1): 75-80.
[4] Song Z R, Wang L, Zhou Y Q. Journal of Sichuan Normal University(Sichuan Shifan Daxue
Xuebao), 1994, 17(1):90-93.
[5]Li S T, Zha D M, Liang H. Spectroscopy and Spectral Analysis (Guangpuxue He Guangpu
Fenxi),1999,19(5):
700-703.
[6]Cao X A, Chen Y H, Lin H M. Spectroscopy and Spectral Analysis (Guangpuxue He Guangpu
Fenxi), 2004, 24 (4): 474-476.
[7] Fersht A. (Translated by Du J Z, Ru B G, Wei X C) The Structural and Mechanism of
Enzyme (Mei De Jiegou He Zuoyong Jizhi), Beijing: Beijing University Press, 1991, 292.