http://www.chemistrymag.org/cji/2007/097031nc.htm |
Jul.10,
2007 Vol.9 No.7 P.31 Copyright |
Ma Sha, Yang Xiaomei, Chen Xiumin#
(School of Traditional Chinese Medicine, Yunnan University of Traditional Chinese Medicine,Kunming 650200; #School of Science, Kunming University
of Science and Technology , Kunming 650000, China)
Abstract The system of n-C8H17OH-H2O
was adopted to study the distribution of Lead in extract of Erigeron breviscapus of
Yunnan. The contents, distribution and speciation of the analytes were determined by
ICP-AES. The result shows that although total contents of Pb are high, total contents of
water soluble species are low. The values of Kow are high, which indicates that
water soluble Pb is easily absorbed by human body under gastric and intestinal acidity.
Keywords ICP-AES; Lead; Speciation; erigeron breviscapus
云南部分产地灯盏细辛中铅的化学形态初探
马莎,杨晓梅,陈秀敏
#(云南中医学院中药学院,昆明 650200;#昆明理工大学理学院,昆明 650000 )
摘要 以正辛醇
-水分配体系模拟中药水煎液中的微量元素在人体肠胃中的分配情况,采用ICP-AES测定灯盏细辛药材及其水煎液中Pb的含量,获取相关的化学形态浓度及分布规律,结果显示:Pb的总量较高,但总水溶态很少; Pb的Kow较大,说明在胃肠酸碱条件下,水溶态Pb被人体吸收的可能性较高。这些结果对云南灯盏细辛的进一步开发利用有参考价值。关键词 ICP-AES;铅;形态分析;灯盏细辛
1 引言
中药中的金属元素多与中药所含有机成分以结合或络合态存在,在不同的形态下和不同的靶位环境中,具有不同的亲脂性和生物活性,从而表现出不同的药效[5]。因此,中药中的金属元素对人体的作用并不取决于总浓度,而是与该元素的化学形态有关。
正辛醇是一种结构上与人体内的碳水化合物和脂肪类似的长链烷烃醇,因此在药理学中常用Kow参数(Kow=co/cw,co和cw分别为该化合物在正辛醇相和水相中的平衡浓度)评价有机药物的亲脂性及生物活性[6]。
电感耦合等离子体发射光谱法(ICP-AES法)具有基体效应小,线性范围宽等优点,已在中药微量元素形态分析中得到广泛应用[7,8]。本文采用该法测定云南部分产地灯盏花中Pb的含量,同时与黑龙江产灯盏花进行对比试验。然后还进行Pb的形态分析,采取中药常用煎煮方式制取水煮液,用正辛醇-水分配体系来模拟中药水煎液在人体胃肠中的分配情况,然后测定水煎液及正辛醇萃取后的水溶态Pb含量,求算出灯盏细辛样品中Pb的水煮溶出率、Kow值,探讨了酸度变化(模拟人体的胃肠酸度)对Pb形态的影响,为进一步研究中药中金属元素的存在形态,深入探讨中药中金属元素在中药药材、药效方面的作用机制,制定合理的中药中重金属元素质量标准提供理论基础。
2 实验部分
2.1.1 仪器及工作条件
ICP-1000Ⅱ等离子体光谱仪(日本岛津公司)。仪器工作条件:高频功率1200W,观测高度15mm,载气流量1.0L/min,冷却气流量15L/min,等离子气流量1.2L/min,净化气流量3.5L/min,进样时间20s,清洗时间20s,积分时间5s,分析线:283.307nm。
2.1.2 试剂
HNO3、HClO4等所用试剂均为优级纯或分析纯,水为二次石英亚沸蒸馏水。
2.1.3 药材的采集及保存
灯盏花样品采自云南丽江、玉溪、石屏地区,黑龙江的样品购自昆明福临堂。全草样品洗净、风干、碾细、过40目筛,于60℃烘箱中干燥,存放于干燥器中备用。
2.2实验方法
2.2.1 药材样品中铅总量测定
准确称取灯盏花粉末样1g,加入25mL浓HNO3浸泡,放置过夜,进行预分解。然后低温加热消化至近干,取下,稍冷后加入5mLHClO4及10mL浓HNO3,再加热至溶液澄清或有白色晶体析出,大火加热使大量白烟冒尽后,冷却,用水定容至25mL容量瓶中,供ICP-AES测定铅含量(若仍有沉淀,需先过滤再用于测定)。
2.2.2 铅形态分离及分析流程
铅形态分离及分析流程见图1.
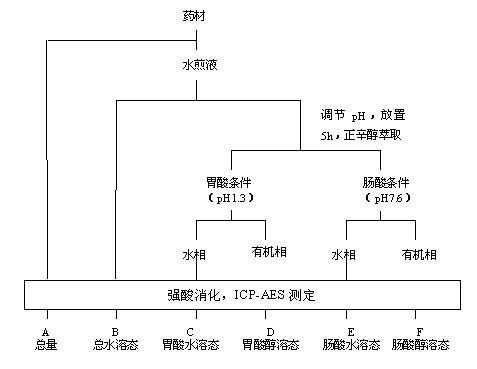
图1 样品形态分离步骤流程图
形态差减:D=B-C;F=B-E
2.2.3水煎液的制备
制备时沿袭传统中药煎煮法,与中药临床用药接近。准确称取灯盏细辛药材10g,放入250mL烧杯中,煎煮3次,每次加水150mL,加热至沸腾后保持微沸15min,合并3次的水煮液,过滤,滤液加热浓缩后定容至50mL。
2.2.4水煎液中铅总量测定
取适量上述水煎液,加入10mL浓HNO3,小火消化至小体积,稍冷,加入1mL
HClO4及5mL浓HNO3,继续消化至溶液澄清或有白色晶体析出时,大火加热使大量白烟冒尽,取出冷却,定容至25mL容量瓶中。用于ICP-AES测定水煎液中铅的含量。
2.2.5水煎液中铅的形态分析
取适量上述水煎液两组,分别用HCl(6mol/L)和NaOH(2mol/L)调溶液的pH值,一组调为胃液的酸度(pH=1.3),另一组调为小肠液的酸度(pH=7.6)[5],放置5h,移入分液漏斗中,每份均加入5mL正辛醇振荡萃取两次(每次振荡10min后静置分层30min),合并两次的水相按1.2.4所述方法消化后测定水煎液中水溶态铅的含量,用差减法求得醇溶态铅的浓度。
3 结果与讨论
表1 样品中Pb的形态分布(mg/g)
产地 |
总量 |
总水溶态 |
水煮溶出率( %) |
胃酸条件( pH1.3) |
肠酸条件( pH7.6) |
||||
胃酸水溶态 |
胃酸醇溶态 |
Kow1 |
肠酸水溶态 |
肠酸醇溶态 |
Kow2 |
||||
石屏 |
110.4 |
6.55 |
5.9 |
2.60 |
3.95 |
1.52 |
1.97 |
4.58 |
2.32 |
丽江 |
54.3 |
5.96 |
11.0 |
1.62 |
4.34 |
2.68 |
2.84 |
3.12 |
1.10 |
玉溪 |
48.1 |
1.13 |
2.3 |
0.3 |
0.83 |
2.77 |
0.52 |
0.61 |
1.17 |
黑龙江 |
64.7 |
2.46 |
3.8 |
1.86 |
0.60 |
0.32 |
0.75 |
1.71 |
2.28 |
由表可知:云南大部分产地的灯盏花样品中铅的含量与黑龙江产的样品没有显著差别,且数值均较高。云南产灯盏花中除石屏的样品中铅含量异常偏高(110.4μg/g)外,其余样品的铅含量无显著差异。通常中药的金属含量与其种植土壤有关,土壤中金属含量高,则药材中该金属含量也高。因此,石屏样品中铅含量过高可能是由于该种植地受到铅的污染所致。
尽管药材样品中的Pb的总量较高(如新加坡规定中药中Pb<20×10-6;法国规定Pb<5.0×10-6[9]),但水煮溶出率较低,即总水溶态很少,说明常规的中药煎服方式引入人体的Pb的量很少。因此单纯用总量衡量铅对人体的危害并不全面,而应该具体考虑其化学形态及分布情况。通过模拟人体胃肠酸碱变化对金属元素形态转化的影响可知:无论是在肠酸条件(pH7.6),还是在胃酸条件(pH1.3)下,Kow都较大(黑龙江样品例外,胃酸条件下的Kow1仅为0.32),说明水溶态Pb被人体吸收的可能性较高。
总而言之,从降低中药材中有害金属元素含量角度考虑,应该进行规范种植,既要考虑药材的品种,也要选择适宜的产地。而在制定药材的重金属质量控制标准方面,则不能只控制总量,或以总量一个标准来衡量药材的优劣。
REFENENCES
[1] Gao M, Huang W, RoyChowdhury M, et al. , Analytica chimica acta, 2007,591
(2), 161-166.
[2] Liu H, Yang X L , Ren T,et al. , Fitoterapia, 2005 ,76 (7-8), 666-670.
[3] Chu Q, Wu T, Fu L,et al., Journal of Pharmaceutical and Biomedical Analysis, 2005,37
(3), 535-541.
[4] Chen B, Li B G, Zhang G L , Natural product research, 2003,17 (1),
,37-40.
[5]Li S L,Luo X F, Ma D, et
al., Progress in Pharmaceutical Sciences, 2006,30(2),49-56.
[6] Li S X, Den N S, Liu Z Q, Progress in Pharmaceutical Sciences, 2002,18
(2),145-148.
[7] Wu Y W, Zhang H, Hu B, et al., Journal of Analytical Science,
2003,19(3),201-204.
[8] Lu Z, Xu X, LUO Y F, GUANGDONG Trace Elements Science, 2000,7(5),65-67.
[9] Zhang D T, Zhang Z L, Han L, LISHIZHEN Medicine and
Materia Medcia Research,