http://www.chemistrymag.org/cji/2007/09a045pc.htm |
Oct.14,
2007 Vol.9 No.10 P.45 Copyright |
Zhao Yu1, Yang Gengliang 1, 2, Zhang Li3, Wang Lijuan1, Bai Ligai1, Zhu Shiguo1
(1Phamacy College of Hebei University, Baoding 071002, China; 2 Molecular Science Center, Institute of Chemistry, Chinese Academy of Sciences, Beijing 100080, China; 3 China Institute of Veterinary Drug Control, Beijing 100081, China)
Abstract Objective An analytical
method of capillary column gas chromatography was introduced for the determination of
alcohol and acetone residuals in crude drug of Polyene Phosphatidyl Choline Injection. Method
Internal standard method was utilized to calculate the content of residual solvents
and n-propyl alcohol was chosen as the internal standard. AT SE-54 capillary column was
used in the experiment. N2 was used as carrier gas, The rusult was examined by
Flame Ionization Detection (FID). Result Alcohol was detected in the crude
drug. The linearity was good from 0.005 mg·mL-1 to 1.5 mg·mL-1.
The average recoveries of alcohol and acetone was 99.4% and 99.0%, respectively. Conclusion
This method was successfully applied to determine the quantity of alcohol and acetone
residuals in crude drug of Polyene Phosphatidyl Choline Injection with high sensitivity
and good reproducibility. Moreover, the method was very easy to perform and the results
were reliable.
Keywords capillary gas chromatograhpy; Polyene Phosphatidyl Choline Injection;
internal standard; residual solvents
(1河北大学药学院,河北 保定 071002;2中国科学院化学研究所分子科学中心,北京 100080;3中国兽医药品监察所,北京 100081)
国家自然科学基金资助项目(NO.20375010,20675084),河北省科技攻关项目(NO.06276479D,07276407D),中国科学院“百人计划”资助项目
摘要
目的 采用毛细管气相色谱法建立多烯磷脂酰胆碱注射液原料药中残留乙醇和丙酮的检测方法。方法 使用气相色谱仪,AT. SE-54毛细管柱,程序升温,N2为载气,不分流模式,氢火焰离子化检测器(FID),以正丙醇作为内标物,采用内标法计算残留溶剂的含量。结果 多烯磷脂酰胆碱注射液原料药中有乙醇检出。乙醇和丙酮在0.005-1.5 mg·mL-1具有良好的线性,平均加标回收率乙醇为99.4%,丙酮为99.0%。乙醇和丙酮的检出限分别为0.20 mg·L-1和0.13 mg·L-1。结论 该方法简便,准确,重现性好,精密度高,适用于多烯磷脂酰胆碱注射液原料药中残留溶剂的测定。关键词 毛细管气相色谱;多烯磷脂酰胆碱注射液;内标;残留溶剂 多烯磷脂酰胆碱为一种强力肝细胞膜修复剂,具有修复肝细胞生物膜、促进肝细胞代谢酶活性、改善血液脂质代谢、抗脂质过氧化和抗肝纤维化等功效,因而为治疗脂肪肝和保肝抗纤维化的一种有效药物。可用于防治各种原因所致的脂肪肝、酒精性肝病、急慢性肝炎、中毒性肝病、肝硬变、胆汁瘀积以及肝胆手术前后的保肝治疗等。
由于在多烯磷脂酰胆碱注射液原料药生产过程中使用了乙醇和丙酮等有机溶剂,且多烯磷脂酰胆碱注射液为注射剂,有必要对乙醇和丙酮残留量进行检验。人用药品注册技术规范国际协调会(ICH)把乙醇列为三类溶剂[1~3],低毒,ICH规定限度为0.5%;而丙酮属于二类溶剂,毒性较大[4],因此有必要对他们的含量进行测定。目前,经文献报道的常见的残留量分析方法有顶空气相色谱法[5],气-液平衡法,二硫化碳萃取法等[1, 6],最常用的就是顶空气相色谱法和固相微萃取-气相色谱法[5, 7]。而多烯磷脂酰胆碱注射液原料药中残留乙醇和丙酮的测定及方法学的建立尚未见报道。本文采用毛细管气相色谱法,用内标法定量,方法简便,准确,重现性好,精密度高,适用于多烯磷脂酰胆碱注射液原料药中残留溶剂的测定。
1
实验部分1.1 样品与试剂
多烯磷脂酰胆碱注射液原料药由保定三九济世生物药业有限公司提供,批号为:y104100,y104101,y104102;无水乙醇、丙酮、正丙醇和氯仿均为分析纯。
1.2 仪器
Agilent6820气相色谱仪(配FID)及Agilent QA-QC工作站(USA),TX-300 氮、氢、空气发生器及TJ-1净化器(北京安瑞吉公司)。
1.3色谱条件
载气:高纯N2,流速1.0 mL·min-1;进样口:200 ℃;检测器:FID,350 ℃;分流模式:不分流;色谱柱:AT SE-54(50 m×0.32 mm×0.33 mm);进样量:1.0 mL;柱温:初始温度56℃,保持1 min,然后以4 ℃·min-1的速度升温至80 ℃,保持6 min后,以20 ℃·min-1的速度升温至100 ℃,保持2 min。
1.4 溶液的制备
1.4.1标准储备液的制备 精密称取无水乙醇250.0 mg、丙酮250.0 mg置于25 mL容量瓶中,用氯仿配制乙醇和丙酮浓度均为10 mg·mL-1的标准储备液。
1.4.2内标溶液的制备 精密称取正丙醇100.0 mg置于10 mL容量瓶中,加氯仿溶解并定容,得到10 mg·mL-1的内标溶液。
1.4.3对照品的制备 精密称取标准储备液适量,加入一定量内标,并用氯仿定容,得到0.1 mg·mL-1的对照品溶液(乙醇、丙酮的浓度分别为0.1 mg·mL-1,含内标0.08 mg·mL-1)。
1.4.4供试品的制备 精密称定原料药0.10 g置于5 mL容量瓶中,加入一定量内标液并用氯仿溶解定容,得到供试品溶液(含内标0.08 mg·mL-1)。
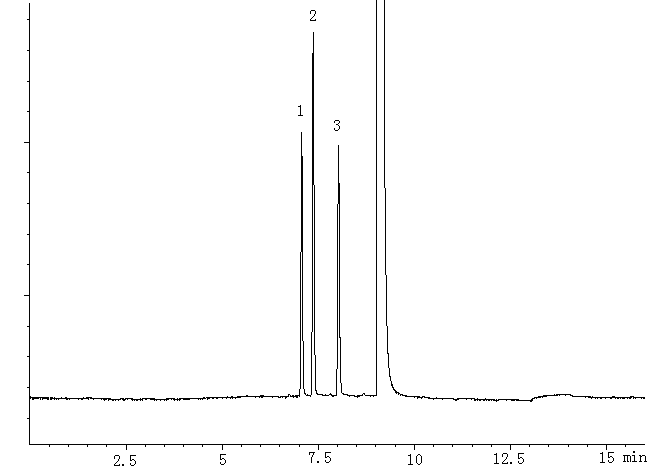
图
1 对照品色谱图1: 乙醇峰 2: 丙酮峰 3: 正丙醇峰
Fig.1 Chromatograms of reference solution
1: peak of alcohol 2: peak of acetone 3: peak of n-propyl alcohol
2
结果与讨论2.1 系统适应性试验
取对照品溶液进样分析,色谱图见图1.乙醇、丙酮和内标物都得到了良好的分离,且无其它物质干扰。乙醇和丙酮的理论塔板数分别为51155,55605,各物质分离度大于1.5,故此色谱条件可满足测定的要求。
2.2 线性关系和检出限
分别精密量取标准储备液适量,各加入同量的内标,用氯仿定容,得到含乙醇、丙酮各0.15 mg·mL-1 、0.10 mg·mL-1、0.05 mg·mL-1、0.01 mg·mL-1、0.005 mg·mL-1的系列标准溶液。
在上述色谱条件下各浓度溶液分别进样,进样量1.0 mL,以乙醇与正丙醇峰面积之比(F乙)为纵坐标,乙醇浓度(C乙,mg·mL-1)为横坐标,绘制标准曲线,进行线性回归计算,得回归方程:F乙 = 10.50 C乙 - 0.08,r = 0.9995;以丙酮与正丙醇峰面积之比(F丙)为纵坐标,丙酮浓度(C丙,mg·mL-1)为横坐标,绘制标准曲线,进行线性回归计算,得回归方程:F丙 = 12.67 C丙 - 0.006, r = 0.9999。乙醇和丙酮浓度在0.005- 0.15 mg·mL-1 之间线性关系良好。
将对照品溶液逐级稀释,当信噪比为3时,计算得到乙醇、丙酮的检出限分别为0.2 mg·L-1和0.13 mg·L-1。
2.3 加标回收率试验
精密称取已知残留量的原料药(批号:y104100)0.25 g共10份,分别置25 mL容量瓶中,其中一份作为空白,分别精密加入无水乙醇和丙酮各7.5 mg, 12.5 mg, 17.5 mg(每个浓度各三份),然后加入0.2 ml内标溶液并用氯仿定容,摇匀。分别进样测定并同时进样对照品,按内标法[8]计算实测质量浓度。计算得乙醇和丙酮的平均回收率分别为99.4%和99.0%,RSD分别为2.1%,1.7%,结果见表1。
表1 加样回收率实验结果
Table 1 Results of recovery
added(mg·mL-1) |
detected(mg·mL-1) |
Recovery(%) |
Average recovery(%) |
RSD(%) |
|
乙醇 |
0.300 |
0.303 |
101.0 |
99.4 |
2.1 |
0.309 |
103.0 |
||||
0.293 |
97.7 |
||||
0.500 |
0.489 |
97.8 |
|||
0.509 |
101.8 |
||||
0.495 |
99.0 |
||||
0.700 |
0.694 |
99.1 |
|||
0.679 |
97.0 |
||||
0.685 |
97.9 |
||||
丙酮 |
0.300 |
0.298 |
99.3 |
99.0 |
1.7 |
0.288 |
96.0 |
||||
0.302 |
100.7 |
||||
0.500 |
0.494 |
98.8 |
|||
0.487 |
97.4 |
||||
0.510 |
102.0 |
||||
0.700 |
0.692 |
98.9 |
|||
0.688 |
98.3 |
||||
0.696 |
99.4 |
||||
2.4
对照品精密度实验精密量取对照品溶液1.0 mL,重复进样5次,测定峰面积,计算F乙醇(A乙醇/A正丙醇),F丙酮(A乙醇/A正丙醇),然后分别计算F乙醇和F丙酮的相对标准偏差RSD,RSD (F乙醇) = 1.10%,RSD(F丙酮) = 0.59%。
2.5 重现性实验
取同一批原料药按1.4方法制备供试品溶液6份,分别进样,计算乙醇和正丙醇的峰面积之比(F乙醇),计算相对标准偏差,RSD = 0.35%。
2.6样品的测定
对照品溶液进样三次,记录色谱图(见图2)和峰面积,按公式f = (CR/AR)/(CS/AS),计算乙醇和丙酮的相对校正因子并计算平均值得f乙醇 = 1.35,f丙酮 = 0.95。对三批原料药的供试品进行残留溶剂的测定,每批进样三次,记录峰面积,依照内标法按公式
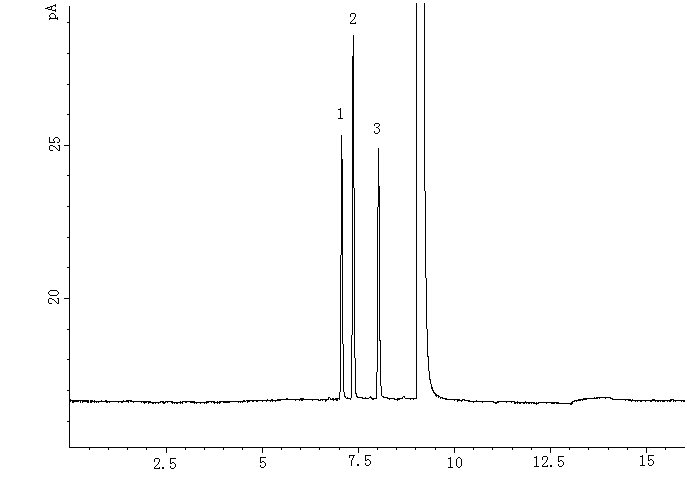
图
2 供试品色谱图1: 乙醇峰 2: 正丙醇峰
Fig.2 Chromatograms of sample
1: peak of alcohol 2: peak of n-propyl alcohol 表2 供试品中乙醇和丙酮残留量的测定结果
Table 2 Results of alcohol and acetone residuals in sample
批号 Batch number |
乙醇 alcohol |
丙酮 acetone |
|
浓度 concentration(mg·mL-1) |
残留乙醇质量分数 Quality score of alcohol residual(%) |
||
y104100 |
0.0164 |
0.082 |
—— |
y104101 |
0.0166 |
0.083 |
—— |
y104102 |
0.0167 |
0.084 |
—— |
3.
结论本文使用毛细管气相色谱法,用内标法定量,建立了多烯磷脂酰胆碱注射液原料药中残留溶剂的测定方法,精密度高,回收率实验、重现性实验结果良好,均能符合药典要求,具有一定实用价值。该方法简便、快速、准确,适用于多烯磷脂酰胆碱注射液原料药中残留溶剂的测定。用本方法测定3批多烯磷脂酰胆碱注射液原料药,溶剂残留总量小于0.5%,符合标准规定。 REFERENCES
[1] Yan Z, Xiao J J, Cui J B, et al.. Journal of Hebei University (Natural Science Edition)(Heda Xuebao(Ziran Kexue Ban)), 2005, 25 (6): 619~622
[2] Liang X Y, Chen Z, Xue L J. Drug Standarda of China (Zhongguo Yaopin Biaozhun), 2004, 5 (5), 30~32
[3] Guo Q, Zhang L J, Dong H W, Chinese Pharmaceutical Journal(Zhongguo Yaoxue Zazhi), 2002,37 (7): 537~539
[4] Wang M, Wang J H, Bai X P. Journal of Pharmaceutical Practice (Yaoxue Shijian Zazhi), 2006, 24 (1): 27~29
[5] Otero R, Carrera G, Dulsat J F, et al.. Journal of Chromatography A, 2004, 1057: 193~201
[6] Liu B P, Zhou Y, Luo X. Chinese Journal of Analysis Laboratory (Fenxi Shiyanshi), 2007, 4 (26): 69~72
[7] Coran S A, Giannellini V, Furlanetto S, et al.. Journal of Chromatography A, 2001, 915: 209~216
[8] Chinese Pharmacopeia(Zhongguo Yaodian). The Pepoles Republic of China national pharma-copeia committee. The second section [S]. Beijing. Chemical Industry Publishing Company 2005: appendix VE: 31