http://www.chemistrymag.org/cji/2008/104018pc.htm |
Apr. 1,
2008 Vol.10 No.4 P.18 Copyright |
(College of Materials Science and Engineering, Huaqiao University, Quanzhou 362021, China)
Abstract
Cloud point extraction of trace Pyrene from aqueous solution with sodium dodecyl sulfate (SDS) which determined by HPLC was carried out. The parameters affecting the separation and detection were investigated, which include SDS, HCl, NaCl, extraction time and temperature.Under the optimized condition, the concentrations of Pyrene showed a linear range of 0-10.0 mg·L-1 with R2=0.9994. The spiked recoveries and the detection limit of the proposed method were found to be 80.7-105.1% and 13.6 mg·L-1, respectively. The experimental results indicated that the proposed method was successfully applied to the determination of Pyrene in real water samples.Keywords Cloud point extraction(CPE);Pyrene;Sodium dodecyl sulfate(SDS);High performance liquid chromatography (HPLC) 浊点萃取-高效液相色谱测定水中痕量的芘
陈虹丽
薛秀玲 徐玮(华侨大学材料科学与工程学院,福建 泉州362021) 2008年1月14日收稿;福建省青年人才创新基金(No.2005J029)、国务院侨办科研基金(No.05QJR05)、华侨大学高层次引进人才科研基金资助项目
摘要 采用阴离子表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate, SDS)浊点萃取(Cloud Point Extraction,CPE),高效液相色谱(High performance liquid chromatography,HPLC)测定水中痕量的芘(Pyrene),考察适宜的反应条件和影响因素(SDS、HCl和NaCl)。在最佳条件下,方法检测限为13.6 mg·L-1,线性范围为0~10.0 mg·L-1,回收率为80.7~105.1%。方法快速、简便、经济,应用于水中痕量芘的测定,结果满意。
关键词 浊点萃取;芘;十二烷基硫酸钠;高效液相色谱
多环芳烃(polycyclic aromatic
hydrocarbons, PAHs)是广泛存在于环境中的有毒有机污染物,其化学性质稳定,在环境中长期留存,并通过环境蓄积、生物蓄积、生物转化或化学反应等方式污染环境,威胁生物健康,已成为全球环境污染研究的重要内容和热点课题[1]。
浊点萃取(Cloud Point Extraction,CPE)是近年来出现的一种新型液-液萃取技术,它以表面活性剂胶束水溶液的溶解性和浊点现象为基础,通过改变实验条件(如温度、电解质等)引发水相和表面活性剂相分离,该法不使用挥发性有机溶剂,具有萃取率高、富集倍数大,操作简便、安全,可实现联用化等优点,因此受到人们的极大关注,在生物大分子分离纯化、有机小分子分离测定及金属离子分离富集等方面得到广泛应用[2-4]。
用于浊点萃取PAHs的多为非离子型表面活性剂,如Triton X 系列[5-8], PONPE 系列[9,10]和Brij系列[11-14]]等,而阴离子型表面活性剂SDS用于浊点萃取有以下优点:萃取效果好,易于分离,且低毒,价廉,本研究使用HCl使SDS质子化,加入NaCl降低体系的浊点,高效液相色谱测定,讨论影响浊点萃取痕量芘的各项因素,建立了水中痕量芘简单、快速、灵敏测定的新方法。
1 实验部分
高效液相色谱仪(Agilent1100, 美国安捷伦科技有限公司);UV-4802H型紫外可见分光光度计(尤尼柯(上海)仪器有限公司);KQ-100型超声波清洗器(昆明市超声仪器有限公司);DK-S24电热恒温水浴锅(上海精密实验设备有限公司);800B离心机(上海安亭科学仪器厂);SHZ-D(Ⅲ)循环水式真空泵(上海贺德实验设备有限公司)。
芘(pyrene, Aldrich Chem.Co. , AR);甲醇(TEDIA COMPANY, INC.USA , HPLC);甲醇(广东汕头市西陇化工厂, AR);浓盐酸(上海化学试剂有限公司,AR);SDS(Biosharp , AR);氯化钠(广东汕头市西陇化工厂, AR)。
1.2 实验方法
1.2.1芘-甲醇紫外最大吸收波长的测定
分别取0、0.05、0.15、0.3、0.6、1.0mL 10 mg·L-1芘-甲醇标准液,于10mL具塞试管中,甲醇定容至5 mL,摇匀。以甲醇为参比,用UV-4802H型紫外可见分光光度计,从200nm~500nm对甲醇和芘-甲醇标准液进行谱图扫描,确定芘-甲醇的最大吸收波长。
1.2.2 浊点萃取过程和分析指标的测定
取适量芘-甲醇标准液于10 mL具塞试管中,依次加入SDS、浓HCl、饱和NaCl溶液, Milli-Q水定容至10 mL,摇匀,2000 rpm离心10 min,使表面活性剂相与水相分离,富集于上层,用自制取样器取出SDS相,甲醇定容至3 mL后,高效液相色谱仪测定。同时做一根全程空白管,即试管中不加芘-甲醇的标准液,其他操作完全同上,以消除试剂误差。
萃取率采用标准曲线法测定,相体积比,简称相比,即分离富集后表面活性剂富集相(Vs)和水相(Vw)的体积比。
1.2.3 高效液相色谱分析条件
色谱柱:Aichrom ODS-C18柱(250 mm×4.0 mm,5 mm);流动相:甲醇-水 (90:10);流速:0.8 mL·min-1;柱温:30 ℃;紫外吸收检测器波长:239 nm;进样量:20 mL。
1.2.4 样品处理
自来水、校园秋中湖水、泉州东湖水用0.45 mm孔径滤膜过滤以除去水中悬浮颗粒物,置于4 ℃冰箱中待用。
2 结果与讨论
芘-甲醇标准液的紫外-可见吸收光谱图如图1所示,相应浓度分别为0、0.1、0.3、0.6、1.2、2.0 mg·L-1。
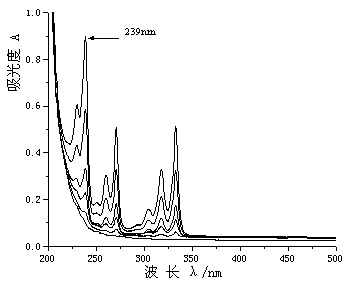
图1 芘-甲醇标准液的吸收光谱图
Fig. 1 UV-Vis absorption spectra of pyrene titer
由图1,芘-甲醇标准液在200 nm~500 nm内有多个吸收峰,最大吸收峰在239 nm处,随芘浓度的递增,其吸光值线性增加。因此选择239 nm作为本实验体系的测定波长。
2.2影响浊点萃取的因素
2.2.1 SDS对浊点萃取的影响
SDS的浓度决定了表面活性剂富集相的体积,进而影响萃取率和方法检测限。由图2,随着SDS的增加,相比增加,芘的萃取率呈现先增加后降低的趋势。这是因为SDS浓度过低(<1.25%时),萃取不完全,SDS浓度过大(>2%时),表面活性剂分子碰撞结合几率增大,容易聚集成液滴,萃取率降低,同时增加了相比,降低了富集倍数。另外实验发现,随着SDS浓度增加,浊点降低,当SDS浓度为1.25%时,浊点已降至室温,在保证萃取完全的情况下,实验选择SDS浓度为2.0%。
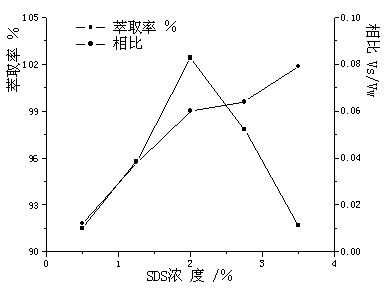
图2 SDS对萃取率和相比的影响
Fig.2 Effect of SDS on
extraction efficiency and the phase volume ratio
注:Pyrene=0.9 mg·L-1,HCl=3.0
mol·L-1,NaCl=0.92 mol·L-1
2.2.2 浓HCl、饱和NaCl对浊点萃取的影响
实验中加入HCl的目的,是使SDS质子化,由阴离子型转化为非离子型表面活性剂,胶束浓度增高,出现浑浊,最终形成双液相实现与水相的分离[15-19]。NaCl可降低体系的浊点,促进相分离的发生。图3和图4显示了HCl和NaCl对萃取率和相体积比的影响。
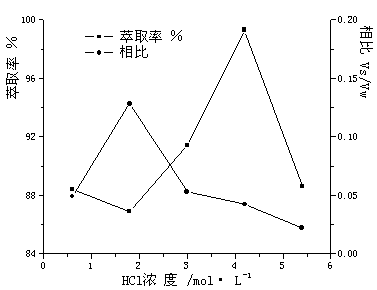
图3 HCl对萃取率和相比的的影响
Fig.3 Effect of HCl on extraction efficiency and the phase
volume ratio
注:Pyrene=0.9 mg·L-1,SDS=2%,NaCl=0.92 mol·L-1
由图3可知,较低浓度的HCl是为了溶解SDS,体系无浊点现象,HCl浓度增加,萃取率逐渐增大,而过多的[H+]也不会增加芘的萃取率。结果表明HCl浓度在0.5~5 mol·L-1时均可引发相分离。且随HCl浓度的增大,浊点逐渐降低,相体积比逐渐减小,浓度为4.2 mol·L-1时,浊点降至室温,萃取率最高,同时相体积比较小,浓缩倍数较高,因此实验选择HCl浓度为4.2 mol·L-1。
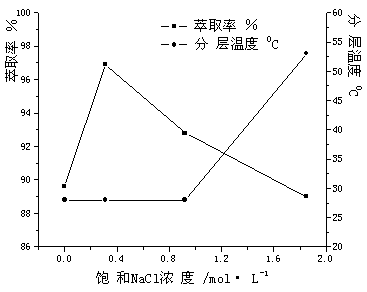
图4 NaCl对萃取率和分相的影响
Fig.4 Effect of NaCl on
extraction efficiency and the phase separation
注:Pyrene=0.9 mg·L-1,SDS=2%,HCl=4.2 mol·L-1
图4表明体系中加入NaCl,在室温即有明显的浊点现象,浓度为0.31 mol·L-1时萃取率可达到97%,表明NaCl的盐析作用,使胶束中氢键断裂,胶束间斥力减小,浊点降低,达到表面活性剂相与水相的分离。
NaCl浓度>0.31 mol·L-1时,体系密度减小,水相与表面活性剂相分层所需能量加大,需要加热到53
℃,才可达到两相分离,在同样萃取条件下,萃取率降低。另外,过量的NaCl(1.90 mol·L-1)改变了体系中的离子强度,造成SDS不溶解,体系出现白色絮状物,难与水相分离,导致了萃取率下降。因此实验选择NaCl浓度为0.31 mol·L-1。
2.2.3 平衡温度和平衡时间对浊点萃取的影响
酸性条件下,体系在室温下即可实现相分离,但耗时长,约24h,水浴加热,可使时间缩短,说明加热可促进相分离。
根据实验,平衡时间约30min即可达到较好的萃取效果,实验考察水浴恒温30min,平衡温度对芘萃取率和相比的影响(见图5)。
由图5可知,随温度升高,萃取率迅速提高,在50℃时达到最高,而后降低,趋于平衡。体系温度较低时,SDS的亲水基团与水分子形成氢键,PAHs不易进入SDS富集相;温度升高后,氢键断裂,水化层被破坏,SDS疏水性增强,两相分离[9]。同时热扰动增强,胶束的增溶空间增大,水相残留的SDS浓度迅速减小,有利于萃取率的提高。但由于溶质在胶束中的增溶过程为放热过程,升高温度使胶束对溶质的增溶能力减弱,萃取率反而降低。在40~80 ℃范围内,温度升高,表面活性剂富集相凝聚效果越好,相体积比降低。综合考虑,实验选择50
℃。
浊点萃取需要一定时间使SDS形成胶束来包裹疏水物质PAHs,将其萃取进凝聚相,在50
℃下,实验考察了恒温时间对萃取效果的影响,结果如图6所示。
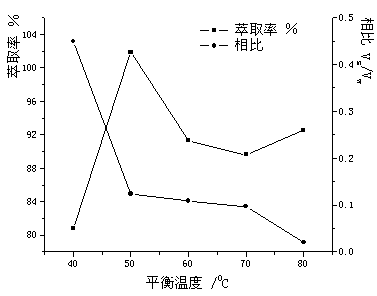
图5 平衡温度对萃取率和相比的影响
Fig.5 Effect of temperature on
extraction efficiency and the phase volume ratio
注:Pyrene=0.9 mg·L-1,SDS=2%,HCl=4.2 mol·L-1,NaCl=0.31 mol·L-1
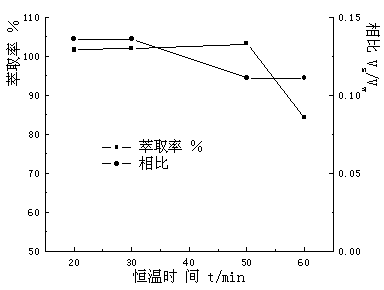
图6 恒温时间对萃取率和相比的影响
Fig.6 Effect of time on extraction
efficiency and the phase volume ratio
注:Pyrene=0.9 mg·L-1,SDS=2%,HCl=4.2 mol·L-1,NaCl=0.31 mol·L-1
由图6可知,恒温时间对萃取率的影响不大。加热20~50 min,萃取率均可达100%,继续加热,萃取率又会下降,这可能是因为继续加热阻碍了芘进入SDS胶束相。随着恒温时间延长,凝聚相逐渐浓缩,相比逐渐减小,在恒温50
min时,恒定不变。故实验选择恒温时间为50
min。
2.2.4 浊点萃取的最优条件
综上结果,浊点萃取的最优条件为:2%SDS;HCl浓度4.2
mol·L-1;NaCl浓度0.31 mol·L-1;平衡温度50
℃;平衡时间50 min。
2.3 芘-甲醇溶液的标准工作曲线
准确配制7个浓度梯度的芘-甲醇标准液,进行色谱分析,根据峰面积对其含量绘制标准曲线。线性回归方程为y=438.98533x-8.75855,相关系数R2=0.9994,线性范围0~10.0 mg·L-1。
2.4方法检测限的测定
方法检测限(method detection limit,MDL)的确立参照文献[20],即基底加标试样经历预处理与仪器分析全过程,经n(≥4)次平行测定,计算其标准偏差s
,则MDL=s tf,0.01(单边)=s tf,0.02(双边)。计算得到的MDL与加标浓度进行比较,如果加标浓度£
5MDL,则以上过程有效,否则,调整加标浓度,重新测定与计算MDL。
以Milli-Q水为样品基底,芘-甲醇浓度为0.05 mg·L-1,平行测定4次,平均值为0.070
mg·L-1,SD为0.003 mg·L-1,查表t3,
0.01(单边)为4.541,计算得本方法的检测限MDL = S.D. ×t3, 0.01(单边)=0.0136
mg·L-1,加标浓度(0.05 mg·L-1)小于5倍的MDL值(0.068 mg·L-1),计算所得的方法检测限有效。
2.5 基底加标实验及样品测定
为验证该法的可行性,在最佳条件下,选择Milli-Q水、自来水和湖水样品进行测定及基底加标实验,考察了方法的回收率和精密度,结果见表1。
表1 实际样品和加标回收率实验结果
(n=3)
Tab. 1 Results of real sample and recoveries
of spiked samples (n=3)
水样 |
加入浓度 (mg·L-1) |
平均值± SD |
加标回收率 (%) |
RSD(%) |
Milli-Q 水 |
0 |
ND |
- |
- |
0.2 |
0.188±0.003 |
94.0 |
1.60 |
|
1.0 |
1.051±0.005 |
105.1 |
0.48 |
|
3.0 |
2.820±0.232 |
94.0 |
8.23 |
|
秋中湖水 |
0 |
ND |
- |
- |
0.2 |
0.198±0.003 |
99.0 |
1.52 |
|
1.0 |
0.962±0.002 |
96.2 |
0.21 |
|
3.0 |
2.734±0.077 |
91.1 |
2.82 |
|
东湖水 |
0 |
ND |
- |
- |
0.2 |
0.193±0.003 |
96.5 |
1.56 |
|
1.0 |
1.024±0.006 |
102.4 |
0.59 |
|
3.0 |
2.604±0.168 |
86.8 |
6.45 |
|
自来水 |
0 |
ND |
- |
- |
0.2 |
0.180±0.002 |
90.0 |
1.11 |
|
1.0 |
0.904±0.017 |
90.4 |
1.89 |
|
3.0 |
2.422±0.143 |
80.7 |
5.91 |
注:
ND为未检出。3 结束语
REFERENCES
[1] 胡健.贵阳市大气-水体-土壤环境中多环芳烃的研究[D].中国科学院地球化学研究所,2005.
[2] Paleologos E K, Giokas D L, Karayannis M I. Trends in Analytical Chemistry, 2005, 24(5): 426-436.
[3] Li J L, Chen B H. Journal of Colloid and Interface Science, 2003, 263: 625-632.
[4] Giokas D L, Eksperiandova L P, Blank A B et al. Analytica Chimica Acta, 2004, 505: 51-58.
[5] Sirimanne S R, Barr J R, Patterson D G et al. Anal. Chem, 1996, 68: 1556-1560.
[6] Fang Q, Yeung H W, Leung H W et al. Chromatogr A, 2000, 904: 47-55.
[7] Garcia-Pinto C, Perez-Pavon J L, Moreno-Cordero B.Anal. Chem, 1995, 67: 2606-2612.
[8] Wu Y C, Huang S D. Anal. Chim. Acta, 1998, 373: 197-206.
[9] Casero I, Sicilia D, Rubio S et al. Anal. Chem, 1999(71): 4519-4526.
[10] Saitoh T, Hinze W L. Anal. Chem, 1991, 63: 2520-2525.
[11] Eiguren-Fernandez A, Sosa-Ferrera Z, Santana-Rodriguez J J. Anal. Chim. Acta, 1998, 358: 145-155.
[12] Sirimanne S R, Patterson D G, Ma L et al. Chromatogr, B 1998, 716: 129-137.
[13] Eiguren-Fernandez A, Sosa-Ferrera Z, Santana-Rodriguez J J. Analyst, 1999, 124: 487-494.
[14] Ba'rbara D, Vero′nica P, Juan H. Analyst, 2005, 130: 571-577.
[15] 马岳,黄骏雄.上海环境科学, 2000, 19(7): 319-324.
[16] Francisco M, Soledad R, Dolores P B. Journal of Chromatography A, 2002, 962: 1-8.
[17] Sicilia D, Rubio S, Pe?rez-Bendito D et al. Analytica Chimica Acta, 1999 , 392: 29-38.
[18] Theodosios I, Sikalos, Evangelos K. P. Anal. Chem, 2005, 77: 2544-2549.
[19] Nascentes C C,Arruda M A Z. Talanta, 2003, 61: 759-768.
[20] Berger W, McCarty H, Smith R K. Environmental Laboratory Data Evaluation[M].GA,the Unites States:Genium Publishing Corporation, 1996: 2-11.