http://www.chemistrymag.org/cji/2008/105025pc.htm |
May 1,
2008 Vol.10 No.5 P.25 Copyright |
Peng
Shuge1, Gao Qiuming2, Gao Xiping1, Lu Chang1,Zhang Yuqing1
(1 Laboratory of Polymer and Nanomaterials, Henan University of Science and Technology,
Luoyang 471003, Henan, China; 2 State Key Laboratory of High Performance Ceramics and
Superfine Microstructure, Shanghai Institute of Ceramics, Graduate School, Chinese Academy
of Sciences, Shanghai 200050, China)
Abstract Myoglobin(Mb) intercalated
magadiite nano-composites (Mb-magadiite) was successfully prepared by
exfoliation-reassembly method at room temperature and pH=7. Catalytic activity of
immobilized Mb in organic solvents with different hydrophobicity and different functional
groups were investigated detailedly. The results showed that function groups and molecular
constitution were both important factors to determine catalytic activity of immobilized Mb
in organic solvents except hydrophobicity of organic solvents.
Keywords Magadiite, Myoglobin, Enzyme Immobilization, Hydrophobicity.
层状
magadiite固定肌红蛋白复合物的催化行为研究彭淑鸽
1,高秋明2,高喜平1,陆昶1,张玉清1(1 河南科技大学高分子与纳米材料重点实验室 河南 洛阳 471003;2中国科学院上海硅酸盐研究所高性能陶瓷和超微结构国家重点实验室, 上海 200050)
摘要
在室温及pH=7下,通过剥离重组法成功实现了肌红蛋白分子在层状magadiite层间的固定。详细考察了固定后肌红蛋白分子在接近疏水度不同官能团的有机溶剂中以及不同疏水度相同官能团的有机溶剂中的催化活性。结果表明,除疏水度外,有机溶剂的官能团和分子构型也是影响固定后肌红蛋白催化活性的两个重要因素。关键词 层状硅酸盐,肌红蛋白,酶固定,疏水度
国家自然科学基金
(批准号20201013); 河南科技大学研究基金(批准号05-160, 2007QN065).由于酶的高效专一的催化特点,在药物、手性中间体以及生化试剂等有机合成领域极具吸引力。自从
Zarks 等[1]报道酶在有机溶剂中具有催化活性后,有机溶剂已被广泛应用于酶合成领域[2-7]。自由酶分子在有机溶剂中,由于团聚[8]和结构变化[9],催化效率大大降低。为了有效实现酶在有机溶剂中的催化,学者们构筑了很多在有机溶剂中的酶催化体系[10-13]。其中酶的固定化被普遍认为是实现酶在有机溶剂中催化走向工业化的最有前景的方法[14]。层状无机载体作为酶固定化载体,层间距会随着嵌入分子的大小而发生相应的变化,不仅可以有效地保护生物分子,而且层状材料的空旷骨架也不会堵塞生物分子的信号传输,是一种优良的载体材料。由于插层技术的限制,层状无机载体作为酶固定化载体报道相对较少,插层后生物分子在有机溶剂中的催化行为的研究就更少。
Magadiite 的层板结构处于粘土和沸石的骨架结构之间,是一种层板带孔的结构。我们课题组在实现了肌红蛋白Mb在magadiite层间的固定后[15],系统考察了固定亚铁血红蛋白分子在甲苯以及不同疏水度的有机溶剂中催化活性[16]。本工作详细考察了有机溶剂的官能团和分子构型对固定后肌红蛋白分子的催化行为的影响。
1 实验部分
肌红蛋白(Sigma公司),四丁基氢氧化铵(TBAOH, 40%水溶液,ACROS公司),邻苯二胺,丙酮,乙醇,乙腈,苯乙醇,丁醇均为分析纯,叔丁基过氧化氢为化学纯,Na-magadiite与H-magadiite根据文献方法制备。
日本理学RigakuD/Max-rB 型X射线衍射仪,管电压40V,管电流40A,扫描速率0.6oC/min;日本岛津公司UV-3101PC型紫外可见吸收光谱仪。
1.2 固定化肌红蛋白的制备
根据文献方法制备[15,17]:首先,以四丁基氢氧化铵作为剥离剂,通过插层反应制备TBA+插层的magadiite复合物(TBA-magadiite)溶胶;然后称取一定量肌红蛋白(Mb),溶解于磷酸盐缓冲溶液(pH=7)中;最后,取一定量TBA-magadiite溶胶,逐滴加入Mb中,搅拌1 h,即得固定化肌红蛋白复合物(Mb-magadiite)溶胶,最终溶胶中 Mb的浓度保持在2.0 mg/mL。
1.3 催化活性测试
选取叔丁基过氧化氢将邻苯二胺氧化成2,3-二氨基吩嗪作为催化体系;利用紫外可见吸收光谱,监测产物的吸收带强度随时间变化来测试固定前后Mb的催化活性。选取的具有接近疏水度的有机溶剂分别为:乙腈(log P=-0.33),乙醇(log P=-0.24),丙酮(log P=-0.23)。选取的具有相同官能团的有机溶剂分别为:乙醇(log P=-0.24),丁醇(log P=0.80)和苯乙醇(log P=0.90)。测试方法如下:
在反应瓶中加入有机溶剂20 ml,邻苯二胺(2.5 mM)0.5 ml,固定化Mb溶胶0.5 ml(含Mb 1.0 mg),在磁力搅拌条件下加入叔丁基过氧化氢(10.0 mM)0.5 ml,会迅速产生红色的2,3-二氨基吩嗪;取不同反应时间的产物进行测试,可以得到Mb的催化活性曲线。由于有机溶剂的极性不同,产物在溶剂中的吸收带位置有差异。
Mb在不同有机溶剂中的动力学常数通过构筑米氏方程获得。测试方法同上;不同之处在于:所用叔丁基过氧化氢的浓度改为1.0 mM。在整个测试过程中,固定Mb和叔丁基过氧化氢的用量,改变邻苯二胺的浓度,测试催化反应的初始反应速度。通过构筑底物浓度与初始反应速度的双倒数图,可得Km,Vmax,kcat 及 kcat/Km值。
2 结果与讨论
固定后肌红蛋白Mb的结构由X射线衍射决定。从图1可以看出,固定后Mb的层间距从1.56 nm增加到4.32 nm,比形成单层Mb分子插层的复合物层间距4.12 nm(magadiite层板厚度1.12 nm 加Mb分子的平均尺寸3.0 nm)要大,说明Mb分子在插层的同时,引进了水分子 [15]。
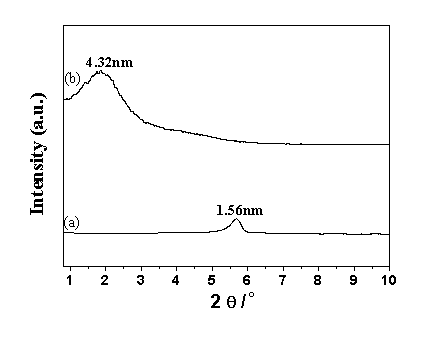
图1 肌红蛋白Mb插层前后样品的X射线衍射
Fig.1 Powder X-ray diffraction patterns of Na-magadiite (a) and Mb-magadiite (b)
2.2
固定后Mb在有机溶剂中的催化活性一般认为,酶在有机溶剂中的失活,是由于维持酶分子构象的“必需水”被有机溶剂剥夺或取代;而有机溶剂对酶分子表面“必需水”的扰动能力与溶剂的疏水度有关;疏水度越大,有机溶剂对 “必需水”的扰动能力越弱,酶活性越大。我们已经报道,固定后Mb在中等疏水度的有机溶剂中具有比自由Mb更高的催化活性和稳定性,原因归属于固定后Mb的特殊结构,即载体对Mb分子及其催化 “必需水”的保护,以及固定后Mb在中等疏水度的有机溶剂中良好的分散性。疏水度是否是决定酶催化活性的唯一因素,我们详细考察了有机溶剂的官能团对固定后Mb催化活性的影响。
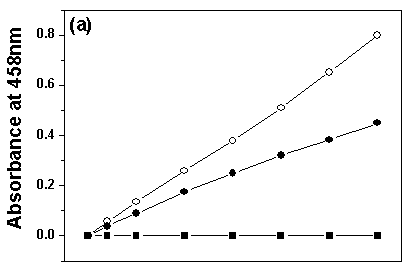
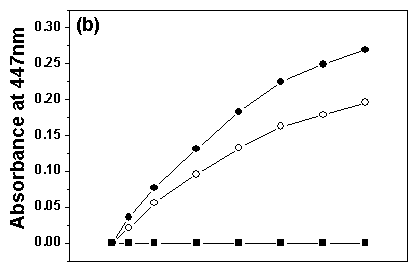
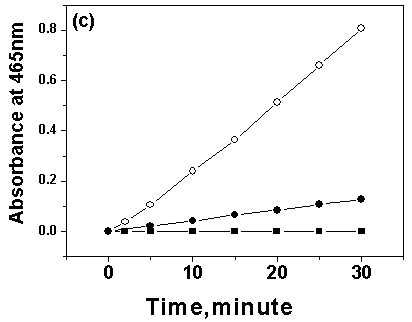
图2 固定前后肌红蛋白(Mb)在不同官能团的有机溶剂中的催化活性曲线
(○代表固定Mb,●代表自由Mb,■代表空白TBA-magadiite)
Fig.2 Catalytic activity plots of free and bound Mb in organic solvents with different functional groups. (a) Acetonitrile (b) Ethanol (c) Acetone
2.2.1
在不同官能团的有机溶剂中的催化选用的三种有机溶剂是乙腈(log P=-0.33),乙醇 (log P=-0.24)及丙酮(log P=-0.23)。固定前后Mb在不同官能团但接近疏水度的有机溶剂中的催化活性曲线如图2所示。
从图2可以看到,反应30 min后,在乙醇中,固定后的Mb催化活性是自由Mb催化活性的72.8%;而在乙腈及丙酮中,固定后Mb呈现出比自由Mb更高的催化活性,分别是自由Mb催化活性的1.78倍和6.37倍。
这三种溶剂具有接近的疏水度,但是在乙醇中固定化的Mb催化行为却截然不同于其在乙腈及丙酮中的催化行为。表明有机溶剂的疏水度不是影响固定化Mb催化活性的唯一因素,有机溶剂的官能团也是一个很重要的影响因素,即羟基对固定后Mb的催化活性扰动最大。
2.2.2在不同疏水度的有机溶剂中的催化
为了深入考察含羟基的有机溶剂对固定后Mb催化活性的影响,我们又选取了三种具有不同疏水度的含羟基的有机溶剂,分别是:乙醇(log P=-0.24),丁醇(log P=0.80)及苯乙醇(log P=0.90)。固定前后Mb在不同疏水度的含羟基的有机溶剂中的催化活性如图3所示。
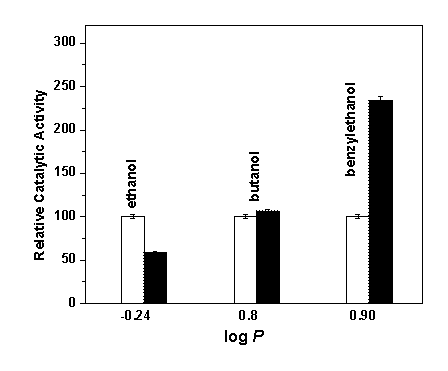
图3 固定前后肌红蛋白(Mb)在不同疏水度的羟基溶剂中的相对催化活性(自由Mb的催化活性指定为100%,□代表自由Mb,■代表固定Mb)
Fig.3 Relative catalytic activity columns of free and bound Mb in hydroxyl organic solvents with different hydrophobicity. (a) Ethanol (b)Butanol (c) Benzylethanol
从图3可以看到,固定前后Mb在不同疏水度的羟基溶剂中的催化活性的变化趋势:在乙醇中,固定后Mb的催化活性明显低于自由Mb;在丁醇中,固定后Mb的催化活性稍高于自由Mb;而在苯乙醇中,固定后Mb的催化活性显著高于自由Mb,是自由Mb催化活性的1.5倍。
这三种溶剂均含羟基,从乙醇到丁醇,疏水度明显增加,但固定后Mb的催化活性稍有增加;从丁醇到苯乙醇,疏水度接近,但固定后Mb的催化活性却显著增加。表明除了溶剂的官能团外,溶剂分子的构型也是一个很重要的因素。
2.3 固定化Mb的动力学行为
为解释有机溶剂对固定化Mb体系的催化,固定前后Mb的的动力学常数列于表1中。从表1可以看出,在丙酮和乙腈中,固定后Mb的Km和Vmax值要大于自由Mb;而在乙醇中,固定后Mb的Km和Vmax值降低。在丙酮中,固定后Mb的Vmax和kcat 值比自由Mb增加了将近5倍,在乙腈中增加了6.4倍;而在乙醇中,仅是自由Mb的57.9%。
表
1 固定前后肌红蛋白在不同官能团的有机溶剂中的动力学常数Table 1 Kinetic constants of free and bound Mb in organic solvents with different functional groups
Catalyzer |
Solvents |
Km/mM |
Vmax/mM·min-1·mg-1 |
kcat ×103/min-1 |
(kcat/Km) ×103/min-1·mM-1 |
Free Mb |
Acetone |
0.31 |
1.81 |
15.38 |
49.61 |
Bound Mb |
Acetone |
1.83 |
10.57 |
89.84 |
49.09 |
Free Mb |
Ethanol |
0.14 |
0.38 |
3.23 |
23.07 |
Bound Mb |
Ethanol |
0.11 |
0.22 |
1.87 |
17.00 |
Free Mb |
Acetonitrile |
0.58 |
0.75 |
6.38 |
11.00 |
Bound Mb |
Acetonitrile |
10.32 |
5.53 |
47.02 |
4.56 |
固定前后Km值变化很大,说明固定化改变了Mb和底物分子的相互作用。固定后Mb在乙腈和丙酮中kcat
值要远大于自由Mb,说明固定后Mb的催化活性高于自由Mb;而在乙醇中,固定后Mb的催化活性低于自由Mb。Km和kcat 值的同时降低,说明在乙醇体系中存在产物抑制,且已构成限速[18]。
2.4 有机溶剂对固定化Mb催化作用的影响
乙醇、丙酮及乙腈溶剂均具有极低的疏水度,但只有乙醇对固定后Mb扰动最强,这可能是由于乙醇分子中存在羟基,同生物分子Mb、产物分子以及载体magadiite表面的羟基有较强的氢键作用,导致乙醇分子很容易剥夺固定后Mb表面的水分子。乙腈及丙酮也具有较低的疏水度,但由于层板的保护作用,短时间内并不能迅速剥夺固定后Mb用于催化的“必需水”,因而固定后Mb在乙腈及丙酮溶剂中具有比自由Mb更高的催化活性及稳定性。
丁醇与苯乙醇之间具有很接近的疏水度,但固定后Mb在苯乙醇溶剂中却呈现出相对较高的催化活性,可能是由于苯乙醇带有较大的苯环,同丁醇分子相比,苯乙醇接近固定后Mb的活性中心有更大的空间位阻,不容易剥夺固定后Mb用于催化的“必需水”。由于含有羟基的有机溶剂对固定前后Mb的结构破坏较大,同其它有机溶剂相比,固定后Mb在含羟基的有机溶剂中具有较低地催化效率。
3 结论
[1] Zaks A, Klibanov A M. Science , 1984, 224 (4654): 1249
[2] Cambou B, Klibanov A M. J Am Chem Soc, 1984, 106 (9): 2687
[3] Whitesides G M, Wong C H. Angew Chem Int Ed Engl, 1985, 24 (8): 695
[4] Schmid A, Dordick J S, Hauer B, et al. Nature, 2001, 409 (6817): 258
[5] Fágáin C ó. Enzyme Microb Technol, 2003, 33 (2-3): 137
[6] Torres C, Otero C. J Mol Catal A: Chem, 1995, 97(2): 119
[7] Frings K, Koch M, Hartmeier W. Enzyme Microb Technol, 1999, 25 (3-5): 303
[8] Mccoy L F, Wong K P. Biochemistry, 1981, 20(11): 3062
[9] Klibanov A M, Mozhaeu V V, Biochem Biophys Res Commun, 1978, 83 (3): 1012
[10] Bindhu L V, Abraham E T. Biochem Eng J, 2003, 15 (1): 47
[11] Desantis G, Jones J B. Curr. Opin. Biotechnol., 1999, 10 (4): 324
[12] Durfor C N, Bolin R J, Sugasawara R J, et al. J Am Chem Soc, 1988, 110 (26): 8713
[13] Aslan Y, Tanriseven A. J Mol Catal B: Enzym, 2007, 45 (3-4): 73.
[14] Xu J H, Zhu J, Hu Y. Biotechnology, 1997, 7 (1): 1.
[15] Peng S, Gao Q, Wang Q, et al. Chem Mater, 2004, 16 (13): 2675
[16] Peng S, Gao Q, Shi J. Chem Lett, 2004, 33 (9): 1210
[17] Peng S, Gao Q, Chem J Chinese Universities, 2004, 25 (4): 603
[18] Guo Z, Bai S, Sun Y, Enzyme Microb Technol 2003, 32(7): 776