http://www.chemistrymag.org/cji/2009/115025pc.htm |
May.1,
2009 Vol.11 No.5 P.25 Copyright |
electrochemiluminescence detection
Wang Lixin, Sun Hanwen, Su Ming
(College of Chemistry and Environmental Science, Hebei University, Key Laboratory of
Analytical Science and Technology of Hebei Province, Baoding 071002,China)
Keywords Capillary electrophoresis;Electrochemiluminescence; Lomefloxacin;Proline;Human urine 毛细管电泳-电致化学发光同时测定尿液中的脯氨酸和洛美沙星
王立新 孙汉文 苏明
(河北大学化学与环境科学学院,河北省分析科学技术重点实验室,河北保定071002)
关键词 毛细管电泳;电化学发光;洛美沙星;脯氨酸;尿液
1 引言
脯氨酸(Proline)是一种氨基酸类药物。胶原蛋白中含有丰富的脯氨酸,在胶原蛋白的代谢中,脯氨酸通过羟基化形成羟脯氨酸,脯氨酸通过尿液排出体外。体液中脯氨酸含量的变化与多种疾病有关,如骨病、癌症、慢性尿毒症等[1]。 洛美沙星(Lomefloxacin)为第三代喹诺酮类广谱抗菌药,抗菌谱广、口服吸收好、能迅速分布到各组织、血液浓度高、半衰期长等,因此用于治疗敏感细菌引起的呼吸道感染,泌尿生殖系统感染,腹腔、胆道、肠道及伤寒等感染[2]。在临床药理研究中需适时检测和了解服药后不同阶段各组织中该药物的含量, 因此,建立灵敏、可靠、快速的分析方法是十分必要的。目前,测定脯氨酸的方法有分光光度法[3]、质谱法[4]、化学发光法[5]、液相色谱法[6]、毛细管电泳法[7]等。测定洛美沙星的方法有高效液相色谱法[8] 、荧光法[9] 、毛细管电泳法[10] 、流动注射化学发光法[11]等。
电致化学发光(ECL)结合了化学发光技术和电化学技术两者的优点,具有高灵敏度、高选择性,以及高的抗干扰能力,动态范围宽等优点,已广泛被应用于环境分析、食品分析、药物分析及免疫分析等分析领域。毛细管电泳(CE)分离-联吡啶钌[Ru(bpy)32+]电致化学发光检测是近年来发展的一种新方法, 已成功应用于一些胺类药物和氨基酸等生化物质的检测[12-15]。本实验通过优化毛细管电泳分离和电致化学发光检测条件,建立了有效分离和同时检测人体尿液中脯氨酸和洛美沙星的新方法。
2 实验部分
所有实验均在 MPI-B型毛细管电泳电化学发光检测仪(西安瑞迈电子科技有限公司)上完成。该检测仪由四部分组成:数控电化学恒电位仪(参数:电位范围, -10V - 0V; 电流范围, ±250 mA;参比电极输入阻抗,1012 Ω; 灵敏度,1×10-12─0.1A 共16个量程; 输入偏置电流,<50 pA; 电位增量, 1mV; 扫描速率,0.0001- 200V/S),数控毛细管电泳高压电源(参数:输出电压, 0─20 kV; 输出电流,0─300mA),多功能化学发光检测仪(参数:波长范围, 300─650 nm,SP>1000A/Lm) 和多通道数据采集分析仪。电化学发光强度的输出信号由计算机记录并放大。未涂敷毛细管(50 cm×25 mm i.d)在首次使用前,用0.1 mol/L 的NaOH过夜处理,然后用二次蒸馏水和运行缓冲液分别冲洗30 min。为获得良好的重现性,每两次电泳操作之间,依次用二次蒸馏水和缓冲溶液冲洗毛细管各2 min。
三电极工作体系用于对电化学发光电位的控制,铂丝作为对电极,Ag/AgCl为参比电极,300 mm直径的铂盘电极作为工作电极,毛细管与工作电极的间距为70 mm。工作电极在使用前首先用0.3 mm的氧化铝粉末打磨平整并用蒸馏水超声洗净,在每次检测之前对电极施加-0.5 V的电压以除去电极表面的氧化层。pHS-25型酸度计(上海雷磁分析仪器厂)。
2.2 试剂和溶液
联吡啶钌(TBR)、L-脯氨酸由Sigma-Aldrich公司购得,洛美沙星标准品(中国药品生物制品检定所,批号为:0452-200001)。试剂公司),磷酸二氢钠、磷酸氢二钠、三氯乙酸和盐酸等试剂为分析纯(西安化学试剂厂)。所有溶液皆用经Milli-Q系统制备的水配制,并保存在冰箱中(4ºC)。
洛美沙星标准溶液(0.5 mg/mL): 准确称取25 mg洛美沙星标准品(中国药品生物制品检定所,批号为:0452-200001)于烧杯中,加入0.1 mol/L NaOH溶液2.5 mL使其溶解,定量转移至50 mL棕色容量瓶中,用水稀至标线,即得浓度为0.5 mg/mL的标准溶液,于4℃冰箱中保存,使用时用水稀至所需浓度。脯氨酸标准溶液(0.5mg/mL):准确称取25 mg脯氨酸(Sigma)于烧杯中,加入适量水使其溶解,定量转移至50 mL棕色容量瓶中,用水稀至标线,即得浓度为0.5 mg/mL的标准溶液,于4℃冰箱中保存,使用时以水稀至所需浓度。
2.3 毛细管电泳分离和检测条件
取人新鲜尿液500 mL于1.5 mL离心试管中,加入500 mL浓度为1%三氯乙酸充分震荡5 min,使尿蛋白沉淀,再4000 r/min离心10 min,取上清液过滤后直接测定。
样品采用电动进样方式,进样电压为10 kV,进样时间为10 s,分离电压为15 kV, 25 mmol/L的磷酸盐缓冲溶液(pH=11.20)用于电泳流动相。为获得良好的重现性,分析前毛细管柱依次用0.1 mol/L氢氧化钠冲洗1min、去离子水冲洗2 min、电泳流动相冲洗2 min。300 mL含有5 mmol/L TBR的50mmol/L的磷酸盐缓冲液(pH=8.0)用作电化学发光溶液加入到电化学发光检测池中,进行电化学发光测定,以峰高定量。
3 结果与讨论
在CE-ECL体系中,在毛细管内壁状况、尺寸和进样方式等条件确定时,分离缓冲液的pH和浓度是影响CE分离的主要因素。经在pH 5.19 - 1.32范围内考察分离缓冲液pH对脯氨酸和洛美沙星分离的影响。脯氨酸和洛美沙星的分离度采用Rs =2(t2-t1)/(Wb1 +Wb2) 公式计算,t1和t2分别表示脯氨酸和洛美沙星的迁移时间,Wb1和Wb2分别表示脯氨酸和洛美沙星的峰底宽。在所研究的pH范围内,其分离度Rs>6。虽然脯氨酸和洛美沙星可以完全分开,但ECL强度有一定的变化,如图1所示:在pH为11.20时洛美沙星的ECL强度达到最大值,而脯氨酸的ECL强度并非最大,但在此酸度下二者的分离度较高。所以选择pH为11.20的分离缓冲溶液。
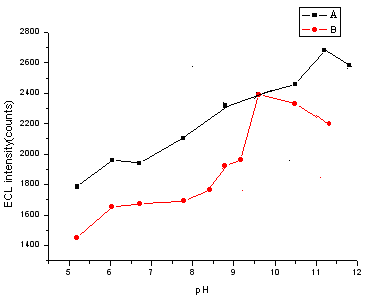
图1 毛细管中磷酸盐缓冲溶液pH值对洛美沙星(A)和脯氨酸(B) ECL强度的影响
Fig.1 The effect of pH of the phosphate buffer in capillary on ECL intensity of Lomefloxacin (A) and Proline (B)
分离缓冲液浓度在10 - 70 mmol/L范围内,浓度从10 - 25 mmol/L增大, 脯氨酸和洛美沙星的ECL强度也随着增大,但达到25 mmol/L以后,随着浓度的增大,二者的ECL强度反而都降低,且保留时间增大。综合考虑ECL强度和保留时间,最适分离缓冲液浓度为25 mmol/L。
3.2 TBR的浓度对检测信号的影响
实验结果表明,脯氨酸和洛美沙星的电化学发光峰值随着检测池体溶液中TBR浓度的增加而明显增大。虽然提高TBR浓度对提高检测的灵敏度是有利的,但由于TBR是比较昂贵的试剂,采用更高浓度的TBR显然是不可取的,因此在本实验中采用5 mmol/L的TBR溶液浓度。
3.3 检测池中缓冲溶液pH和浓度对检测信号的影响
当检测池中磷酸盐缓冲溶液在pH 4.66- 11.08范围内变化时,脯氨酸和洛美沙星的ECL强度的相应变化如图2所示。洛美沙星的ECL强度随pH值的增大而减小, 而脯氨酸的ECL强度在pH为8.0左右到最大值。考虑到洛美沙星和脯氨酸两方面的因素,选择检测池中缓冲溶液的pH值为8.0。
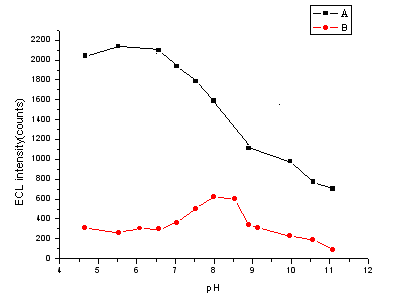
图2 检测池中磷酸盐缓冲溶液pH值对洛美沙星(A)和脯氨酸(B)
ECL强度的影响
Fig.2 The effect of pH of the
phosphate buffer in ECL cell on ECL intensity of Lomefloxacin (A) and Proline (B)
进一步考察了电解池中磷酸盐缓冲溶液的浓度对电化学发光强度的影响。结果表明,随着缓冲溶液浓度的增加,洛美沙星在缓冲溶液浓度为40
mmol/L时ECL强度达到最大值,此后ECL强度反而降低。而脯氨酸的ECL强度随缓冲溶液浓度变化不大,固选取缓冲溶液浓度为40
mmol/L。
3.4 进样电压和进样时间对检测信号的影响
进样体积由进样时间和进样电压控制,其大小不仅影响发光强度,也影响峰形。随着进样电压从7
kV增大到13 kV,进样时间从4 s增加到15 s,电致化学发光强度也随之增强。但是若进样电压过高,电极表面的分析物不能立即反应而会扩散进溶液,则导致电致化学发光峰展宽且理论塔板数降低[16]。为了获得较强的ECL信号和较好的分离效果,最佳进样电压和进样时间分别设为10
kV和10 s。
3.5 分离电压和检测电位对检测信号的影响
分离电压是影响分离度和分析时间的重要因素。分离电压在4.0-20kV之间,
分离时间随着分离电压的增大而缩短,但未发现电致化学发光强度有明显变化。考虑到合适的分离时间,选取15
kV为分离电压。
由于施加在电极上的电压对光发射化学反应速率有一定影响,将影响发射光强度。电压从1.0V增加到1.3V时,ECL响应也随之增强,但电压大于1.3V后,响应反而降低,而当电压高于1.35V时,水的氧化反应对电致化学发光强度可能起负面作用。因此在以下的实验中,将最佳检测电位设为1.23V。
3.6 场致效应对检测信号的影响
在样品电动进样之前,若注如一段水塞可以提高富集效果,这是因为在电动进样时,水塞提供的高电场使更多的分析物可以集聚在水塞和待分离溶液的界面,而且可以使样品离子更深入到毛细管柱中而不是只停留在毛细管的进口端。当电渗流的方向与样品离子的电泳方向相同时,水塞的加入并不能使峰形变好和峰面积增加。而当电渗流的方向与样品离子的电泳方向相反时或样品是溶于高导基质中,则有必要在毛细管中加入一段水塞。因为进样体积受进样时间的影响,试验了2-20
s之间的不同蒸馏水进样时间。发现从进样时间2至10 s,峰高随蒸馏水进样时间的增大而增高,峰形也有一定程度的改善,但进样时间大于10
s,其峰高和峰形没有显著变化。因此,进蒸馏水的时间设为10 s为宜。
3.7 反应机理
联吡啶钌的ECL是由于激发态的Ru(bpy)32+*所致,其发光波长为620
nm [16]。 通过电极对脯氨酸-洛美沙星-联吡啶钌化学发光体系施加一定的电压,导致联吡啶钌被氧化,氧化产物Ru(bpy)33+继而氧化分析物,
产生的Ru(bpy)3+与Ru(bpy)33+之间发生反应而产生激发态的发光物质Ru(bpy)32+*
当其返回到基态时则发光。本体系的发光机理可以描述如下:
Ru(bpy)32+→ Ru(bpy)33+ + e-(Anode)
Ru(bpy)33+ + Pro → Ru(bpy)3+ + Oxidised Pro
Ru(bpy)33+ + PPA → Ru(bpy)3+ + Oxidised PPA
Ru(bpy)3+ + Ru(bpy)33+ → Ru(bpy)32+*
+ Ru(bpy)32+
Ru(bpy)32+*→ Ru(bpy)32+ + hv (620 nm)
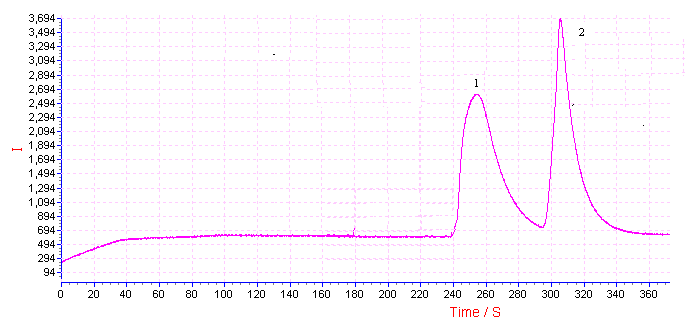
图3 尿液中脯氨酸(1)和洛美沙星(2)的毛细管电泳图
Fig.3 Electropherograms of
proline(1) and lomefloxacin (2) in human urine
3.8 线性范围、精密度和检出限
在优化的实验条件下,脯氨酸的线性范围为0.1-80 mg/mL,线性方程为y =76.8x+152.1,相关系数r
= 0.998。检出限为0.03 mg/mL;洛美沙星的线性范围为0.2-80 mg/mL,线性方程为y=46.5x+538.6,相关系数 r
= 0.998,检出限为0.06 mg/mL。对6 μg/mL的脯氨酸和洛美沙星的标准混合液连续11次测定,脯氨酸的峰高和迁移时间的相对标准偏差分别为3.2%和1.0%,洛美沙星的峰高和迁移时间的相对标准偏差分别为3.7%和1.2%。
3.9 尿样分析
据文献报道[17],正常人单次口服剂量400
mg时,平均血药峰浓度分别可达3.4 mg/L,24 h时血药浓度为0.3 mg/L;给药后24~48
h,尿中药物浓度有30.8 mg/L,尿中药物浓度较高,48 h内可由尿排出给药量的68%。取健康志愿者口服400
mg洛美沙星胶囊一定时间后的尿液,经脱蛋白处理后进行测定。
最佳分离和测定条件为:检测电位,1.23V;电化学发光溶液,50mmol/L磷酸盐(pH=8.0)和5
mmol/L TBR;电泳流动相,25 mmol/L磷酸盐(pH=11.20); 分离电压,15 kV;采样电压,10
kV;采样时间,10 s。CE-ECL谱图如图3所示,脯氨酸和洛美沙星得到有效分离。样品测定后,添加适量的脯氨酸和洛美沙星标准液进行回收实验,检测结果见表1。脯氨酸和洛美沙星的回收率在94.2%-97.2%范围内,
相对标准偏差为4.3-4.7%。
表1 尿样测定结果与回收率
Table 1 Determination
results and recovery of the urine samples
分析物 |
时间 |
含量 Content (mg/mL) |
加入量 |
测得值 |
回收率 |
相对标准偏差 |
脯氨酸 |
4 |
910.9 |
50 |
959.1 |
96.4 |
4.7 |
12 |
853.5 |
50 |
902.1 |
97.2 |
3.8 |
|
24 |
898.2 |
50 |
945.3 |
94.2 |
4.3 |
|
洛美沙星 |
4 |
22.3 |
20 |
41.5 |
96.0 |
4.4 |
12 |
15.7 |
20 |
35.0 |
96.5 |
4.7 |
|
24 |
11.5 |
20 |
30.4 |
94.5 |
4.3 |
4.结论
REFERENCES
[1] Inoue H, Kohashi K, Tsuruta Y. Ana.l Chim. Acta, 1998,365 (1-3): 219 -226
[2] Marrot L, Belaïdi J P, Jones C. et al. J. Inves.t Dermato, 2003, 121 : 596-606
[4] Goshe M B, Anderson V E. Anal. Biochem., 1995, 231(2): 387-392
[5] Costin J W, Barnett N W, Lewis SW. Talanta, 2004, 64(4): 894 -898
[6] Harada M. Anal. Chim. Acta, 1997, 352(1-3): 179-185
[7] 薛静,梁恒,李甜, 等.分析化学, 2005, 33 (6): 785-788
[8] Santoro Maria Inês R M, Kassab Nájla M, Singh Anil K, et al. J. pharm. Biomed. Anal, 2006, 40(1): 179-184
[9] Du Li-ming, Xu Qing-qin, Yuan Jian-mei. J. pharm. Biome.d Anal., 2003, 33(4): 693-698
[10] Sun Han-wen, He Pan, Lv Yun-kai, et al. J. Chromatog.r B, 2007, 852 (1-2): 145-151
[11] Wang Lun, Yang Ping, Li Yong-xin, et al. Talanta, 2007, 72 (3): 1066-1072
[12] Liu J F, Cao W D, Qiu H B, et al. Clin. Chem., 2002, 48 (7): 1049-1058
[13] Liu J F, Yang X R, Wang E K. Electrophoresis, 2003, 24 (18): 3131-3138
[14] Wang X, Bobbitt D R. Anal. Chim. Acta, 1999, 383 (3): 213-220
[15] Chiang M T, Whang C W. J. Chromatogr. A, 2001, 934 (1-2): 59-66
[16] Liu Ying-ju, Zhou Wu-yi. Anal. Sci., 2006, 22 (7): 999
[17] 施耀国, 曹忆堇, 王磊,等. 中国抗生素杂志, 1994, 19 (4): 248-252