http://www.chemistrymag.org/cji/2002/045023rc.htm |
Apr. 1, 2002 Vol.4 No.5 P.23 Copyright |
Ionic Liquids in Green
Chemistry
Yu Tianxiang, Zheng Qiong
(College of chemistry and Molecular Sciences , Wuhan University Wuhan 430072)
Abstract The characteristic of ionic
liquids and its application in chemical reaction were reviewed . Ionic liquids as green
solvent can be performed widely in the future.
Keywords Green Chemistry, Green Solvent, Ionic liquids
绿色化学中的离子液体
余天祥 郑 穹(武汉大学化学与分子科学学院 武汉 430072) 摘要 本文评述了离子液体的一般性质及其在一系列化学反应中的应用,并且展望了它作为绿色溶剂的将来。
关键词 绿色化学 绿色溶剂 离子液体
迄今,绝大多数化学反应都在分子溶剂中进行,如水和多数常见的有机溶剂。近年来一种新的溶剂-离子液体的出现引起了各国学者的关注。该溶剂在室温下是流质(也称为室温离子液),而组成是离子系列的,组成该溶剂至少有两种成份,即可变换的阳离子和阴离子。由于该溶剂可按利用者的需要或具某些特种性质而设计,所以又称之为“设计者溶剂”。离子液体既可作溶剂又可作催化剂,在该液体中进行反应的热力学和动力学与在普通溶剂中有所不同的,一般说来,离子液体对热稳定,不可燃,不挥发,不氧化,不爆炸,低毒性,故用于合成反应中是清洁友好的。已有的报导证明,离子液体增加了反应的活性、选择性及催化剂的稳定性等,更深地探索会发现一些新的不可预见的事物,激发人们聚焦于此的原因还在于人们一直倡导绿色化学和绿色合成。
离子液体的领域已有综述,它包括Welton [1],Wasserscheid 和Keim[2],以及Freemantle[3],特别是长期从事这一领域研究的Seddon等[4]。第一个常温离子液体[EtNH3][NO3](mp. 12 ℃)于1914年发现,但仅在上世纪七十年后才有新的进展[5、6]。离子液体包括两大类:一类是简单的盐,由有机阳离子和阴离子组成,有机阳离子通常包括有季铵阳离子、季膦盐阳离子、杂环芳香化合物及天然产物的衍生物等,其中常见的是咪唑盐,如

另一类是二元离子液体(即含有平衡的盐)。例,AlCl3(Ⅲ)和氯化1-甲基-3-乙基咪唑盐的混合物,它含有几种不同的离子系列,它们的熔点和性质取决于组成,常用[C2mim]Cl-AlCl3来表示这个络合物。
离子溶液被称为“设计者溶剂”,那么它的熔点,粘度,密度和疏水等性能可用简单地变换离子结构来控制。如[Rmim]BF4的烷基链长(C数)小于6时,在25° C时与水混溶,当链长大于6时,它就与水不混溶了,这种行为对反应的选择和产物萃取和分离有利。
离子液体在反应中典型作溶剂或催化剂,反应后用醚萃取或用超临界的CO2来萃取产物[7a],且非水溶性离子液体本身可用水洗也可用超临界CO2再生[7b]。
1 在离子液体中的过渡金属催化氢化和偶联等反应
离子液体作溶剂的过渡金属催化氢化反应已有大量报导[1、2],它一方面作溶剂,又作共催化剂(cocatalyst),与水和其它普通有机溶剂相比,离子液体是催化剂又是很好的溶剂,它使催化活性稳定。如1-戊烯成功地氢化[8]
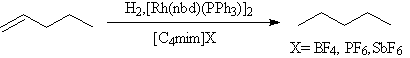
在
[C4mim]SbF6中氢化比在丙酮中快五倍,催化剂均可重复操作。立体选择性氢化在离子液体中也成功完成[2]。如2,4-己二烯酸的氢化: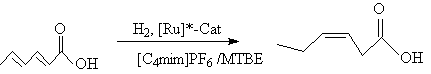
顺 – 3 – 已烯酸 85%
如在极性溶剂乙二醇中进行,选择性大三倍。
对映体选择氢化亦有报道[9],2-芳基丙烯酸氢化为熟知的药物萘普生(Naproxen),其对映体选择性达80%ee,如:
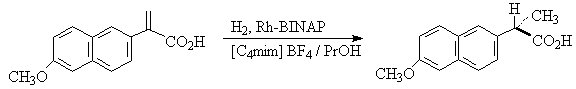
(S)- 萘普生
除了氢化外,烯烃的环氧化[12]和烯的甲酰化[8]也有报导。利用PdCl2,Pd(OAc)2 在[C4mim][BF4]或[C4mim][PF6]中进行二烯的二聚化反应,产物主要是2,7-辛二烯-1-醇,1,3,6-辛三烯是次要产物[11]
![]()
离子液体用于钯催化的Heck反应1996年有所描述[12],溴苯与与丙烯酸丁酯反应得高产率偶联产物反-肉桂酸酯。如反应:

该反应的特点是该离子液体对钯有稳定作用,整个反应中未见钯沉淀出来。钯催化的Suzuki交叉偶联反应是C-C成键反应,也很成功[13]

另外钯催化的烯丙基取代的Trost-Tsuji偶联在离子液体[C4mim][BF4]中得90%的高产率产物[14],这归于增加了催化活性及底物分子在该离子液体中有较好的溶解度。
2 Friedel-Crafts反应及含氯化铝的离子液体
氯化铝与适量的有机碱在惰性气体中熔融,这个离子液体最好用x(AlCl3)的摩尔分数来描述,一般x(AlCl3)<0.5,含过量的Clˉ离子,称为碱性的,x(AlCl3)>0.5,含过量的[Al2Cl7ˉ],称为酸性的,x=0.5称为中性的,如以下含[C2mim]的氯化铝的盐为[2]
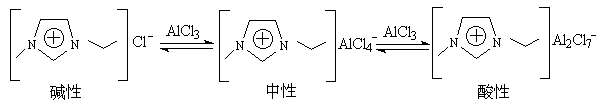
经典的Friedel-Crafts反应用路易斯酸所催化,研究发现,许多Friedel-Crafts反应在离子液体中进行反应很顺利[15、16],许多香料分子可高产率地获得,且具选择性,如
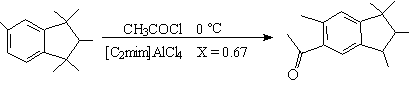 99%
99%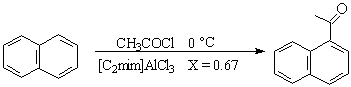 89% a位; 2% b位
89% a位; 2% b位邓有全等[16]在含HCl的离子液体[C2mim]AlCl3中,用1-十二碳烯对苯的烷基化反应,得到了较好地产物异构体分配,作者认为HCl的存在,离子液体的超酸性(superacidity)起了作用,二茂铁的酰化也有成功的报导[18]。
含AlCl3的离子液体一般见水会分解,故操作一般在无水及惰性气体下进行。
3 亲核取代反应及芳烃取代中的离子液体
脂肪族亲核取代反应利用相转移(PTC)法较好,通常要用到二氯甲烷、甲苯和氯苯作溶剂,由于卤代烃的使用越来越受到限制,离子液体作溶剂及催化亲核取代反应自然受到重视,它一方面能活化阴离子,且离子液体的阳离子部分或许像PTC一样是有效地催化剂,如氯苄与氰化物的反应:

该反应的动力学试验表明有很高的反应速率。[19]
吲哚和萘酚用RX和NaOH反应,可在O上或N上烷基化,在离子液体[C4mim][PF6]中得到了与在DMF和DMSO中类似的反应速率,萘酚主要是O-烷基化,吲哚主要是N上烷基化;处理很方便,离子液体可循环再用,克服了使用高沸点的非质子极性溶剂DMF等难从产物中除尽的困难,所以作者认为是清洁的合成方法。[20]
近来,有关其芳香重氮盐被氟取代在离子液体中进行,取得了相当的进展,[21]操作简便,产率几乎定量,离子液体可回收数次。在离子液体中的硝化也是有效地改变经典的硝化方法,克服了传统地要中和反应后强酸性液体的弊病。[3a]
4 在离子液体中的插入反应和Wittig反应
在离子液体[C4mim][PF6]或[C4mim][BF4]中,卤代烷与硫化物反应,形成硫叶立德,该反应可将亚甲基转移到芳醛或芳酮中,[4] 后者,有好的对映体过量。
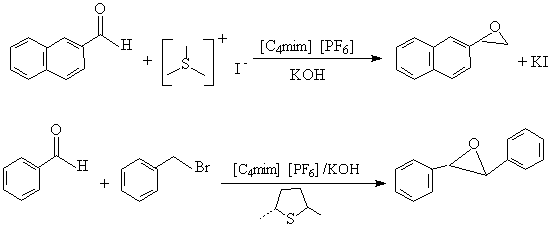
Wittig反应是醛或酮与磷叶立德生成烯的反应,该反应用[C4mim][BF4]作溶剂,产物烯易于与副产物Ph3P=O分离,且能有效的回收溶剂,具优良的立体控制。[22]
Y=COMe, CO2Me, CN
有机金属试剂与羰基化合物的加成在有机化学中是一重要反应,如烯丙基锡与醛反应生成烯醇的反应,
[23]三烷基硼与醛反应,[24]在离子液体中反应良好,且离子液本身可再生循环利用。5 Diels-Alder反应
环戊二烯和丙烯酸酯的反应在一系列离子液体中反应早有报导。[25]
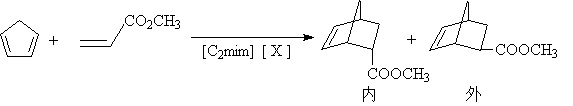
X=BF4―,ClO4― CF3SO3― ,NO3― PF6―
实验表明这些反应比在非水溶剂中进行,选择性和反应速率都增加,但没有在水中那么大,那些对水敏感的底物在离子液体中进行反应,具有优点,如在离子中加入少量的路易斯酸如
ZnI2,可改善立体选择性[26]
6 在离子液体中的酶催化反应和其它形式的生物转化
最引人注目的是人造甜味剂阿斯巴甜(Aspartame)的酶催化合成[3],产率91%。
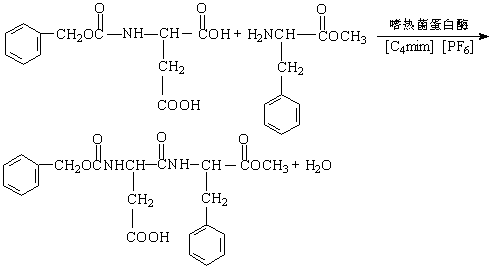
Freemantle[3]表明,像念珠菌(Candida antarctica)和嗜热菌(Thermolysin)等水解酶在离子液体中能有效地催化酰胺、酯和过酸的生成,该工作对药物合成,农药中间体,香料、香精的制造等都很有利。例环己烯由过辛酸在离子液体[C4mim][PF6]中环氧化的研究,过辛酸是由辛酸在脂肪酶催化下在离子液体[C4mim]BF4中与水溶液过氧化氢反应得到,收率83%。一种红球菌(Rodococcus)R312细胞生物催化剂在两相中即离子液体[C4mim]PF6/水中促进腈转化为酰胺。
同样,利用无水的[C4mim] PF6,丁酸乙酯用正丁醇的转酯化研究效果也很好,收率81%[3]。
7 其它
离子液体的研究和应用的前景非常广阔,它不仅用于化学合成,精细化工,高聚物如烯的二聚,齐聚,线性烷基苯的合成等方面外,而且在催化,分离技术和蓄电池,太阳能电池的电解质中也有应用[3],例如离子液体可用于核燃料的循环,将废的核燃料溶于加有氧化剂的离子液体中,如1-丁基吡啶硝酸盐中,由于有氧化剂,使燃料金属由不溶变成可溶,因为铀(IV)变成铀(VI),钚(IV)变成钚(VI)。而现有使用的煤油及磷酸三丁酯可由离子液体替代[3]。一特别设计的离子液体,例在咪唑阳离子上,将烷基部分连接一些特殊的官能团[27],或制备一些不同的多胺盐[28]应用于有机反应和萃取分离的研究,如:
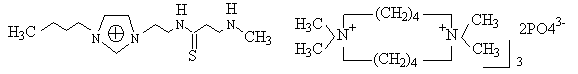
这是离子液体新的进展。
Seddon等人[4]完成了在离子液体中一药物(Pravadoline)的全合成,它包括Friedel-Crafts反应和亲核取代反应两步。第一步反应2-甲吲哚与N-吗啉-2-氯乙烷在[C4mim][PF6]中反应,产率为95%,
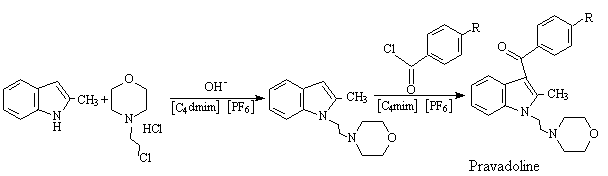
如改用1-丁基-2,3-二甲基咪唑六氟化磷[C4dmim] [PF6]后,产率可达99%。第二步用含AlCl3的离子液体在0℃进行,而最好的结果是不用AlCl3,用[C4mim] [PF6]于150℃下反应。第二步无铝盐存在,反应程序简单廉价,且废弃物大大减少,这显示出“绿色溶剂”强大的生命力。
毋用置疑,离子液体在绿色化学中占有重要的地位,预计在不久将来,离子液体的应用研究会更深入,更广泛,在工业上如化学工业等方面会越来越多地采用离子液体。 REFERENCES
[1] Welton T. Chem . Rev., 1999, 99: 2071.
[2] Wasserscheid P, Keim W. Angew Chem. .Int. Ed. Engl., 2000, 39: 3722.
[3] Freemantle M. (a) Chem . Eng . News, 2000, 78 (May)15: 37-39; (b) Chem . Eng . News, 2001, 79 (Jan)1: 21-25.
[4] Earle M J, Seddon K R. Pure Appl, Chem., 2000, 72 (7): 1391-1398.
[5] Chum H L, Koch V N et al. J. Am. Chem, Soc., 1975, 97: 3264 .
[6] Wilkes JS et al . Inorg . Chem., 1982, 21: 1236.
[7] a) Blanchard L A et al. Nature, 1999, 399: 28; b) Blanchard L A et al. Ind. Egn. Chem. Res., 2001, 40: 287.
[8] Chauvin Y, Mubmann L, Olivier H. Angew. Chem. Int. Engl., 1995, 34: 2698.
[9] Monteiro A L et al. Tetrahedron Asymmetry, 1997, 2: 177-179.
[10] Song C E, Roh E J. Chem. Commun., 2000: 837-838.
[11] Dullins J E L et al. Organometallics, 1998, 17: 815.
[12] Kakfman D E et al. Synlett., 1996: 1091.
[13] Mathews C J, Smith P J, Welton T. Chem. Commun., 2000: 1249-1250.
[14] Bellefon C de et al . J. Mol . Catal., 1999, 145: 121.
[15] Adam C J et al. Chem. Commun., 1998: 2097-2098.
[16] Boon J A et al. J. Org. Chem., 1986, 51: 48.
[17] Kun Qian, Yonquan Deng. J. Mol. Catal. A: Chem., 2001, 171: 81-84.
[18] Surretle J K D, Green L, Singer R D. Chem. Commun., 1996: 2753-2754.
[19] Wheeler C et al . Chem. Commun., 2001: 887.
[20] Earle M J, McCormac P B, Seddon K R. Chem. Commun, 1998: 2245.
[21] Hagiwara R, Ito Y J. Fluorine Chem., 2000, 105: 221.
[22] Boularre V L, Gree R. Chem. Commun., 2000: 2195-2196.
[23] Gordone L M, McClusky A. Chem. Commun., 1999: 1431-1432.
[24] Kanalka G W, Maladi R R. Chem. Commun., 2000: 2191.
[25] Fischer F, Sethi A , Welton T et al. Tetranedron letters, 1999, 40: 793-796.
[26] Earle M J, McCormac P B, Seddon K R. Gree. Chem., 1999, 1:23-25.
[27] Visser A E, Swatloski R P, Reichert W M et al. Chem. Commun., 2001: 135.
[28] Lall S I, Mancheno D, Castro S. Chem. Commun., 2000: 2413.